

Археология об основании Рима: Новые раскопки проясняют и такой острый дискуссионный вопрос, как дата самого возникновения Рима...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Археология об основании Рима: Новые раскопки проясняют и такой острый дискуссионный вопрос, как дата самого возникновения Рима...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...
Топ:
Особенности труда и отдыха в условиях низких температур: К работам при низких температурах на открытом воздухе и в не отапливаемых помещениях допускаются лица не моложе 18 лет, прошедшие...
Установка замедленного коксования: Чем выше температура и ниже давление, тем место разрыва углеродной цепи всё больше смещается к её концу и значительно возрастает...
Интересное:
Средства для ингаляционного наркоза: Наркоз наступает в результате вдыхания (ингаляции) средств, которое осуществляют или с помощью маски...
Национальное богатство страны и его составляющие: для оценки элементов национального богатства используются...
Мероприятия для защиты от морозного пучения грунтов: Инженерная защита от морозного (криогенного) пучения грунтов необходима для легких малоэтажных зданий и других сооружений...
Дисциплины:
|
из
5.00
|
Заказать работу |
Содержание книги
Поиск на нашем сайте
|
|
|
|
Конфигурация D,L-стереоизомерия открытых форм моносах. Энантиомеры и эпимеры. Реакции циклизации моносах с образ-ем пиранозн и фуранозн циклов, α,β-аномерные формы. Преобразование ф-л Фишера в ф-лы Хеуорса. Цикло-оксотаутомерия.
Моносах – это полигидроксикарбонильные соединения, в которых каждый атом углерода (кроме карбонильного) связан с группой ОН. Общая формула моносахаридов – Сn(H2O)n, где n =3-9. Их классифицир по: 1)прир карб-й гр 2) по длине углер цепи.. По химическому строению различают: альдозы – моносахариды, содержащие альдегидную группу; кетозы – моносахари. ды, содержащие кетонную группу (как правило, в положении 2). 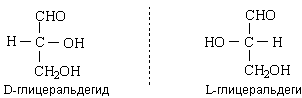 В зависимости от длины углеродной цепи моносахариды делятся на триозы, тетрозы, пентозы, гексозы и т.д. Обычно моносахариды классифицируют с учетом сразу двух этих признаков. Стереоизомерия. Общее кол-во изомеров определется по ф-ле Фишера N=2n. у кетоз по сравн с альдозами на один ассим ат С меньше. Все моносахариды содержат хиральные атомы углерода и имеют стереоизомеры. Простейшая альдоза, глицериновый альдегид, содержит один хиральный атом С и существует в виде двух оптических изомеров – D и L: По мере увеличения длины цепи количество стереоизомеров у альдогексоз растет. В зависимости от конфигурации наиболее удаленного от карбонильной группы хирального атома С все моносахариды делят на два стереохимических ряда – D-моносахариды и L-моносахариды:
В зависимости от длины углеродной цепи моносахариды делятся на триозы, тетрозы, пентозы, гексозы и т.д. Обычно моносахариды классифицируют с учетом сразу двух этих признаков. Стереоизомерия. Общее кол-во изомеров определется по ф-ле Фишера N=2n. у кетоз по сравн с альдозами на один ассим ат С меньше. Все моносахариды содержат хиральные атомы углерода и имеют стереоизомеры. Простейшая альдоза, глицериновый альдегид, содержит один хиральный атом С и существует в виде двух оптических изомеров – D и L: По мере увеличения длины цепи количество стереоизомеров у альдогексоз растет. В зависимости от конфигурации наиболее удаленного от карбонильной группы хирального атома С все моносахариды делят на два стереохимических ряда – D-моносахариды и L-моносахариды: 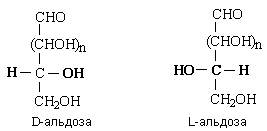 с конфигурацией ассимитричного атома угрерода глицерин альд-да сравн-ся конфиг-я наиболее удал-го ат С от карбонильн гр. Подавляющее большинство природных моносахаридов принадлежит к D-ряду. Между собой D-альдозы с одинаковым числом атомов углерода (D-альдотетрозы, D-альдопентозы, D-альдогексозы и т.д.) являются диастереомерами. Среди них выделяют особый тип диастереомеров, который называют эпимерами. Эпимеры – это диастереомеры, которые отличаются по конфигурации только одного хирального центра. Энантиомером – предмет и его зеркальное отраж-е.для D-глюкозы является L-глюкоза, D-маннозы – L-манноза и т.д
с конфигурацией ассимитричного атома угрерода глицерин альд-да сравн-ся конфиг-я наиболее удал-го ат С от карбонильн гр. Подавляющее большинство природных моносахаридов принадлежит к D-ряду. Между собой D-альдозы с одинаковым числом атомов углерода (D-альдотетрозы, D-альдопентозы, D-альдогексозы и т.д.) являются диастереомерами. Среди них выделяют особый тип диастереомеров, который называют эпимерами. Эпимеры – это диастереомеры, которые отличаются по конфигурации только одного хирального центра. Энантиомером – предмет и его зеркальное отраж-е.для D-глюкозы является L-глюкоза, D-маннозы – L-манноза и т.д  В природе широко распространены гексозы (D-глюкоза, D-галактоза, D-манноза, D-фруктоза) и пентозы (D-рибоза, D-ксилоза, D-арабиноза). Циклич формы моносах по хим прир явл-ся циклич полуацеталями. Они обр-ся за сч вз-я альд-й и 1 из OH гр. В рез этого при замыкании цикла из 1 открыт формы обр-ся 2 циклич полуацетальн формы.ю отл-ся расп-ем гилроксила, кот наз-ют гликозидным. Циклич ф-лы наз-ся проекц ф-ми Колли-Толленса.
В природе широко распространены гексозы (D-глюкоза, D-галактоза, D-манноза, D-фруктоза) и пентозы (D-рибоза, D-ксилоза, D-арабиноза). Циклич формы моносах по хим прир явл-ся циклич полуацеталями. Они обр-ся за сч вз-я альд-й и 1 из OH гр. В рез этого при замыкании цикла из 1 открыт формы обр-ся 2 циклич полуацетальн формы.ю отл-ся расп-ем гилроксила, кот наз-ют гликозидным. Циклич ф-лы наз-ся проекц ф-ми Колли-Толленса.
Для циклич форм моносах приняты перспективн ф-лы Хеуорса, в кот циклы изобр-ся в виде плоск многоугольн, лежащ перпендик-но полск-ти рис, ат кислорода расп в дальнем прав углу в пиранозн цикле, и за плоск-ю цикла в фуранозн, символы ат С не пищ-ся, зам-ли расп-ся выше и ниже плоск-ти кольца. Цикло-оксо-таутомерия. Карбонильная и гидроксильная группы моносахаридов взаимодействуют внутримолекулярно с образованием циклического полуацеталя: При этом возникает новый хиральный центр – бывший карбонильный, а теперь аномерный атом углерода. Наиболее устойчивы циклические полуацетали, содержащие шестичленный (пиранозный) или пятичленный (фуранозный) циклы. Они образуются при взаимодействии альдегидной группы с гидроксильной группой в положении 5 или 4 моносахарида соответственно. На рисунке представлена схема образования циклических форм D-глюкозы:
|
|
Возникновение нового хирального центра приводит к появлению 2-х стереоизомеров для каждой из циклической форм - - и - аномеров.
Аномеры – это эпимеры, которые различаются по конфигурации аномерного атома углерода. У -аномера конфигурация аномерного центра совпадает с конфигурацией концевого хирального атома С, у -аномера она противоположна. Циклические формы моносахаридов изображают с помощью формул Хеуорса. Молекулу представляют в виде плоского цикла, перпендикулярного плоскости рисунка. Заместители, находившиеся в формуле Фишера слева, располагают над плоскостью цикла, справа – под плоскостью. Для определения положения группы СН2ОН в формуле Фишера предварительно делают две перестановки.
В кристаллическом состоянии моносахариды находятся в одной из циклических форм. При растворении образуется равновесная смесь линейной и циклических форм. Их относительное содержание определяется термодинамической стабильностью. Циклические, особенно пиранозные формы, энергетически более выгодны для большинства моносахаридов.
Существование равновесия между линейной и циклическими формами моносахаридов получило название цикло-оксо-таутомерии. Явление изменения удельного вращения свежеприготовленного раствора моносахарида называют мутаротацией. Явление мутаротации – одно из доказательств существования цикло-оксо-таутомерии у моносахаридов.
|
|
39) Методы концентрирования и разделения веществ. Разделение это процесс в результате которого компонент входящии в состав исходной смеси отделяются друг от друга. Концентрирование – процесс повышения концентрации микрокомпонента относительно конц. макрокомп. Концентрирование может быть относительным и абсолютным. Абсолютным конц.-перевод микрокомп из большого объема или массы в малый объем (экстракция). Относит. конц. (обогащение)-разделение комп при резкоразличной их конц, чаще для руд. Наиболее распространённые методы концентрирования: выпаривание, испарение, озоление – термической обработкой сырье переводится в золу, соосаждение, осаждение, кристаллизация, экстракция, электрохимические, хроматографические. Важной характеристикой экстракции является фактор (или степень) извлечения R = n (A) / n (A)нач , где n (A) – колв в-ва в органической фазе;n (A)нач - начальное колв в-ва в водном р-ре. Константа распределения вещества. Постоянная величина, выражающая отношение концентраций распределяемого вещества, находящегося в обеих фазах (после наступления равновесия) в одной и той же форме, называется константой распределения:
 где Р о — константа распределения: [А] о —концентрация вещества в фазе органического растворителя, моль/л; [А] В — концентрация вещества в водной фазе, моль/л.
где Р о — константа распределения: [А] о —концентрация вещества в фазе органического растворителя, моль/л; [А] В — концентрация вещества в водной фазе, моль/л.
Константа распределения вещества. Постоянная величина, выражающая отношение концентраций распределяемого вещества, находящегося в обеих фазах (после наступления равновесия) в одной и той же форме, называется константой распределения:
 где Р о — константа распределения: [А] о —концентрация вещества в фазе органического растворителя, моль/л; [А] В — концентрация вещества в водной фазе, моль/л. Области применения экстракции быстро расширяются. В настоящее время можно назвать аналитическую химию, радиохимию, ядерную технологию, технологию цветных и редких металлов. Кроме того, необходимо отметить большое значение экстракции для препаративных и аналитических целей в научных исследованиях, например при изучении процессов комплексообразования и состояния веществ в растворах. Развитие экстракционных методов достигло такой ступени, что в настоящее время можно экстрагировать любой элемент или разделить любую пару элементов путем применения тех или иных экстракционных систем или выбора соответствующих условий экстракции.
где Р о — константа распределения: [А] о —концентрация вещества в фазе органического растворителя, моль/л; [А] В — концентрация вещества в водной фазе, моль/л. Области применения экстракции быстро расширяются. В настоящее время можно назвать аналитическую химию, радиохимию, ядерную технологию, технологию цветных и редких металлов. Кроме того, необходимо отметить большое значение экстракции для препаративных и аналитических целей в научных исследованиях, например при изучении процессов комплексообразования и состояния веществ в растворах. Развитие экстракционных методов достигло такой ступени, что в настоящее время можно экстрагировать любой элемент или разделить любую пару элементов путем применения тех или иных экстракционных систем или выбора соответствующих условий экстракции.
Классификация полимеров
| Полимерами являются высокомолекулярные соединения, состоящие из одинаковых или различных звеньев, соединенных химическими связями в длинные цепи. Число повторяющихся звеньев в цепи – степень полимеризации (Р). Она определяет молекулярную массу полимера (М) М = m · Р, где m – молекулярная масса звена. В зависимости от значений М различают высокомолекуляные соединения, олигомеры и низкомолекулярные соединения. При М>5 000–10000 – высокомолекулярное соединение, М =500 –5000 – олигомер, М <500 – низкомолекулярное соединение. По числу мономерных звеньев в цепи полимеры классифицируют на гомополимеры и сополимеры. Гомополимеры состоят из одинаковых звеньев (например, –А–А–А–), а сополимеры – из двух или более звеньев (например, –А–В–С–). Сополимеры подразделяют на статистические –А–В–В–А–В–А–А–А–В–В– (имеют нерегулярное расположение звеньев) и чередующиеся А–В–А–В– (имеют регулярное расположение звеньев). Различают блок-сополимеры и привитые сополимеры Блок-сополимеры имеют длинные последовательности звеньев каждого типа ~АААААВВВВВААААА~ и в названии указываются составляющие звенья [например, поли(стирол– блок –метилакрилат)]. Привитые сополимеры основную цепь имеют из звеньев одного мономера, а боковую – из звеньев другого мономера ~ААААААААААА~. | | ВВВВВ ВВВВВ | По структурной форме полимеры делят на линейные, разветвленные и сшитые. Линейные имеют цепи с большой асимметрией. Разветвленные имеют длинную основную цепь с боковыми ответвлениями Сетчатые имеют длинные цепи, соединенные химическими связями По строению основной цепи полимеры делят на гомоцепные и и гетероцепные. Гомоцепные полимеры имеют основную цепьиз одинаковых атомов (например, из серы –S–S–S–, углерода–С–С–С–, фосфора –Р–Р–Р–). Полимеры, построенные из атомовуглерода называются карбоцепными. Г етероцепные полимерыимеют основную цепь из различных атомов (например, –С–О–,–Si–О–, –P=N–). У гетероцепных полимеров энергия связи между атомами выше,чем у гомоцепных. Поэтому гетероцепные полимеры являются высокоплавкими и высокопрочными. По происхождению полимеры делят на природные, синте-тические и искусственные. Примерами природных полимеровявляются натуральный каучук, целлюлоза, белки, алмаз, графит. Синтетическими полимерами, полученными в колбе или реакторе, являются полиэтилен, полистирол, полипропилен. Искусственными являются модифицированные природные полимеры, например, нитрат целлюлозы и ацетат целлюлозы.__ |
|
|
41) Химические реакции приводящие к уменьшению степени полимеризации.. Полимеры при переработке, хранении и эксплуатации подвергаются совместному действию тепла, света, кислорода воздуха,механических воздействий, в результате которых в полимерах развиваются физические и химические процессы, приводящие к ухудшению физико-механических свойств вследствие деструкции полимеров. Деструкция – это разрушение макромолекул под действием физических и химических агентов. С одной стороны, деструкция является нежелательной реакцией, поскольку уменьшает ММ и ухудшает физические и механические свойства полимеров, делает их непригодными к применению. С другой стороны, деструкция играет положительную роль. Для получения ценных низкомолекулярных веществ. 2. Для частичного снижения ММ полимеров с целью облегчения их переработки и применения. Деструкция полимеров может использоваться и для получения блок- и привитых сополимеров. Химическая деструкция осуществляется под действием химических реагентов и её разновидностями являются: гидролиз, ацидолиз, алкоголиз, аминолиз, окисление. Гидролиз – это расщепление цепей при взаимодействии с водой. Катализаторами являются водородные и гидроксильные ионы. Гидролиз некоторых полимеров ускоряется природными катализаторами – ферментами. Ацидолиз – это расщепление цепей под действием безводных кислот. Окислительная деструкция характерна для карбоцепных и гетероцепных полимеров. Окисление является цепным процессом и его основными стадиями являются инициирование, развитие цепи и обрыв цепи.Физическая деструкция полимеров осуществляется под действием различных физических факторов и основными её разновидностями являются: термическая, механическая, фото- и радиационная деструкция. Механическая деструкция полимеров может вызываться интенсивным перемешиванием или растиранием полимеров, а также осуществляться при продавливании под высоким давлением раствора или расплава полимера через отверстия малого диаметра. Для механической деструкции свойственно увеличение интенсивности деструкции с повышением ММ полимера. Механическая деструкция используется для уменьшения ММ и сужения ММР полимера, а также для облегчения переработки полимера. Примером фотодеструкции полимера может являться изменение свойств синтетической рубашки, которая была первоначально ослепительно белой, а со временем стала желтоватой. Это не результат плохой стирки, а фотодеструкции под действием УФ-излучения, что привело к появлению желтизны и хрупкости полимера.
|
|
42) Полимераналогичные превращения – это химические реакции макромолекул с низкомолекулярными соединениями, которые не изменяют длины и строения основной цепи, но изменяют природу функциональных групп. Основными назначениями полимераналогичных превращений являются: 1) Получение полимеров, которые невозможно синтезировать из мономеров, которые не известны или трудно синтезируемые, не способны полимеризоваться или плохо полимеризуются. В этом случае полимераналогичные превращения являются единственным методом получения желаемого продукта.Пример, ПВС получают гидролизом ПВА, потому что мономер для синтеза ПВС – виниловый спирт не существует в свободном виде, а сразу превращается в уксусный альдегид. 2) Получение полимеров с новыми свойстами. Пример, получение производных целлюлозы (нитрата и ацетата целлюлозы). Из продуктов модификации целлюлозы получают бумагу,взрывчатые вещества, пластмассы, искусственный шелк, штапельное волокно. Целлюлоза является полициклическим полимером, содержащим большое число полярных гидроксильных групп. Эти группы обусловливают образование межмолекулярных Н-связей, прочно соединяющих цепи между собой. Вследствие этого целлюлоза отличается очень низкой растворимостью и не плавится. В зависимости от механизма реакций при полимераналогичных превращениях возможно: образование новых функциональных групп,циклизация,раскрытие циклов,сложные превращени. Большое значение имеют полимераналогичныепревращения при решении вопросов стабилизации и целенаправленной деструкцииполимеров, а также при разработке полимерных носителей со специфическимифункциональными и активнымигруппами для синтетических, каталитических иферментативных процессов и для процессов разделения в аналитической химии. При полимераналогичных превращениях реакционная способность функциональных групп и атомов не зависит от молекулярного веса полимера. Особое место в числе полимераналогичных превращений занимают реакции концевых функциональных групп с низкомолекулярными монофункциональными соединениями. Эти реакции не влияют ни на состав и строение, ни на степень полимеризации. Эти реакции используются для изменения реакционной способности функциональных групп (например, при синтезе полипептидов; можно замедлить деструкцию полимеров, экранируя концевые группы макромолекул, или повысить реакционную способность для дальнейшего структурирования полимера). Подобные полимераналогичные превращения концевых групп можно использовать для определения молекулярной массы линейных полимеров.
|
|
43) Внутримолекулярные превращения - это реакции функциональных групп или атомов одной макромолекулы, которые приводят к изменению строения макромолекул. Внутримолекулярные превращения осуществляются под действием химических реагентов, тепла, света, излучений высокой энергии. Внутримолекулярные превращения влияют на механизм синтеза полимеров, приводят у получению полимеров нежелательного строения, но в некоторых случаях, и нужного строения. Различают несколько типов внутримолекулярных превращений: перегруппировка боковых групп, перегруппировка в основных цепях, изомерные превращения (циклизация, цис-транс -изомеризация, миграция двойных связей в основной цепи, образование ненасыщенных связей, сложные превращения). Различают следующие виды внутримолекулярных превращений: а) внутримолекулярные превращения в боковых группах: R–COO–C(CH3)3 —→ R–COOH + (CH3)2C=CH2 б) внутримолекулярные превращения в основной цепи, когда привитой радикал в результате превращения встраивается в главную цепь полимера в) изомерные превращения и в привитых радикалах и в главной цепи полимера. В 30-х годах нашего столетия Флори выдвинул так называемый "принцип равной реакционной способности", гласивший, что реакционный способность функциональной группы не зависит от того, присоединена ли она к цепочке любой длинны или нет. Этот принцип был сформулирован на основе анализа реакций поликонденсации
44) Принципы стабилизации полимеров … Нежелательные процессы старения можно предотвратить или существенно ослабить путём введения в полимер специальных добавок – стабилизаторов и ингибиторов. Часто процессы старения вызываются свободными радикалами. В этом случае роль стабилизатора сводится к предотвращению образования свободных радикалов, либо к взаимодействию с растущими радикалами и переводу их в неактивную форму. Действие стабилизаторов можно пояснить схемой: R• + H X → RH + X•, где HX – стабилизатор, а X• – неактивный радикал. В качестве стабилизаторов используют различные вещества. При этом учитывают их эффективность, технологичность применения, влияние на свойства изделия, токсичность, стоимость и др. В зависимости от назначения стабилизаторов различают антиоксиданты, светостабилизаторы, антирады и др. Антиоксиданты применяют для замедления окислительной деструкции полимеров. В качестве антиоксидантов используют фенолы, ароматические амины, сульфиды, меркаптаны и др. Антирады Для защиты полимера от радиоактивного облучения применяют вещества, действующие как “энергетические губки”, которые рассеивают поглощенную энергию и отнимают её от полимеров так быстро, что полимеры не успевают разрушаться. Такими антирадами являются соединения с системой сопряженных двойных связей и серусодержащие вещества (например, производные тиомочевины). Для защиты полимеров от разрушающего действия света применяют светостабилизаторы. Их роль заключается в поглощении энергии УФ-облучения и её рассеивании в окружающую среду в безопасной форме. Поглощенная стабилизатором энергия выделяется в виде тепла или излучения большей длины волны, а значит, и меньшей энергии. Реакции сшивания приводят к увеличению степени полимеризации полимера. Реакции сшивания используются в промышленности для получения редкосетчатых эластомеров путём вулканизации каучуков. Вулканизацией – называется процесс образования трёхмерных продуктов в результате сшивания макромолекул поперечными связями. Вулканизация может осуществляться под действием
сшивающих агентов (например, серы) и под действием излучений и радикалов. Различают серную и бессерную вулканизацию.
1) Серная вулканизация. Серную вулканизацию проводят при нагревании смеси каучука (содержащего двойные связи) с серой при 130-1600С. Реакция вулканизации полибутадиена протекает по схеме:
Сшивка макромолекул проводится двумя основными путями: 1)путем взаимодействия функциональных групп или атомов у различных макромолекул, 2)при обработке линейных полимеров «сшивающими агентами» - низкомолекулярными соединениями.
45. Классификация оптических методов анализа. Фотоколориметрия, сущность метода. Способы определения концентрации в фотометрических методах анализа: метод градуировочного графика, метод стандартов, метод добавок.
К оптическим методам относятся:
Рефрактометрический анализ - основан на измерении показателя преломления (рефракции) веществ, по которому следует судить о природе вещества, чистоте и содержании в растворах.Преломление луча света возникает на границе двух сред, если среды имеют различную плотность.
Поляриметрический метод основан на свойстве некоторых веществ изменять направление световыхколебаний.Вещества, обладающие свойством изменять направление колебаний при прохождении через них поляризованного света, называются оптически активными. Особенности строения молекул Сахаров обусловливают проявление оптической активности в растворах.
Оптические абсорбционные методы —это методы анализа,основанные на поглощении электромагнитного излученияанализируемыми веществами. При поглощении света атомы и молекулы поглощающих веществ переходят в новое возбужденное состояние. В зависимости от вида поглощающих веществ и способа трансформирования поглощенной энергии различают атомно-абсорбционный, молекулярно-абсорбционный анализ, нефелометрию и люминесцентный анализ.
Атомно-абсорбционный анализ основан на поглощении световой энергии атомами анализируемых веществ. Молекулярный абсорбционный анализ основан на поглощении света молекулами анализируемого вещества и сложными ионами в ультрафиолетовой, видимой и инфракрасной областях спектра.
Нефелометрия основана на поглощении и рассеянии световой энергии взвешенными частицами анализируемогове-щества.
Люминесцентныйанализ основан на измерении излучения,возникающего в результате выделения энергиивозбужденными молекулами анализируемого вещества.
Фотометрический метод анализа основан на способности определяемого вещества поглощать электромагнитное излучение оптического диапазона. Концентрацию поглощающего вещества определяют, измеряя интенсивность поглощения. Поглощение при определенной длине волны является информацией о качественном и количественном составе определяемого вещества и составляет аналитический сигнал. Фотометрический анализ относится к молекулярному абсорбционному анализу, т. е. анализу основанному на поглощении света молекулами анализируемого вещества и сложными ионами в ультрафиолетовой (УФ), видимой и инфракрасной (ИК) областях спектра. В настоящих указаниях рассматриваются метода анализа, основанные на избирательном поглощении электромагнитного излучения в видимой и ультрафиолетовой областях спектра: фотоколориметрия и спектрофотометрия.Спектрофотометрический метод анализа — основан на поглощении монохроматического излучения, т. е. излучения с одной длиной волны в видимой и УФ областях спектра. Фотоколориметрический метод анализа — основан на поглощении полихроматического (немонохроматического) излучения, т. е. пучка лучей с близкими длинами волны в видимой области спектра. Фотоколориметрию используют в основном для анализа окрашенных растворов.
Метод градуировочного графика Записывают спектр поглощения раствора вещества и находят длину волны, соответствующую максимуму поглощения. Затем готовят серию стандартных растворов с различным содержанием определяемого компонента и измеряют их оптическую плотность при выбранной длине волны и толщине слоя. Необходимо, чтобы выбранный интервал концентрации соответствовал области воз-можных изменений концентраций анализируемых растворов. Строят градуировочный график в координатах А ÷ C. В случае подчинения закону Бугера — Ламберта — Бера и при измерении оптической плотности относительно растворителя, график пред-ставляет собой прямую (рис. 6.1), проходящую через начало координат. Измеряют оптическую плотность исследуемого раствора Ах и по графику находят концентрацию Сх вещества в растворе.
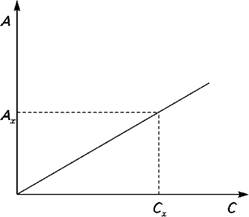 Рис. 6.1. Градуировочный график.
Рис. 6.1. Градуировочный график.
При построении градуировочного графика различают три варианта: — график для стандартных растворов, не содержащих посто- ронние вещества, построенный при оптимальных условиях; — график, построенный в присутствии отдельных посторонних компонентов; — график, построенный по стандартным растворам, содержащим все компоненты анализируемых объектов.Метод стандартного раствора (метод сравнения) В этом методе сравнивают поглощение исследуемого раствора и стандартного Аст. с известной концентрацией. Расчет концентрации Сх проводят по формуле, исходя из закона Бугера — Ламбер- та — Бера: C x= (Ax* Cст) / Аст.Измерения проводят с несколькими стандартными растворами, близкими по концентрации к исследуемому, и усредняют Сх. Этот способ требует строгого подчинения поглощения закону Бугера — Ламберта — Бера.
Метод добавок — это разновидность метода сравнения, основанный на сравнении оптической плотности исследуемого раствора и того же раствора с добавкой известного количества определяемого вещества.Применяют его для устранения мешающего влияния посторонних примесей, определения малых количеств анализируемого вещества в присутствии больших количеств посторонних веществ. Метод требует обязательного соблюдения основного закона свето-поглощения.
46.Общая хар-ка эл-ческих методов анализа.Потенциометрия,сущность метода.Электрод сравнения и индикаторный электрод.Расчет электродных потенциалов.
1 Электрохимические методы анализа. Электрохимические методы анализа (ЭХМА) основаны на использовании электрохимических процессов, происходящих в элек тролитической ячейке (гальваническом элементе, цепи). В состав электролитической ячейки входят два или три элек трода, один из которых — индикаторный или рабочий, второй — электрод сравнения и третий — вспомогательный. В результате электродной реакции в объеме раствора может происходить полное исчерпание вещества, принимающего в ней участие, или только обеднение приэлектродного слоя, при этом объемная концентрация этого вещества практически не изменя ется. Электрохимические методы, в результате которых не проис ходит уменьшение концентрации определяемого вещества в объ еме раствора, могут быть использованы для электрохимической индикации конечной точки титрования в титриметрии.
2. Потенциометрический метод анализа основан на использовании зависимости электродвижущей силы (ЭДС) электрохимической цепи от активности (концентрации) анализируемого иона. Зависимость электродвижущей силы Е электрохимической цепи от активности анализируемого иона описывают уравнением Нернста для цепи: Е = Е0 + (S / n) lg аан, гдe Е0 - стандартная ЭДС цепи; п - заряд анализируемого иона с соответствующим знаком; S - крутизна электроднойфункции индикаторного электрода, селективного к однозарядному иону; а ан - активность анализируемого иона.Для идеального индикаторного электрода:
S = (RT) / F, тогда Е = Е0 + (RT / Fn) lg аан => Е = Е0 + (0,059/ n) lg аан
где R - универсальная газовая постоянная, равная 8,312 Дж/(моль · К); Т - абсолютная температура раствора, К; F -число Фарадея, равное 96500 Кл/моль; S= 0,0591 В при 25°С. => Е = Е0 + (0,059/ n) lg аанДля потенциометрических измерений применяют электрохимические цепи, содержащие два электрода: индикаторный и электрод сравнения. Если оба электрода погружены в анализируемый раствор, то такая цепь называется цепью без переноса. Если электрод сравнения соединяют с анализируемым раствором через жидкостный контакт (солевой мостик), то цепь называется цепью с переносом.Индикаторным называют электрод, потенциал которого определяет активность анализируемого иона в соответствии с уравнением Нернста. Электродом сравнения называют электрод, потенциал которого постоянен и не зависит от концентрации ионов в растворе. Солевой мостик служит для предотвращения смешивания анализируемого раствора и раствора электрода сравнения.В качестве солевого мостика используют насыщенные растворы солей KCl, КNО3 и других с близкими значениями подвижностей катиона и аниона. Это позволяет снизить диффузионный потенциал Едиф жидкостного соединения практически до нуля.
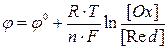 В результате изучения потенциалов различных электродных процессов установлено, что их величины зависят от следующих факторов:1) от природы веществ – участников электродного процесса;2) от соотношения между концентрациями этих веществ;3) от температуры системы.Значения электродных потенциалов рассчитывают по уравнению Нернста:
В результате изучения потенциалов различных электродных процессов установлено, что их величины зависят от следующих факторов:1) от природы веществ – участников электродного процесса;2) от соотношения между концентрациями этих веществ;3) от температуры системы.Значения электродных потенциалов рассчитывают по уравнению Нернста:
где 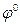 ‑ стандартный электродный потенциал, измеренный при стандартных условиях; R = 8.314 Дж/моль·К, универсальная газовая постоянная; Т – температура по шкале Кельвина, К; F – число Фарадея, равное ~96500 Кл/моль; [Ox] и [Red] – молярные концентрации веществ, участвующих в процессе в окисленной (Ox) и восстановленной (Red) формах.
‑ стандартный электродный потенциал, измеренный при стандартных условиях; R = 8.314 Дж/моль·К, универсальная газовая постоянная; Т – температура по шкале Кельвина, К; F – число Фарадея, равное ~96500 Кл/моль; [Ox] и [Red] – молярные концентрации веществ, участвующих в процессе в окисленной (Ox) и восстановленной (Red) формах.
Для металлического электрода уравнение Нернста принимает вид:
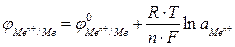 , (2)где n – число электронов, теряемых атомом металла при образовании катиона;
, (2)где n – число электронов, теряемых атомом металла при образовании катиона; 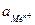 ‑ активность ионов металла в растворе электролита, моль/л.Для обычной при электрохимических измерениях стандартной температуры (Т = 25ºС или 298 К) и при подстановке значений постоянных величин уравнение (2) принимает вид:
‑ активность ионов металла в растворе электролита, моль/л.Для обычной при электрохимических измерениях стандартной температуры (Т = 25ºС или 298 К) и при подстановке значений постоянных величин уравнение (2) принимает вид:
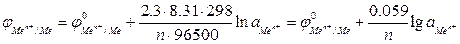 (3)
(3)
|
|
|

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...

Автоматическое растормаживание колес: Тормозные устройства колес предназначены для уменьшения длины пробега и улучшения маневрирования ВС при...

Археология об основании Рима: Новые раскопки проясняют и такой острый дискуссионный вопрос, как дата самого возникновения Рима...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!