Растворы, способные сохранять постоянной концентрацию ионов Н+ при добавлении к ним небольших количеств сильной кислоты или щелочи, а также при разбавлении, называются буферными растворами. Буферные растворы в зависимости от своего состава делятся на 2 основных типа: кислотные и основные.Кислотные буферные системы обычно образованы слабой неорганической или органической кислотой и солью этой же кислоты с сильным основанием.Оснóвные буферные системы образованы слабым неорганическим или органическим основанием и солью этого основания с сильной кислотой.
Механизм действия буферныхсистем Сущность буферного действия смеси слабой кислоты с ее солью можно рассмотреть на примере ацетатного буферного раствора. При добавлении к нему сильной кислоты (например, HCl) происходит реакция:
CH3COONa + HCl = NaCl + CH3COOH– молекулярное уравнение
CH3COO– + Na+ + H+ + Cl– = Na+ + Cl– + CH3COOH– полное ионное уравнение
H+ + CH3COO– = CH3COOH– сокращенное ионное уравнение. В результате этого воздействия сильная кислота замещается на эквивалентное количество плохо диссоциированной слабой кислоты буферной системы, поэтому концентрация ионов Н+ (активная кислотность) в растворе существенно не изменяется.Пока солевая компонента буферной системы не расходуется в данной реакции раствор в той или иной степени будет сохранять свое буферное действие.
При добавлении к буферной смеси сильного основания (например, NaOH) происходит реакция:
CH3COOH + NaOH = CH3COONa + H2O– молекулярное уравнение
CH3COOH + Na+ + OH– = CH3COO– + Na+ + H2O– полноеионноеуравнение
CH3COOН + OH– = CH3COO– + H2O– сокращенное ионное уравнение
В результате сильное основание замещается на эквивалентное количество нейтральной соли буферной системы, поэтому концентрация ионов водорода в ней опять изменится незначительно.Буферное действие раствора при этом будет наблюдаться пока полностью не расходуется слабая кислота.Если к буферному раствору попеременно добавлять в небольших количествах сильную кислоту или щелочь, то его буферное действие сможет сохраняться более длительное время, т.к. в результате протекающих реакций буферная система будет периодически восстанавливать свой первоначальный количественный и качественный состав. Расчет рН буферных растворов.
Для буферной системы I типа НА/A- концентрацию ионов Н+ в растворе легко вычислить, исходя из константы диссоциации слабой кислоты (для простоты изложения вместо активностей ионов в выражении для  будем использовать их концентрации):
будем использовать их концентрации):
НA⇄ A- + H+;

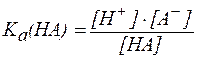
отсюда:
В присутствии второго компонента буферного раствора – сильного электролита – равновесие диссоциации слабой кислоты НA, согласно принципу ЛеШателье, смещено влево. Поэтому можно считать, что концентрация недиссоциированных молекул НA практически равна концентрации кислоты в буферном растворе, а концентрация ионов A- равна концентрации соли.
 В таком случае можно записать:
В таком случае можно записать:
где С(кислоты) и С(соли) – молярные концентрации кислоты и соли.
Если равенство (3) прологарифмировать (взять отрицательный десятичный логарифм левой и правой частей уравнения), то получим:

Так, рН фосфатной буферной системы состава NaH2PO4/Na2HPO4 можно рассчитать по уравнению:
где 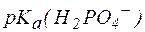 – показатель константы диссоциации фосфорной кислоты по второй ступени.
– показатель константы диссоциации фосфорной кислоты по второй ступени.
В случаях, когда требуется получить буферный раствор с задан-ным значением pH, используют уравнение: 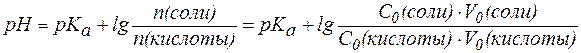
где индексом «0» обозначены характеристики исходных растворов кислоты и соли, смешиванием которых получают требуемую буферную смесь.
Для буферной системы II типа В/ВН+, например аммонийной, гидроксидный и водородный показатели вычисляют по уравнениям:
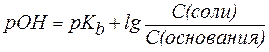
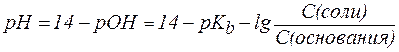
где 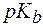 – показатель константы диссоциации основания.
– показатель константы диссоциации основания.
В общем виде уравнение для расчета pH буферных систем выглядит следующим образом:
и называется уравнением Гендерсона-Гассельбаха.
52. Гетерогенные процессы и межфазные равновесия. Факторы, влияющие на образование осадков. Применение процессов осаждения в аналитической химии. Гетерогенные химические процессы основаны на реакциях между реагентами, находящимися в разных фазах. Химические реакции являются одной из стадий гетерогенного процесса и протекают после перемещения реагентов к поверхности раздела фаз, а в ряде случаев и через межфазную поверхность. Гетерогенные процессы делят по фазовому состоянию реагентов на процессы в системах Г-Ж, Ж-Т, Г-Т и т.д. Процессы в системе газ- жидкость (Г-Ж):Процессы, основанные на взаимодействии газообразных и жидких реагентов, широко используются в химической промышленности. К таким процессам относятся абсорбция и десорбция газов, испарение жидкостей, дистилляция и ректификация, пиролиз жидкостей с испарением продуктов пиролиза и т.п. Процессы в системе жидкость-твердое (Ж-Т):Процессы с участием жидких и твердых реагентов служат основой многих химических производств. К таким процессам относятся адсорбция растворенных в жидкости веществ и десорбция их, растворение твердых веществ и кристаллизация из растворов, экстрагирование и выщелачивание, плавление твердых тел и кристаллизация из расплавов, полимеризация в среде жидких мономеров с образованием твердых полимеров и т. д. Процессы в системе газ-твердое (Г-Т): Наиболее типичными технологическими процессами с участием газообразных и твердых реагентов (Г-Т) является адсорбция газов твердыми адсорбентами и десорбция адсорбированных газов, реакции компонентов газовой фазы с участием твердых катализаторов, возгонка и конденсация паров твердых веществ, пиролиз твердого топлива, различные виды обжига твердых материалов. Факторы, влияющие на образование осадков:1)температура,кристаллические осадки рекомендуют получать из подогретых растворов,при постепенном охлаждении такого раствора происходит постепенное наращивание красталла.2)концентрация,онане должна быть высокой и малой.высокие приводят к образованию большого кол-ва центров кристаллизации и получение мелких кристаллических осадков,при малой конц.-осадок не образуется,3)скорость взаимодействия реагентов,4)время формирования осадка.Применение процессов осаждения:1)в качественном анализе для обнаружения и модификации катионов и анионов,2)для разделения смесей веществ при исследовании многих природных материалов,3)в количественном анализе гравиметрии и титрометрии.
53. Гравиметрический анализ. Требования, предъявляемые к осадителю. Условия осаждения аморфных и кристаллических осадков? Понятия форма осаждения и гравиметрическая форм а. Техника высушивания и прокаливания осадков.
.Гравиметрическим анализом называют метод количественного химического анализа, основанный на точном измерении массы определяемого вещества или его составных частей, выделяемых в виде соединений точно известного постоянного состава. Требования к осадителям:Осадитель должен образовывать с исследуемым компонентом осадок, обладающий наименьшей растворимостью. Осадитель должен быть летуч, чтобы примеси его можно было удалить при прокаливании. Осадитель должен быть специфичным, т. е. осаждать избирательно. Условия осаждения кристаллических осадков: 1) Осаждение следует вести из разбавленного анализируемого раствора разбавленным раствором осадителя.2) Раствор осадителя прибавляют медленно, по каплям (особенно в начале осаждения), при непрерывном осторожном перемешивании раствора.3) Осаждение следует вести из горячего анализируемого раствора горячим раствором осадителя.4) В некоторых случаях осаждение полезно вести в присутствии веществ (например, небольших количеств кислоты), слегка повышающих растворимость осадка, ноне образующих с ним растворимые комплексные соединения.5) Выпавший осадок оставляют на некоторое время вместе с маточником для созревания осадка. Условия осаждения аморфных осадков: 1) К горячему концентрированному анализируемому раствору прибавляют горячий концентрированный раствор осадителя. В этих условиях происходит коагуляция коллоидных частиц и осадки получаются более плотными.2) Горячий раствор осадителя прибавляют быстро, что уменьшает вероятность образования коллоидных растворов.3) При необходимости в раствор вводят электролит-коагулятор.4) Избегают длительного выдерживания осадка с маточным раствором. Осаждаемая форма – тот осадок, который получается в результате химической реакции между осаждаемым ионом и осадителем. Например: Ba2+ + SO42– → BaSO4. Гравиметрическая форма – то вещество, которое получается после прокаливания осаждаемой формы. В некоторых случаях осаждаемая и гравиметрическая формы одинаковы (например, BaSO4). В других случаях их состав отличается друг от друга:Осаждаемая форма–CaCO3,Fe(OH)3,Al(OH)3.Гравиметрическая форма-CaO,Fe2O3,Al2O3 Высушивание осадка. Осадок высушивают вместе с фильтром. Воронку с осадком накрывают листком влажной фильтровальной бумаги. Ее края плотно прижимают к наружной поверхности воронки, лишнюю бумагу удаляют. Получается бумажная крышечка, плотно сидящая на воронке и защищающая осадок от пыли.После этого воронку с осадком следует поместить на 20—30 мин в сушильный шкаф, имеющий полки с круглыми отверстиями. В одно из них и вставляют воронку. Температуру в шкафу поддерживают не выше 90—105° С — при более сильном нагреве фильтр обугливается и распадается. Прокаливание осадков. Прежде чем приступить к прокаливанию, необходимо узнать массу пустого тигля. Для этого тигель предварительно прокаливают до постоянной массы, т. е. до тех пор, пока масса его перестанет изменяться. Прокаливают тигли в электрической муфельной печи, в тигельной печи или на газовой горелке, но обязательно при тех же температурных условиях, при которых предполагается прокаливать осадок.Предназначенный для прокаливания тигель берут тигельными щипцами за край и помещают в муфельную печь. После 25—30 мин прокаливания его вынимают из печи, дают остыть на листе асбеста (или на гранитной плитке) и переносят в эксикатор. Последний закрывают крышкой не сразу, а спустя 1—2 мин; иначе при охлаждении в эксикаторе создается разрежение и крышку будет трудно открыть. Затем эксикатор относят в весовую комнату и оставляют на 15—20 мин, чтобы тигель принял температуру весов.Взвесив тигель на аналитических весах, его снова прокаливают 15—20 мин, охлаждают в эксикаторе и повторяют взвешивание. Если результат последнего взвешивания будет отличаться от предыдущего не более чем на ±0,0002 г, считают, что тигель доведен для постоянной массы, т. е. подготовлен для прокаливания осадка. В противном случае тигель прокаливают, охлаждают и взвешивают еще раз. Результаты всех взвешиваний непременно записывают в лабораторный журнал.
Титриметрический метод анализа.Определение,сущность метода,его достоинства.Требования,предъявляемые к реакциям в титриметрии.Расчет результата прямого обратного и косвенного титрования.
Титриметрический анализ основан на точном измерении количества реактива, израсходованного на реакцию с определяемым веществом. В аналитической химии титр — один из способов выражения концентрации раствора. Титр показывает число граммов растворенного вещества в 1 мл раствора. Титрование — это постепенное прибавление титрованного раствора к анализируемому для определения точно эквивалентного количества. Момент титрования, когда количество добавленного титранта химически эквивалентно количеству титруемого вещества,называется точкой эквивалентности (т. э.). Ее замечают по изменению индикатора — специального вспомогательного вещества, которое вводят в титруемый раствор (внутренний индикатор).В области т. э. индикатор изменяет свой цвет, образует осадок или вызывает какойто другой наблюдаемый эффект. Момент титрования, когда наблюдается изменение индикатора, называется тонкой конца титрования (т. к. т.). В идеальном случае т. э. и т. к. т. совпадают, однако в практических условиях между ними наблюдается некоторая разница. Чем больше эта разница, тем больше погрешность титрования при прочих равных условиях, поэтому следует подбирать такой индикатор, чтобы разность между т. э. и т. к. т. была минимальной. Достоинства титриметрических методов анализа: быстрота проведения, высокая точность, простота используемой аппаратуры, возможность определения нескольких веществ в анализируемой пробе, возможность автоматизации процесса титрования.Требования к реакциям:1) Вещества, которые вступают в реакцию, должны реагировать в строго определенных количественных,2) Реакция между определяемым веществом и стандартным раствором реактива должна проходить быстро и практически до конца;3) Посторонние вещества, которые присутствуют в исследуемой пробе, и перешли в раствор вместе с определяемым веществом, не должны мешать титрованию определяемого вещества;4) т.э. должна фиксироваться тем ли иным способом резко и точно;5) Реакции должны проходить по мере возможности при комнатной t;6) Титрование не должно сопровождаться побочными реакциями, которые искажают результаты анализа. При прямом титровании используют исследуемый и один рабочий растворы. В процессе определения к определённому точно измеренному объёму одного из них по каплям добавляют второй раствор до наступления точки эквивалентности. Закон эквивалентов в этом случае может быть математически записан следующим образом:N1V1 = N2V2. где V1 и V2 – объёмы израсходованных исследуемого и рабочего растворов, соответственно; N1 и N2- молярные концентрации химических эквивалентов веществ исследуемого и рабочего растворов, соответственно. При обратном титровании используют исследуемый и два рабочих раствора, один их которых является вспомогательным, а второй применяют для титрования.В процессе анализа к определѐнному точно измеренному объѐму исследуемого раствора одномоментно добавляют взятый в избытке фиксированный объѐм вспомогательного рабочего раствора. В результате протекания химической реакции вещество, присутствующее в исследуемом растворе, расходуется полностью. Не прореагировавший избыток вещества вспомогательного раствора титруется затем вторым рабочим раствором до наступления точки эквивалентности. Таким образом, вещество, присутствующее во вспомогательном рабочем растворе, реагирует как с веществом исследуемого раствора, так и с веществом второго рабочего раствора. Закон эквивалентов в этом случае математически может быть записан следующим образом:N2V2 = N1V1 + N3V3. где V1, V2, V3 – израсходованные объѐмы исследуемого, вспомогательного и второго рабочих растворов, соответственно; N1, N2, N3 – молярные концентрации химических эквивалентов веществ в исследуемом, вспомогательном и во втором рабочих растворах, соответственно. При косвенном титровании используют при отсутствии подхо- дящего индикатора, при несоблюдении стехиометричности или при медленном протекании реакции. В этих случаях к определенному объему вещества А добавляют вспомогательный реагент, количест- венно взаимодействующий с А, а получающийся продукт реакции (в количестве, эквивалентном А) оттитровывают подходящим тит- рантом В. Закон эквивалентов при титровании заместителя имеет выражение как при прямом титровании: n(А) = n(B).
55.Перманганатометрическое титрование. Приготовление и стандартизация титранта. Условия титрования,определения конечной точки титрования. Практическое применение метода.
Перманганатометрическое титрование, или перманганатометрия, — метод количественного определения веществ (восстановителей, реже — окислителей и соединений, не обладающих окислительно-восстановительными свойствами) с применением титранта — раствора перманганата калия КМnO4.
Сущность метода. Перманганат калия — сильный окислитель, обладающий интенсивной фиолетово-малиновой окраской. В зависимости от кислотности титруемого раствора окислительные свойства перманганат-иона проявляются по-разному.





 будем использовать их концентрации):
будем использовать их концентрации):
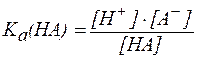
 В таком случае можно записать:
В таком случае можно записать:
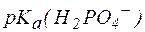 – показатель константы диссоциации фосфорной кислоты по второй ступени.
– показатель константы диссоциации фосфорной кислоты по второй ступени.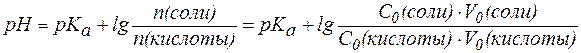
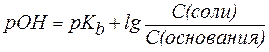
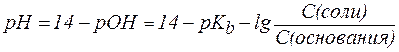
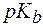 – показатель константы диссоциации основания.
– показатель константы диссоциации основания.


