Электродные потенциалы – разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом. Возникновение электродного потенциала обусловлено переносом заряженных частик ч-з границу раздела фаз, специф. адсорбцией ионов. Величина электродного потенциала в неравномерном состоянии зависит от природы и состава контактирующих фаз. Электродный потенциал является постоянной величиной при данной температуре, если пластинка металла опущена в раствор его соли с активностью ионов металла. Такой потенциал называется стандартным электродным потенциалом. Гальванический элемент — химический источник электрического тока, основанный на взаимодействии двух металлов и/или их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока. Назван в честь Луиджи Гальвани. Переход химической энергии в электрическую энергию происходит в гальванических элементах. Стандартный водородный электрод — электрод, использующийся в качестве электрода сравнения при различных электрохимических измерениях и в гальванических элементах. Водородный электрод (ВЭ) представляет собой пластинку или проволоку из металла, хорошо поглощающего газообразный водород (обычно используют платину или палладий), насыщенную водородом (при атмосферном давлении) и погруженную в водный раствор, содержащий ионы водорода. Потенциал пластины зависит от концентрации ионов Н+ в растворе. Электрод является эталоном, относительно которого ведется отсчет электродного потенциала определяемой химической реакции. При давлении водорода 1 атм., концентрации протонов в растворе 1 моль/л и температуре 298 К потенциал ВЭ принимают равным 0 В. При сборке гальванического элемента из ВЭ и определяемого электрода, на поверхности платины обратимо протекает реакция: 2Н+ + 2e− = H2 то есть, происходит либо восстановление водорода, либо его окисление — это зависит от потенциала реакции, протекающей на определяемом электроде. Измеряя ЭДС гальванического электрода при стандартных условиях (см. выше) определяют стандартный электродный потенциал определяемой химической реакции.
ВЭ применяют для измерения стандартного электродного потенциала электрохимической реакции, для измерения концентрации (активности) водородных ионов, а также любых других ионов. Применяют ВЭ так же для определения произведения растворимости, для определения констант скорости некоторых электрохимических реакций.
Схема стандартного водородного электрода:1. Платиновый электрод.2. Подводимый газообразный водород.3. Раствор кислоты (обычно HCl), в котором концентрация H+ = 1 моль/л.4. Водяной затвор, препятствующий попаданию кислорода воздуха.5. Электролитический мост (состоящий из концентрированного р-ра KCl), позволяющий присоединить вторую половину гальванического элемента.
Нормальный электродный потенциал позволяет оценивать термодинамическую активность различных химических веществ, но в настоящее время нет методов, позволяющих измерять абсолютное значение его. В связи с этим электроды характеризуют так называемым стандартным потенциалом электрода, который представляет собой (по предложению Нернста) разность нормальных потенциалов рассматриваемого и стандартного водородного электродов, определенных при 25 °С (298 К). При таком подходе стандартный электродный потенциал водорода, условно принимают равным нулю. Тогда стандартный потенциал вещества, электродный потенциал которого в указанных условиях, более отрицателен, чем потенциал стандартного водородного электрода, считается отрицательным. Если же электродный потенциал вещества менее отрицателен, чем потенциал стандартного водородного электрода, стандартный потенциал вещества считается положительным.
Механизм возникновения электродных потенциалов Если поместить пластинку металла в растворитель (например, в воду) или в раствор соли этого металла, то под действием полярных молекул растворителя ионы металла будут переходить в раствор. Электроны остаются на металле, следовательно, он заряжается отрицательно. Возникающее электростатическое притяжение между ионами перешедшими в раствор и пластинкой металла препятствует дальнейшему течению процесса, устанавливается равновесие, которое является динамическим. Положение равновесия зависит от соотношения между энергией, необходимой для отрыва иона от кристаллической решетки металла и энергией выделяющейся при сольватации ионов в растворе. Образуется двойной электронный слой, состоящий из плотной и диффузионной частей. На границе металл – раствор появляется скачок потенциала. Система металл-раствор, называется электродом. Электродным потенциалом φ называется, разность потенциалов между металлом и раствором. Обозначение электрода Mez+׀Me Обозначение электродного потенциала  . Реакция на электроде: Mez +Ze ↔ Me
. Реакция на электроде: Mez +Ze ↔ Me
Стандартным электродным потенциалом называется потенциал данного электрода при концентрациях (активностях) всех веществ, участвующих в электродном процессе, равных единице. Применительно к рассмотренным выше примерам электродных процессов уравнение Нернста имеет следующий вид (подставить количество электронов, а 2,3RT/F при стандартных условиях равно 0,059).В качестве электрода сравнения, стандартный потенциал которого считается равным нулю, принят стандартный водородный электрод, на котором осуществляется процесс.2Н+ + 2ē ↔ Н2 при активности (концентрации) ионов водорода, равной единице (рН = 0), и парциальном давлении газообразного водорода, равном нормальному атмосферному давлению, условно принимаемому за единицу.Если, сохраняя парциальное давление Н2 постоянным, изменить концентрацию (активность) ионов Н+ в растворе, то потенциал водородного электрода изменится и не будет равен нулю; при 25°С его величина, как это вытекает из уравнения Нернста, определяется выражением
φ = -0,059раН+ или без учета коэффициента активности: φ = -0,059рН
В частности в нейтральных растворах (рН =7) φ = -0,059*7 = -0,41В. Значения стандартных электродных потенциалов φ°, измеренных по отношению к стандартному водородному электроду, табулированы. Чем меньше (в алгебраическом смысле) значение φ°, тем сильнее выражены восстановительные свойства соответствующей электрохимической системы; напротив, чем больше значение φ°, тем более сильными окислительными свойствами характеризуется система. Пусть ГЭ состоит из двух электродов 1 и 2, потенциалы которых равны φ1 и φ2, причем φ1 > φ2. Это означает, что электрод 1 будет положительным, а электрод 2 – отрицательным полюсом элемента, ЭДС которого равна разности φ1 - φ2. На электроде 1 будет протекать реакция восстановления (катод), на электроде 2 – полуреакция окисления (анод).
ГЭ может быть составлен не только из различных электродов, но и из одинаковых электродов, погруженных в растворы одного и того же электролита, различающиеся только концентрацией (концентрационные гальванические элементы). ЭДС такого элемента равна также разности потенциалов составляющих его электродов.
Электролиз. Электролитическое восстановление водных растворов. Зависимость процесса электролитического восстановления от величины катодного потенциала, материала катода и его поверхности, температуры, плотности тока, природы электролита.
Электролиз – это совокупность процессов, протекающих в растворе или расплаве электролита, при пропускании через него постоянного электрического тока.
Как и в случае химического источника электрической энергии, электрод, на котором происходит восстановление, называется катодом; электрод, на котором происходит окисление, называется анодом. Но при электролизе катод заряжен отрицательно, а анод - положительно, т.е. распределение знаков заряда электродов противоположно тому, которое имеется при работе гальванического элемента. При электролизе химическая реакция осуществляется за счёт энергии электрического тока, подводимой извне, в то время как при работе гальванического элемента энергия самопроизвольно протекающей в нем химической реакции превращается в электрическую энергию.
Примером электролиза расплавов может служить электролиз хлорида магния, молекулы которого подвергаются диссоциации:MgCl2 → Mg2++2Cl-
При прохождении тока через расплав катионы магния по действием электрического поля движутся к отрицательному электроду. Здесь, взаимодействуя с приходящими по внешней цепи электронами, они восстанавливаются. К (-): Mg2++2e-→Mg0
Анионы хлора перемещаются к положительному электроду, и, отдавая избыточные электроны, окисляются. При этом первичным процессом является собственно электрохимическая стадия—окисление ионов хлора А (+): 2Cl- - 2e-→ Cl20
При рассмотрении электролиза растворов следует учитывать, что, кроме ионов электролита, во всяком водном растворе имеются ещё ионы, являющиеся ещё продуктами диссоциации воды, т.е катионы водорода и гидроксильные анионы. В электролитическом поле ионы водорода перемещаются к катоду, а гидроксила—к аноду. Таким образом, у катода могут восстанавливаться как катионы металлов, так и катионы водорода. Аналогично, у анода может происходить окисление, как анионов электролита, так и ионов гидроксила. Кроме того, молекулы воды также могут подвергаться электрохимическому окислению или восстановлению.
Рассматривая катодные процессы, протекающие при электролизе водных растворов, нужно учитывать величину потенциала процесса восстановления ионов водорода. Этот потенциал зависит от концентрации ионов водорода и в случае нейтральных растворов (рН=7), согласно уравнения Нернста имеет значение φ = – 0,059 • 7 = – 0,41 В.
Если электролит образован металлом, электродный потенциал которого значительно положительнее, чем – 0,41 В, то из нейтрального раствора у катода будет выделяться металл. Такие металлы находятся в ряду напряжений вблизи водорода (начиная приблизительно от олова) и после него. Наоборот, в случае электролитов, металл которых имеет потенциал значительно более отрицательный, чем – 0,41 В, металл восстанавливаться не будет, а произойдёт выделение водорода. К таким металлам относятся металлы начала ряда напряжений - приблизительно до титана. Наконец, если потенциал металла близок к величине –0,41 В (металлы средней части ряда—Zn,Cr,Fe,Ni), то в зависимости от концентрации раствора и условий электролиза возможно как восстановление металла, так и выделение водорода. Электрохимическое выделение водорода из кислых растворов происходит в процессе разряда ионов водорода. В случае же нейтральных или щелочных сред оно является результатом электрохимического восстановления воды:
К (-): 2Н2О + 2е- →Н2 + 2ОН-
Таким образом, характер катодного процесса при электролизе водных растворов определяется прежде всего положением соответствующего металла в ряду напряжений. В ряде случаев большое значение имеют рН раствора, концентрация ионов металла и другие условия электролиза.
При рассмотрении анодных процессов следует иметь в виду, что материал анода в ходе электролиза может окисляться. В связи с этим различают электролиз с инертным анодом и электролиз с активным анодом. Инертным называется анод, материал которого не претерпевает окисления в ходе электролиза. В качестве материалов для инертных анодов чаще применяют графит и платину. Активным называется анод, материал которого может окисляться в ходе электролиза.
На инертном аноде при электролизе водных растворов щелочей, кислородсодержащих кислот и их солей, а также фтористоводородной кислоты и фторидов происходит электрохимическое окисление воды с выделением кислорода. В зависимости от рН раствора этот процесс протекает по-разному и может быть записан различными уравнениями. В щелочной среде уравнение имеет вид:
А (+): 4ОН- - 4е-→О2 + 2Н2О
В кислой или нейтральной среде: А (+): 2Н2О - 4е-→ О2 + 4Н+
В рассматриваемых случаях электрохимическое окисление воды является энергетически наиболее выгодным процессом. Кислородсодержащие анионы или не способны окисляться, или их окисление происходит при очень высоких потенциалах. Например, стандартный потенциал окисления иона 2SO42- - 2e- →S2O82- равен 2,010 В, что значительно превышает стандартный потенциал окисления воды (1,228 В). Стандартный потенциал окисления иона F- имеет ещё большее значение (2,87 В).
При электролизе водных растворов бескислородных кислот и их солей (кроме HF и фторидов) у анода разряжаются анионы. В частности, при электролизе растворов HI, HBr, HCl и их солей у анода выделяется соответствующий галоген.
В случае активного анода число конкурирующих окислительных процессов возрастает до трёх: электрохимическое окисление воды с выделением кислорода, разряд аниона (т.е. его окисление) и электрохимическое окисление металла анода (так называемое анодное растворение металла). Из этих возможных процессов будет идти тот, который энергетически наиболее выгоден. Если металл анода расположен в ряду стандартных потенциалов раньше обеих других электрохимических систем, то будет наблюдаться анодное растворение металла. В противном случае будет идти выделение кислорода или разряд аниона.
Типичные случаи электролиза водных растворов.
Электролиз раствора CuCl2 с инертным анодом. Медь в ряду напряжений расположена после водорода; поэтому у катода будет происходить разряд ионов Cu2+ и выделение металлической меди. У анода будут разряжаться хлорид-ионы. Схема электролиза раствора хлорида меди (II): CuCl2 → Cu2+ + 2Cl- К (-): Cu2++2e-→Cu0 А (+): 2Cl- - 2e-→ Cl20
Электролиз раствора K2SO4 с инертным анодом. Поскольку калий в ряду напряжений стоит значительно левее водорода, то у катода происходит выделение водорода и накопление ОН-; у анода - выделение кислорода и накопление ионов Н+. K2SO4 → 2К+ + SO42- К (-): 2Н2О + 2е- →Н2 + 2ОН- А (+): 2Н2О - 4е-→ О2 + 4Н+
Электролиз раствора NiSO4 с никелевым анодом. Стандартный потенциал никеля (- 0,250 В) несколько больше, чем –0,41 В, поэтому при электролизе нейтрального раствора NiSO4 на катоде в основном происходит разряд ионов Ni2+ и выделение металла. На аноде происходит противоположный процесс—окисление металла, поскольку потенциал никеля намного меньше потенциала окисления воды, а тем более—потенциала окисления иона SO42-. Таким образом, в данном случае электролиз сводится к растворению металла анода и выделению его на катоде.
Схема электролиза раствора сульфата никеля: К (-): Ni 2+ +2e-→Ni0 А (+): Ni 0 - 2e-→Ni 2+
71)Скорость химической реакции. Распределение частиц по скоростям и энергии. Распределение Максвелла. Скорость химической реакции есть число элементарных актов химической реакции, происходящих в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности (для гетерогенных реакций).
Скорость химической реакции есть изменение концентрации реагирующих веществ в единицу времени. Скорость реакции считается положительной, поэтому математически определение средней скорости реакции в интервале времени Δt записывается следующим образом:
 (II.1) В различных интервалах времени средняя скорость химической реакции имеет разные значения; истинная (мгновенная) скорость реакции определяется как производная от концентрации по времени:
(II.1) В различных интервалах времени средняя скорость химической реакции имеет разные значения; истинная (мгновенная) скорость реакции определяется как производная от концентрации по времени:  (II.2) Графическое изображение зависимости концентрации реагентов от времени есть кинетическая кривая (рисунок 2.1).
(II.2) Графическое изображение зависимости концентрации реагентов от времени есть кинетическая кривая (рисунок 2.1).
 Рис. 2.1 Кинетические кривые для исходных веществ (А) и продуктов реакции (В). Истинную скорость реакции можно определить графически, проведя касательную к кинетической кривой (рис. 2.2); истинная скорость реакции в данный момент времени равна по абсолютной величине тангенсу угла наклона касательной:
Рис. 2.1 Кинетические кривые для исходных веществ (А) и продуктов реакции (В). Истинную скорость реакции можно определить графически, проведя касательную к кинетической кривой (рис. 2.2); истинная скорость реакции в данный момент времени равна по абсолютной величине тангенсу угла наклона касательной:
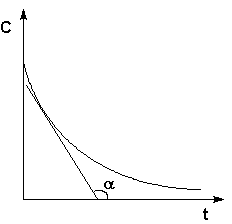 Рис. 2.2 Графическое определение Vист.
Рис. 2.2 Графическое определение Vист.
α = dC/dt. Vист = dC/dt.
Закон распределения молекул идеального газа по скоростям, теоретически полученный Максвеллом в 1860 г. определяет, какое число dN молекул однородного (p = const) одноатомного идеального газа из общего числа N его молекул в единице объёма имеет при данной температуре Т скорости, заключенные в интервале от v до v + dv. Для вывода функции распределения молекул по скоростям f(v) равной отношению числа молекул dN, скорости которых лежат в интервале v ÷ v + dv к общему числу молекул N и величине интервала dv
Максвелл использовал два предложения: а) все направления в пространстве равноправны и поэтому любое направление движения частицы, т.е. любое направление скорости одинаково вероятно. Это свойство иногда называют свойством изотропности функции распределения. б) движение по трем взаимно перпендикулярным осям независимы т.е. х-компоненты скорости 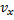 не зависит от того каково значения ее компонент
не зависит от того каково значения ее компонент  или
или  . И тогда вывод f (v) делается сначала для одной компоненты
. И тогда вывод f (v) делается сначала для одной компоненты 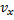 , а затем обобщается на все координаты скорости.
, а затем обобщается на все координаты скорости.
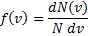 - ф-я распределения ч-ц по скоростям
- ф-я распределения ч-ц по скоростям
вероятность нахождения модуля скорости молекулы в интервале скоростей от v до v+dv Функция:
 - названа распределением Максвелла. Она является плотностью вероятности того, что молекула имеет модуль скорости равный v.
- названа распределением Максвелла. Она является плотностью вероятности того, что молекула имеет модуль скорости равный v.
Распределение Максвелла позволяет найти относительное число молекул, скорости которых заключаются в интервале от v до v+dv. 
 ф-я распределения ч-ц по энергиям
ф-я распределения ч-ц по энергиям
 , – это закон распределения частиц по потенциальным энергиям – распределение Больцмана. Здесь n0 – число молекул в единице объёма там, где U = 0.
, – это закон распределения частиц по потенциальным энергиям – распределение Больцмана. Здесь n0 – число молекул в единице объёма там, где U = 0.
Теория активных столкновений. Уравнение Аррениуса, его анализ. Правило Вант–Гоффа.ТАС - В основу этой теории положено два учения: молекулярно-кинетическая теория и теория Больцмана.Вывод уравнения ТАС.
z– общее число столкновений в единицу времени.z= 
Д – эффективный диаметр молекул; n– число молекул в единице объема; M– молекулярная масса. С помощью закона Больцмана определяем количество активных столкновений z  , т.е. таких, в которых энергия превышает энергию активации:z
, т.е. таких, в которых энергия превышает энергию активации:z  Тогда доля активных столкновений составит:
Тогда доля активных столкновений составит: 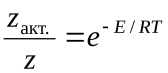 Рассмотрим бимолекулярную газовую реакцию типа: 2А
Рассмотрим бимолекулярную газовую реакцию типа: 2А  , где Р – продукты реакции. Например, это может быть разложение йодистого водорода: 2HJ
, где Р – продукты реакции. Например, это может быть разложение йодистого водорода: 2HJ 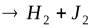
Теперь заметим, что в результате каждого активного столкновения расходуется две молекулы исходного вещества. Поэтому количество прореагировавших молекул в единице объема будет равна удвоенному количеству активных столкновений в то же время и в том же объеме:
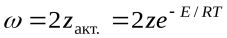 или
или 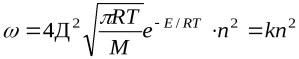 (
( )
)
Отсюда видно, что скорость реакции зависит от квадрата концентрации. 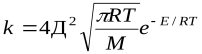
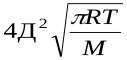 =k
=k  k=k
k=k 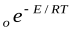 уравнение Аррениуса
уравнение Аррениуса
Сравнение этих уравнений позволяет установить физический смысл предэкспоненциального множителя k  , который оказывается пропорциональным общему количеству столкновений всех молекул в единице объема за единицу времени. В общем виде уравнение Аррениуса для всех типов реакций часто пишут в виде: k=z
, который оказывается пропорциональным общему количеству столкновений всех молекул в единице объема за единицу времени. В общем виде уравнение Аррениуса для всех типов реакций часто пишут в виде: k=z  уравнение Аррениуса
уравнение Аррениуса
Константа, рассчитанная по этому уравнению, не дает совпадения с экспериментальными данными. Для корректировки в это уравнение вводят стерический фактор р. Тогда уравнение Аррениуса с точки зрения ТАС запишется следующим образом: k=pz 
Считается, что стерический фактор отличается от единицы потому, что для осуществления реакции необходима определенная ориентация реагирующих молекул. В этом уравнении Е – энергия активации, рассчитанная по ТАС, абсолютная (истинная) энергия активации, а экспериментальная – эффективная энергия активации. Е 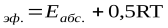

Очевидно, что взаимодействие частиц осуществляется при их столкновениях; однако число столкновений молекул очень велико и, если бы каждое столкновение приводило к химическому взаимодействию частиц, все реакции протекали бы практически мгновенно. С. Аррениус постулировал, что столкновения молекул будут эффективны (т.е. будут приводить к реакции) только в том случае, если сталкивающиеся молекулы обладают некоторым запасом энергии – энергией активации.
Энергия активации есть минимальная энергия, которой должны обладать молекулы, чтобы их столкновение могло привести к химическому взаимодействию.
Рассмотрим путь некоторой элементарной реакции А + В ––> С
Поскольку химическое взаимодействие частиц связано с разрывом старых химических связей и образованием новых, считается, что всякая элементарная реакция проходит через образование некоторого неустойчивого промежуточного соединения, называемого активированным комплексом:
А ––> K# ––> B
Образование активированного комплекса всегда требует затраты некоторого количества энергии, что вызвано, во-первых, отталкиванием электронных оболочек и атомных ядер при сближении частиц и, во-вторых, необходимостью построения определенной пространственной конфигурации атомов в активированном комплексе и перераспределения электронной плотности. Таким образом, по пути из начального состояния в конечное система должна преодолеть своего рода энергетический барьер. Энергия активации реакции приближённо равна превышению средней энергии активированного комплекса над средним уровнем энергии реагентов. Очевидно, что если прямая реакция является экзотермической, то энергия активации обратной реакции Е'А выше, нежели энергия активации прямой реакции EA. Энергии активации прямой и обратной реакции связаны друг с другом через изменение внутренней энергии в ходе реакции. Вышесказанное можно проиллюстрировать с помощью энергетической диаграммы химической реакции (рис. 2.5).
 Рис. 2.5 Энергетическая диаграмма химической реакции. Eисх – средняя энергия частиц исходных веществ Eпрод – средняя энергия частиц продуктов реакции Поскольку температура есть мера средней кинетической энергии частиц, повышение температуры приводит к увеличению доли частиц, энергия которых равна или больше энергии активации, что приводит к увеличению константы скорости реакции (рис.2.6):
Рис. 2.5 Энергетическая диаграмма химической реакции. Eисх – средняя энергия частиц исходных веществ Eпрод – средняя энергия частиц продуктов реакции Поскольку температура есть мера средней кинетической энергии частиц, повышение температуры приводит к увеличению доли частиц, энергия которых равна или больше энергии активации, что приводит к увеличению константы скорости реакции (рис.2.6):
 Рис. 2.6 Распределение частиц по энергии Здесь nЕ/N – доля частиц, обладающих энергией E; Ei - средняя энергия частиц при температуре Ti (T1 < T2 < T3)
Рис. 2.6 Распределение частиц по энергии Здесь nЕ/N – доля частиц, обладающих энергией E; Ei - средняя энергия частиц при температуре Ti (T1 < T2 < T3)
Рассмотрим термодинамический вывод выражения, описывающего зависимость константы скорости реакции от температуры и величины энергии активации – уравнения Аррениуса. Согласно уравнению изобары Вант-Гоффа,  (II.31) Поскольку константа равновесия есть отношение констант скоростей прямой и обратной реакции, можно переписать выражение (II.31) следующим образом:
(II.31) Поскольку константа равновесия есть отношение констант скоростей прямой и обратной реакции, можно переписать выражение (II.31) следующим образом:
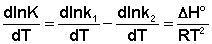 (II.32) Представив изменение энтальпии реакции ΔHº в виде разности двух величин E1 и E2, получаем:
(II.32) Представив изменение энтальпии реакции ΔHº в виде разности двух величин E1 и E2, получаем:
 (II.33)
(II.33) 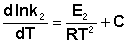 (II.34) Здесь С – некоторая константа. Постулировав, что С = 0, получаем уравнение Аррениуса, где EA – энергия активации:
(II.34) Здесь С – некоторая константа. Постулировав, что С = 0, получаем уравнение Аррениуса, где EA – энергия активации:
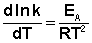 (II.35) После неопределенного интегрирования выражения (II.35) получим уравнение Аррениуса в интегральной форме:
(II.35) После неопределенного интегрирования выражения (II.35) получим уравнение Аррениуса в интегральной форме:
 (II.36)
(II.36)  (II.37)
(II.37)
 Рис. 2.7 Зависимость логарифма константы скорости химической реакции от обратной температуры.
Рис. 2.7 Зависимость логарифма константы скорости химической реакции от обратной температуры.
Здесь A – постоянная интегрирования. Из уравнения (II.37) нетрудно показать физический смысл предэкспоненциального множителя A, который равен константе скорости реакции при температуре, стремящейся к бесконечности. Как видно из выражения (II.36), логарифм константы скорости линейно зависит от обратной температуры (рис.2.7); величину энергии активации EA и логарифм предэкспоненциального множителя A можно определить графически (тангенс угла наклона прямой к оси абсцисс и отрезок, отсекаемый прямой на оси ординат).  (II.38) Зная энергию активации реакции и константу скорости при какой-либо температуре T1, по уравнению Аррениуса можно рассчитать величину константы скорости при любой температуре T2:
(II.38) Зная энергию активации реакции и константу скорости при какой-либо температуре T1, по уравнению Аррениуса можно рассчитать величину константы скорости при любой температуре T2:
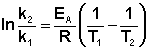 (II.39) При повышении температуры на каждые 10 градусов константа скорости элементарной химической реакции увеличивается в 2 – 4 раза.
(II.39) При повышении температуры на каждые 10 градусов константа скорости элементарной химической реакции увеличивается в 2 – 4 раза.
Величина, показывающая, во сколько раз увеличивается константа скорости при повышении температуры на 10 градусов, есть температурный коэффициент константы скорости реакции γ. Математически правило Вант-Гоффа можно записать следующим образом: 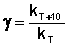 (II.29)
(II.29)  (II.30) Однако правило Вант-Гоффа применимо лишь в узком температурном интервале, поскольку температурный коэффициент скорости реакции γ сам является функцией от температуры; при очень высоких и очень низких температурах γ становится равным единице (т.е. скорость химической реакции перестает зависеть от температуры).
(II.30) Однако правило Вант-Гоффа применимо лишь в узком температурном интервале, поскольку температурный коэффициент скорости реакции γ сам является функцией от температуры; при очень высоких и очень низких температурах γ становится равным единице (т.е. скорость химической реакции перестает зависеть от температуры).





 . Реакция на электроде: Mez +Ze ↔ Me
. Реакция на электроде: Mez +Ze ↔ Me (II.1) В различных интервалах времени средняя скорость химической реакции имеет разные значения; истинная (мгновенная) скорость реакции определяется как производная от концентрации по времени:
(II.1) В различных интервалах времени средняя скорость химической реакции имеет разные значения; истинная (мгновенная) скорость реакции определяется как производная от концентрации по времени:  (II.2) Графическое изображение зависимости концентрации реагентов от времени есть кинетическая кривая (рисунок 2.1).
(II.2) Графическое изображение зависимости концентрации реагентов от времени есть кинетическая кривая (рисунок 2.1). Рис. 2.1 Кинетические кривые для исходных веществ (А) и продуктов реакции (В). Истинную скорость реакции можно определить графически, проведя касательную к кинетической кривой (рис. 2.2); истинная скорость реакции в данный момент времени равна по абсолютной величине тангенсу угла наклона касательной:
Рис. 2.1 Кинетические кривые для исходных веществ (А) и продуктов реакции (В). Истинную скорость реакции можно определить графически, проведя касательную к кинетической кривой (рис. 2.2); истинная скорость реакции в данный момент времени равна по абсолютной величине тангенсу угла наклона касательной: Рис. 2.2 Графическое определение Vист.
Рис. 2.2 Графическое определение Vист.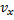 не зависит от того каково значения ее компонент
не зависит от того каково значения ее компонент  или
или  . И тогда вывод f (v) делается сначала для одной компоненты
. И тогда вывод f (v) делается сначала для одной компоненты 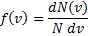 - ф-я распределения ч-ц по скоростям
- ф-я распределения ч-ц по скоростям - названа распределением Максвелла. Она является плотностью вероятности того, что молекула имеет модуль скорости равный v.
- названа распределением Максвелла. Она является плотностью вероятности того, что молекула имеет модуль скорости равный v.
 ф-я распределения ч-ц по энергиям
ф-я распределения ч-ц по энергиям , – это закон распределения частиц по потенциальным энергиям – распределение Больцмана. Здесь n0 – число молекул в единице объёма там, где U = 0.
, – это закон распределения частиц по потенциальным энергиям – распределение Больцмана. Здесь n0 – число молекул в единице объёма там, где U = 0.
 , т.е. таких, в которых энергия превышает энергию активации:z
, т.е. таких, в которых энергия превышает энергию активации:z  Тогда доля активных столкновений составит:
Тогда доля активных столкновений составит: 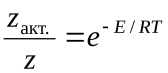 Рассмотрим бимолекулярную газовую реакцию типа: 2А
Рассмотрим бимолекулярную газовую реакцию типа: 2А  , где Р – продукты реакции. Например, это может быть разложение йодистого водорода: 2HJ
, где Р – продукты реакции. Например, это может быть разложение йодистого водорода: 2HJ 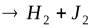
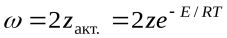 или
или 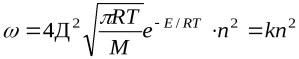 (
( )
)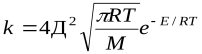
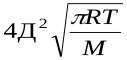 =k
=k  k=k
k=k 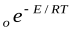 уравнение Аррениуса
уравнение Аррениуса , который оказывается пропорциональным общему количеству столкновений всех молекул в единице объема за единицу времени. В общем виде уравнение Аррениуса для всех типов реакций часто пишут в виде: k=z
, который оказывается пропорциональным общему количеству столкновений всех молекул в единице объема за единицу времени. В общем виде уравнение Аррениуса для всех типов реакций часто пишут в виде: k=z  уравнение Аррениуса
уравнение Аррениуса
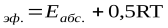

 Рис. 2.5 Энергетическая диаграмма химической реакции. Eисх – средняя энергия частиц исходных веществ Eпрод – средняя энергия частиц продуктов реакции Поскольку температура есть мера средней кинетической энергии частиц, повышение температуры приводит к увеличению доли частиц, энергия которых равна или больше энергии активации, что приводит к увеличению константы скорости реакции (рис.2.6):
Рис. 2.5 Энергетическая диаграмма химической реакции. Eисх – средняя энергия частиц исходных веществ Eпрод – средняя энергия частиц продуктов реакции Поскольку температура есть мера средней кинетической энергии частиц, повышение температуры приводит к увеличению доли частиц, энергия которых равна или больше энергии активации, что приводит к увеличению константы скорости реакции (рис.2.6): Рис. 2.6 Распределение частиц по энергии Здесь nЕ/N – доля частиц, обладающих энергией E; Ei - средняя энергия частиц при температуре Ti (T1 < T2 < T3)
Рис. 2.6 Распределение частиц по энергии Здесь nЕ/N – доля частиц, обладающих энергией E; Ei - средняя энергия частиц при температуре Ti (T1 < T2 < T3) (II.31) Поскольку константа равновесия есть отношение констант скоростей прямой и обратной реакции, можно переписать выражение (II.31) следующим образом:
(II.31) Поскольку константа равновесия есть отношение констант скоростей прямой и обратной реакции, можно переписать выражение (II.31) следующим образом: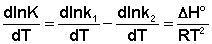 (II.32) Представив изменение энтальпии реакции ΔHº в виде разности двух величин E1 и E2, получаем:
(II.32) Представив изменение энтальпии реакции ΔHº в виде разности двух величин E1 и E2, получаем: (II.33)
(II.33) 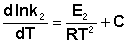 (II.34) Здесь С – некоторая константа. Постулировав, что С = 0, получаем уравнение Аррениуса, где EA – энергия активации:
(II.34) Здесь С – некоторая константа. Постулировав, что С = 0, получаем уравнение Аррениуса, где EA – энергия активации: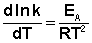 (II.35) После неопределенного интегрирования выражения (II.35) получим уравнение Аррениуса в интегральной форме:
(II.35) После неопределенного интегрирования выражения (II.35) получим уравнение Аррениуса в интегральной форме: (II.36)
(II.36)  (II.37)
(II.37) Рис. 2.7 Зависимость логарифма константы скорости химической реакции от обратной температуры.
Рис. 2.7 Зависимость логарифма константы скорости химической реакции от обратной температуры. (II.38) Зная энергию активации реакции и константу скорости при какой-либо температуре T1, по уравнению Аррениуса можно рассчитать величину константы скорости при любой температуре T2:
(II.38) Зная энергию активации реакции и константу скорости при какой-либо температуре T1, по уравнению Аррениуса можно рассчитать величину константы скорости при любой температуре T2: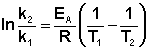 (II.39) При повышении температуры на каждые 10 градусов константа скорости элементарной химической реакции увеличивается в 2 – 4 раза.
(II.39) При повышении температуры на каждые 10 градусов константа скорости элементарной химической реакции увеличивается в 2 – 4 раза.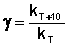 (II.29)
(II.29)  (II.30) Однако правило Вант-Гоффа применимо лишь в узком температурном интервале, поскольку температурный коэффициент скорости реакции γ сам является функцией от температуры; при очень высоких и очень низких температурах γ становится равным единице (т.е. скорость химической реакции перестает зависеть от температуры).
(II.30) Однако правило Вант-Гоффа применимо лишь в узком температурном интервале, поскольку температурный коэффициент скорости реакции γ сам является функцией от температуры; при очень высоких и очень низких температурах γ становится равным единице (т.е. скорость химической реакции перестает зависеть от температуры).


