Министерство здравоохранения и социального развития
Российской Федерации
Государственное образовательное учреждение высшего
профессионального образования
Дальневосточный Государственный медицинский университет
Росздрава.
Пестрикова Т.Ю., В.А. Пушкарь, И.В. Юрасов, О.Б. Сиротина.
МИОМА МАТКИ.
СОВРЕМЕННЫЕ АСПЕКТЫ ДИАГНОСТИКИ,
ТАКТИКИ, ЛЕЧЕНИЯ.
Пособие для врачей.
Хабаровск.
2009.
Составители: д.м.н, профессор Пестрикова Т.Ю., доцент кафедры акушерства и гинекологии В.А. Пушкарь; к.м.н., ассистент кафедры акушерства и гинекологии И.В. Юрасов; к.м.н., зав. отд. ультразвуковой диагностики Дорожной клинической больницы на станции Хабаровск 1 - Сиротина О.Б.
Пестрикова Т. Ю., В.А. Пушкарь, И.В. Юрасов, О.Б. Сиротина, 2009.
Городское общество акушеров-гинекологов.
г. Хабаровск, 2009г.
Рецензент: профессор, д.м.н. Блощинская И.А.
Миома матки остается одной из важнейших проблем практической гинекологии, играющей определенную негативную роль на течении беременности, родов, послеродового периода.
Изучение факторов риска, патогенеза миомы матки направлены на снижение частоты оперативных вмешательств в гинекологических стационарах при данной патологии, отдаленные последствия которых оказывают негативное влияние на качество жизни пациенток.
Актуальной проблемой остается вопрос особенностей течения беременности при наличии миомы матки, связанного с этим увеличение частоты благоприятного течения беременности и исходов родов у женщин.
Решение проблемы реабилитации женщин; страдающих миомой матки, в медицинском и социальном плане; связаны с ранним выявлением заболевания, своевременной коррекцией гормонального и иммунного статуса больных, предпочтительным выбором за органосохраняющими оперативными вмешательствами.
Пособие предназначено для врачей акушеров-гинекологов, клинических ординаторов, врачей УЗД.
УДК 618. 58. ББК. ISBN
Пестрикова Т.Ю., В.А. Пушкарь, И.В. Юрасов, О.Б. Сиротина. 2009г.
Издательство Дальневосточного государственного медицинского университета/
2009.
ОГЛАВЛЕНИЕ.
| №/№
|
| Страницы
|
| 1.
| Нозологическая характеристика миомы матки в МКБ 10. Медико-социальная значимость. Частота.
| 5-6
|
| 2.
| Классификация миомы матки
| 6-13
|
| 3.
| Теории патогенеза миомы матки
| 13-22
|
| 4.
| Морфологическая характеристика узлов миомы матки.
|
|
| 5.
| Характеристика, стадии образования миоматозного узла.
| 22-24
|
| 6.
| Клинические признаки
| 25-27
|
| 7.
| Современные методы диагностики миомы матки
| 27-37
|
| 8.
| Современные методы лечения миомы матки
| 38-56
|
| 9.
| Постгистерэктомический синдром (ПГС).
| 56-66
|
| 10.
| Новые тактические подходы в лечении миомы матки.
| 67-70
|
| 11.
| Влияние миомы матки на беременность
|
|
| 12.
| Прогнозирование быстрого роста миомы матки.
|
|
| 13.
| Профилактика миомы матки.
|
|
| 14.
| Список используемой литературы.
| 74-76
|
Перечень условных обозначений.
| АГПЭ
| Атипическая гиперплазия эндометрия
|
| ВПР
| Врожденные пороки развития
|
| ГПЭ
| Гиперпластический процесс эндометрия
|
| а-ГнРГ
| Агонисты Гонадотропин - релизинг- гормонов
|
| ДВС
| Диссеминированное внутрисосудистое свертывание
|
| ДНК
Е2
| Дезоксирибонуклеиновая кислота
Эстрадиол
|
| ЖГЭ
| Железистая гиперплазия эндометрия
|
| ИППП
| Инфекции, передаваемые половым путем
|
| ИПФР
ИФА
| Инсулиноподобный фактор роста
Иммуноферментный анализ
|
| ЛГ
| Лютеинизирующий гормон
|
| ЛНГ
| Левоноргестрел
|
| ММ
| Миома матки
|
| М-эхо
| Маточное эхо
|
| ОКС
| Операция кесарева сечения
|
| 17 ОПК
ПГС
| 17-гидроксипрогестерона- капроната
Постгистерэктомический синдром
|
| ПРЛ
| Пролактин
|
| ПЦР
| Полимеразная цепная реакция
|
| ПЭ
| Полип эндометрия.
|
| РДВ
| Раздельное диагностическое выскабливание
|
| РП
| Рецепторы прогестерона
|
| РЭ
| Рецепторы эстрадиола
|
| СПКЯ
| Синдром поликистозных яичников
|
| ТОRCH
| Исследование на ТОRCH комплекс (Т-токсоплазмоз, О(others)-
другие инфекции: сифилис, энтеровирусная инфекция, гепати
ты А и В, гонококковая инфекция, листериоз и др.), R
(Rubella) -краснуха
|
| УЗИ
УЗВ
| Ультразвуковое исследование
Ультразвуковой (метод лечения)
|
| ХА
| Хориоамнионит
|
| ХГЧ
| Хорионический гонадотропин человека
|
| ФСГ
| Фолликулостимулирующий гормон
|
| ЦНС
| Центральная нервная система
|
| ЭМА
| Эмболизация маточных артерий
|
ЭФР Эпидермальный фактор роста
Код по МКБ – 10
D 25 Лейомиома матки.
D 25. 0 Подслизистая лейомиома матки.
D 25. 1 Интрамуральная лейомиома матки.
D 25. 2 Субсерозная лейомиома матки.
D 25. 9 Лейомиома матки не уточненная.
Синонимы: Лейомиома, Фиброма, Фибромиома
Частота миомы матки.
● Это наиболее распространенная опухоль матки, истинную частоту которой уточнить невозможно, т.к. 70% миом протекают асимптомно.
● Примерно 1/3 всех обращений в гинекологические клиники составляют обращения по поводу миомы матки.
● По данным аутопсии выявляется у 80% женщин.
● Страдает 20 -25% женщин репродуктивного возраста.
● Наблюдается у каждой 4-5-й женщины старше 35 лет.
● В 2 раза чаще встречается у представителей черной расы.
Миома матки способна к полному регрессу у женщин в период менопаузы, однако у 10-15% больных, в первые 10 лет постменеопаузального периода она может увеличиваться и сочетаться с ГПЭ как у часто рожавших женщин, так и не подвергшихся абортам и выскабливаниям матки, не болевшим воспалительными заболеваниями органов малого таза. Доказательная база свидетельствует о возможности снижении риска развитии миомы матки при длительном приеме комбинированных оральных контрацептивов у женщин.
Скрининг. УЗИ органов малого таза проводится один раз в год, начиная с 25 летнего возраста (В.И.Кулаков, И.Б. Манухин, Г.М. Савельева с соавт., 2007).
Факторы риска по развитию миомы матки:
1. Наличие миомы у ближайших родственников повышает риск в 3 раза,
2. Ожирение (при массе тела более 70 кг, риск развития миомы матки в 3 раза выше, чем при массе тела менее 50 кг),
3. Бесплодие повышает риск развития миомы матки в 2 раза,
4. Отсутствие родов и лактации к 30 годам,
5. Аборты,
6. Длительная неадекватная контрацепция,
7. Хронические, подострые и острые воспаления матки и придатков,
8. Стрессы,
9. Ультрафиолетовое облучение, 10.Образование кист и кистом яичников.
На возраст 44–45 лет приходится самая высокая частота оперативных вмешательств (чаще всего это удаление матки), показанием к которым является быстрый рост миомы матки, ее большие размеры, сочетание миомы матки с патологией эндометрия (гиперплазия, атипическая гиперплазия) и яичников: доброкачественные и злокачественные опухоли (Сидорова И.С. 2006).

| Рождающийся субмукозный узел
| |


| Субсерозный узел лейомиомы
| |

| Субмукозный узел миомы
Интралигаментарный узел
| |

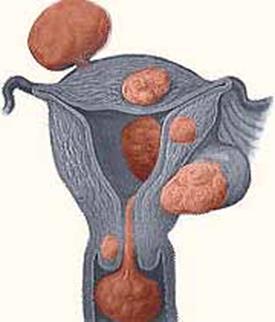
Рис.1. Типы расположения узлов в матке.
Классификация миомы
По локализации узлов различают:
1. миому матки с интрамуральным ростом,
2. субсерозную лейомиому матки,
3. субмукозную миому,
4. интралигаментарную,
5. паразитирующую миому матки.
(В.И.Кулаков, Г.М.Савельева, И.Б. Манухин., 2007).
Рис.2. Типы расположения субмукозных узлов в полости матки.
Для оценки топографии субсерозных миоматозных узлов, выделяют следующие варианты их расположения (Рис.3).
♦ 0 тип- миоматозный узел на ножке, полностью находится в брюшной
полости,
♦ I тип- менее 50% объема узла располагается межмышечно, большая
его часть располагается в брюшной полости
♦ II тип- более 50% объема миоматозного узла располагается
межмышечно, меньшая его часть располагается в брюшной
полости.
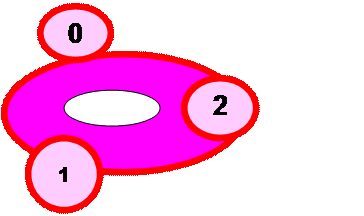
Рис. 3 Топография расположения субсерозных миоматозных узлов.
Миоматозных узлов.
Типичное расположение узлов:
1.субсерозное,
2. интрамуральное,
3.субмукозное - 5-10%.
4. субсерозные узлы. (Центробежные, растут в сторону брюшной полости,
они очень подвижны, легко подвергается перекручиванию).
Атипичное расположение миоматозных узлов:
1. шеечное (частота которых составляет 2-5%),
2. интралегаментарное расположение (частота их составляет до 5%).
Если опухоль с субмукозным ростом, располагается преимущественно в мышечном слое (более 1/3 объема узла), используют термин «межмышечная опухоль с центрипетальным ростом» (А.Н.Стрижаков, А.И. Давыдов, 1997).
Каждый узел имеет независимое происхождение. Рост узла всегда начинается в мышечном слое. Каждый узел имеет независимое происхождение.
Миоматозные узлы образуются в зонах со сложным переплетением мышечных волокон, в зонах «дистрофических нарушений»:
А) по средней линии матки,
Б) вблизи трубных углов,
В) сбоку от шейки матки
(А.Н.Стрижаков, А.И. Давыдов, 1997).
Рис.5. Показатели эффективности лечения миомы матки
Гестагенными препаратами.
8). Теория нарушения процессов апоптоза, контролируемого аутокринно - паракринной системой. Согласно данной концепции, рост лейомиомы контролируется аутокринно -паракринной системой, которая «запускает» синтез факторов роста (J. Andersen., 1996., Dixon D, He H, Haseman J. 2000, А.Л.Тихомиров, Д.М. Лубнин., 2006.)
Во время многократно повторяющихся менструальных циклов, в I фазу цикла на поверхности клеток миометрия накапливаются рецепторы к прогестерону, к различным факторам роста: ЕGF, TGF-ß, b–FGF (Iи II, инсулиноподобные факторы, трансформирующий фактор роста, фактор роста фибробластов, эпидермальный фактор роста, и других). Основными факторами роста, обнаруживаемых в нормальном миометрии и в миоматозных узлах являются: инсулиподобный фактор роста, эпидермальный фактор роста. Повышенное содержание факторов роста и их рецепторов в миоматозной матке, регулирующих процессы васкуляризации, приводит к возникновению патологических кровотечений
В норме, после овуляции под действием прогестерона, вырабатываемого желтым телом, происходит гиперплазия миометрия (А.Л.Тихомиров, Д.М. Лубнин., 2006). Если беременность не наступает, концентрация прогестерона в крови снижается, активизируется процесс апоптоза и избыток гладкомышечных клеток элиминируется, что обуславливает количественное постоянство клеточного состава миометрия.
Данный процесс обеспечивает сохранение нормальных размеров матки от цикла к циклу, и не дает ей увеличиться. В случаях воздействия повреждающих факторов, апоптоз гладкомышечных клеток задерживается, происходит избыточное накопление гипертрофированных клеток от одного цикла к другому. Судьба накопившихся клеток миометрия различна: часть поврежденных клеток миометрия все же элиминируется, из другой части формируется зачаток миоматозного узла, его ядро (А.Л.Тихомиров, Д.М. Лубнин., 2006).
При изучении факторов, регулирующих апоптоз в миометрии, был обнаружен онкопротеин, блокирующий апоптоз. При миоме матки его колличество увеличивается, что способствует росту опухоли (Полякова В.А., 2004).
Образовавшаяся кооперация клеток в результате гипертрофии и пролиферации генетически измененных клеток миометрия – «клон клеток» или «активный зачаток» активизирует аутокринно- паракринные механизмы, ускоряет синтез всех ключевых факторов роста, которые усиливают рост узла через процессы пролиферации и образование соединительной ткани в миометрии (Сидорова И.С., 2006)
В самом узле также активизируется локальная ферментативная система и ее основной фермент - ароматаза, которая переводит андрогены в эстрогены, т.е. формируется автономная локальная система продукции эстрогенов.
С этого момента физиологические колебания половых гормонов в организме для формирования миоматозного узла перестают быть основными, поскольку синтезируемый в узле эстрадиол запускает в миоматозном узле свой аутокринно-паракринно-интракринный механизм активизации факторов роста, процесс апоптоза клеток ингибируется, развивается миома матки (А.Л.Тихомиров, Д.М. Лубнин., 2006)..
9). Исследования, посвященные изучению роли пролактина в патогенезе миомы матки показали, что у больных моложе 40 лет содержание пролактина в плазме находится в пределах доверительного интервала нормы здоровых женщин, а у больных старше 40 лет - в значительной мере превышает ее. Установлено, что клетки миомы матки также секретируют пролактин. Однако роль этого гормона в патогенезе миомы матки и его влияние на рост опухоли еще уточняются (Е.М. Вихляева и соавт. 1997, Г.А. Паллади 1986).
По данным E.A. Stewart et al. (1996) блокатор прогестеронных рецепторов RU 486 подавляет синтез пролактина в миоматозных узлах и в нормальном миометрии. Авторы полагают, что поскольку RU 486 вызывает торможение роста миоматозных узлов у определенной группы больных, т.е. пролактин, наряду с прогестероном, м.б. одним из факторов роста миоматозных узлов
10).Предполагается, что соматотропин (гормон роста) также может играть роль инициатора развития миомы матки. Это подтверждается тем, что у женщин с акромегалией миомы матки возникают чаще. Наличие мРНК- рецептора соматотропина в ткани миометрия и миомы подтверждает возможность действия соматотропина непосредственно на миометрий.
11). Теория образования "активной" зоны (зачатка) роста в миометрии, который приводит к нарушению метаболизма тканей, к росту опухоли. На начальном этапе рост миомы идет без признаков дифференцировки, затем с дифференцировкой и созреванием (Озолиня Л. А. 2008).
В "активной" зоне изменяется регионарная гемодинамика (происходит нарушение венозного оттока, увеличение калибра маточных артерий и вен, нарушение водно-электролитного баланса, белкового равновесия, иммунологического статуса, обмена железа, гиповолемия (Озолиня Л.А.2008).
В большинстве клинических наблюдений в миометрии вокруг тонкостенного венозного сосуда сразу закладываются несколько зачатков роста, но дальнейший рост и развитие в микроскопический и макроскопический узел происходят с разной скоростью и не всегда в одно и то же время.
Миома матки имеет автономный рост, обусловленный воздействием ростовых факторов и образованием гормонально чувствительных и ростовых рецепторов. Как у всякой опухоли, процесс роста и развития миомы матки сопровождается образованием новых сосудов (неоангиогенез), но сосуды миомы отличаются от нормальных. Они имеют синусоидный характер с низко резистентным кровотоком. Для пролиферирующих, быстро растущих миом характерно наличие клеток с крупным и гиперхромным ядром, содержащее повышенное количество ДНК. Хотя митотическая активность миом матки, как правило, низкая, клетки миомы экспрессируют онкобелки пролиферации (Ki–67) и онкобелки, снижающие процесс апоптоза (bcl–2, bax).
Начало возникновения узлов миомы матки приходится на 30 лет, когда у женщин накапливаются соматические, гинекологические заболевания и нейроэндокринные нарушения.
Суммирование патологических факторов в этом возрасте вызывает соматическую мутацию клеток в органах репродуктивной системы и вероятно, играет ведущую роль на стадии формирования пролиферативного компонента при регенерации поврежденных клеток миометрия.
Для последующего роста узлов опухоли требуется дальнейшее накопление неблагоприятных факторов, вызывающих опухолевую прогрессию: отсутствие родов и лактации к 30 годам, аборты, длительная неадекватная контрацепция, хронические, подострые и острые воспаления матки и придатков, стрессы, ультрафиолетовое облучение, образование кист и кистом яичников.
На возраст 44–45 лет приходится самая высокая частота оперативных вмешательств (чаще всего это удаление матки), показанием к которым является быстрый рост миомы матки, ее большие размеры, сочетание миомы матки с патологией эндометрия (гиперплазия, атипическая гиперплазия) и яичников (доброкачественные и злокачественные опухоли).
Рост опухоли усиливается в возрасте 35–45 лет, когда снижается функциональная активность яичников и их чувствительность к гонадотропной стимуляции, синхронно возрастает продукция гонадотропных гормонов, возникает хроническое функциональное напряжение систем регуляции (нейроэндокринной, гормональной, иммунной) и чаще всего нарушается гемостаз и гомеостаз.
Фоном для усиленного роста миоматозных узлов в пременопаузальном возрасте является не постепенный, достаточно медленный переход к окончанию гормональной функции яичников; а скачкообразный, слишком быстрый и ранний климакс или чрезмерно замедленный переход к менопаузе (поздняя менопауза 53–55 лет). Отрицательную роль играют длительно существующие нейроэндокринные нарушения, патологический климакс, действие факторов, стимулирующих гиперпластические и пролиферативные процессы в организме (ожирение, нарушение углеводного и липидного обмена, эндометриоз, аденомиоз). Развитие опухоли от «зачатка роста» и микроскопического узелка без признаков клеточной дифференцировки до макроскопического узла, определяемого при бимануальном исследовании или с помощью УЗИ, занимает около 5 лет. Изучение молекулярно-биологических звеньев патогенеза аденомиоза, установило общность его развития с механизмами развития гиперпластических процессов эндометрия и миомы матки (И.С. Сидорова, Е.А.Коган, А.Л. Унанян, 2006 (Рис.6).Миома матки и эндометриоз имеют разнообразный преморбидный фон: развиваются у женщин с отягощенным акушерско-гинекологическим анамнезом (самопроизвольные и искусственные аборты, лечебно-диагностические выскабливания, патологические роды), однако могут возникать и у молодых женщин (девушек) без фактов травматического или воспалительного повреждения внутренних структур матки. В этих случаях обращает на себя внимание высокая частота наследственной отягощенности по материнской линии.
Несмотря на то, что оба заболевания признаны дисгормональными, гормональные нарушения (в том числе гиперэстрогения и дефицит прогестерона) в их генезе оказались не основными и не ведущими.

Рис. 6. Схема патогенеза аденомиоза, миомы матки.
Доказано, что во всех случаях вышеперечисленной патологии, имеет место преобладание процессов пролиферации над апоптозом, высокая экспрессия факторов роста, особенно фактора EGF - инсулиноподобных факторов I и II, играющих ключевую роль в миграции эндотелиальных клеток, в процессах неоангиогенеза (И.С. Сидорова, с соавт., 2006).
12) Роль вегетативной нервной системы в формировании миомы
матки. Оптимальным состоянием вегетативной нервной системы в физиологических условиях является состояние нормотонии или не резко выраженной симпатикотонии. Крайне патологическим состоянием считается общая или сегментарная симпатикотония, имеющая место при миоме матки, следствием которой являются нарушения центрального и периферического кровообращения, гипоксия тканей, усиленная пролиферация тканей миометрия (Фролова Е.С., Ишпахтин Ю.И., Гельцер БИ., 2004).
Стадии образования миоматозного узла:
I стадия. Образование активной зоны роста в миометрии (вблизи микрососудов, характеризуются высоким уровнем обмена и сосудисто- тканевой проницаемостью, что способствует росту опухоли).
II стадия. Рост опухоли без признаков дифференцировки (микроскопически определяется узел).
III стадия. Рост опухоли с ее дифференцировкой и созреванием, макроскопически определяется узел. (А.Н.Стрижаков, А.И. Давыдов, 1997).
Клиника миомы матки.
( У 50-60% больных, клиники нет, тогда как 4% беременностейпротекает на фоне миомы матки).
● Боли. Острые боли возникают при нарушении кровобращения в узле миомы, прогрессирование которых может привести к развитию клинической картины острого живота. Схваткообразные боли во время менструации -признак подслизистой миомы и свидетельствует о давлении патологического процесса. Постоянный и выраженный болевой синдром сопровождает интралигаментарные миомы, вследствие давления на нервное сплетение в области внутреннего зева. Боли, связанные с менструацией всегда подозрительны на сочетание с эндометриозом. Боли могут быть за счет патологии других органов: колита, цистита, аднексита, эндометриоза.
При нарушении питания узла развивается клиника острого живота, боли внизу живота сопровождаются наличием лейкоцитоза, сдвигом лейкоцитарной формулы влево, повышением СОЭ. При вагинальном осмотре находят увеличенную и болезненную, если произошел некроз субсерозного узла его находят отдельно от матки в виде пальпируемой опухоли, которое нередко принимается за овариальное образование. При некрозе субмукозного узла за счет восходящей инфекции может произойти нагноение или абсцедирование узла. В данном варианте боли будут усиливаются внизу живота, у женщины повышается температура тела, появляется озноб.
При отеке узла, чаще интерстициального, он становится мягким, на разрезе имеет бледную окраску, в нем определяются полости, наполненные жидкостью от соломенно-желтого до зеленовато-красно-коричневого цвета, формируются так называемые «ремаляционные кисты».
При рождении субмукозного миоматозного узла может произойти выворот матки. Возможен разрыв кровеносных сосудов, опухоли с кровотечением в брюшную полость (Полякова В.А., 2004).
● Рост опухоли (чаще рост миомы имеет медленный темп). Быстрым ростом считается увеличение параметров миомы матки на 4 недель беременности за год или за более короткий промежуток времени. Причинами роста миомы матки могут быть ускоренные процессы пролиферации в ткани опухоли, злокачественное перерождение, развитие отека в узле вследствие нарушения кровобращения).
● Кровотечения. Нормальная менструальная кровопотеря составляет 60-80 мл (кровопотеря свыше 80 мл приводит к развитию ЖДА). Мено – и менометроррагия- наиболее частый симптом миомы. Обильные, длительные менструации – признак субмукозного роста опухоли.Продолжительность и интенсивность маточных кровотечений с ростом миомы увеличивается. Позднее могут присоединиться ациклические кровотечения. В результате менструальных и межменструальных кровотечений развивается хроническая постгеморрагическая анемия, гиповолемия, миокардиодистрофия, изменение гемостаза, что приводит к нарушению функции жизненноважных органов.Происхождение их связано с нарушением сократительной способности матки; увеличением менструирующей поверхности за счет роста опухоли; особенностями строения сосудов, кровоснабжающих подслизистые миоматозные узлы (утрачена адвентициальная оболочка, что повышает их проницаемость), снижает сократительную активность при нарушении целостности сосудов, изъязвлением эндометрия при подслизистой миоме; нарушением отслойки эндометрия из-за дисгормональных нарушений. (А.Н.Стрижаков, А.И. Давыдов, 1997).
●Нарушение функции соседних органов. Даже узлы небольших размеров могут вызывать нарушения функции смежных органов, что связано с общими механизмами иннервации, крово - и лимфообращения половой и мочевой систем у женщин. Узлы могут оказывать давление на мочевой пузырь, мочевыводящие пути, способствовать развитию гидроуретера, гидронефроза, пиелонефрита, позадишеечное расположение узла затрудняет дефекацию, возможен лимфостаз.
● Бели -водянистые, водянисто-слизистые обычно имеют место при больших опухолях. При некрозе слизистой оболочки, покрывающей миоматозный узел, они жидкие, зловонные, бурого цвета.
● Другие осложнения: ощущение тяжести внизу живота; лейкоцитоз, нарушение свертываемости крови (при длительности заболевания более 10лет); невынашивание беременности, преждевременные роды, кровотечения в родах и после них; х ронические тазовые боли.
По Ю.Д.Ландеховскому.
I тип.
o Полость матки ассиметрична с удлинением, расширением и закруглением одного из углов, иногда с участками просветления
o Подобная картина наблюдается при расположении подслизистых и межмышечных миоматозных узлов с центрипетальным ростом в передней или задней стенках матки ближе к одному из ее углов
II тип.
o Округлая форма полости матки с участками просветления или дефектами наполнения, четко выраженными при не тугом заполнении контрастом,
o Данная рентгенограмма характерна для центрального расположения подслизистого узла, исходящего из передней или задней стенок матки.
III тип.
o Чашеобразная форма с неровными контурами в дне, дефектами наполнения или участками просветления,
При подслизистой миоме, исходящей из передней или задней стенок матки ближе к ее дну.
IVтип.
o Полость матки неправильной треугольной формы с закругленными контурами.
o Изображение появляется при небольших подслизистых узлах, исходящих из передней или задней стенок матки ближе к ее внутреннему зеву.
V тип.
o Вытянутая полость матки с латеральным смешением и дефектами наполнения по боковому контуру,
o Подобная картина имеет место при подслизистых узлах миомы, исходящих из ребра матки, при этом противоположный контур выпячивается и закругляется.
VI тип.
o Полость матки в виде полумесяца или серповидной формы,
o Полулунная форма наблюдается при локализации межмышечных узлов миомы сравнительно больших размеров в области дна матки,
o Серповидная- при опухолях, локализованных в ребре матки.
УЗИ органов малого таза.
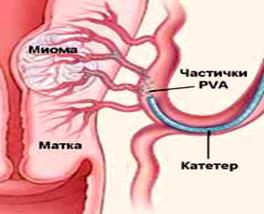
Метод имеет большие перспективы, позволяет получить точную информацию о величине и локализации миоматозных узлов еще до операции. Трехмерная эхография. Допплерометрическое исследование и цветное доплеровское картирование, которое позволят оценить степень васкуляризации узлов. С внедрением ЭМА в лечении миомы матки, важным является определение особенностей кровобращения в миоматозных узлах по данным допплерографии.
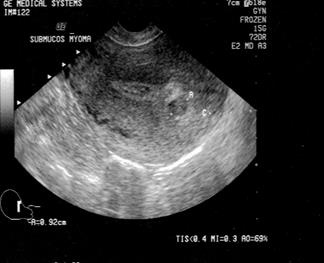
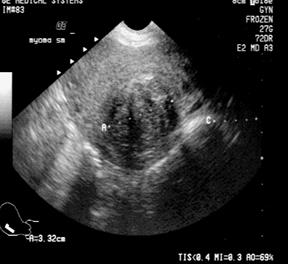
Рис. 7. Миома матки. (Cнимки сделаны в отделении УЗД ДКБ на ст. Хабаровск 1).
● Гидросонография -используется для диагностики субмукозного роста миомы матки. Введение контраста улучшает определение размеров опухоли, ее пространственное отношение к стенкам полости матки, выраженность межмышечного компонента миоматозного узла, точную локализацию его по отношению к внутреннему зеву, маточным углам, позволяет оценить толщину миометрия до серозного покрова, выявить сопутствующую патологию эндометрия. Чувствительность метода составляет 100% (В.И.Кулаков., Г.М.Савельева., И.Б. Манухин. с соавт. 2007).
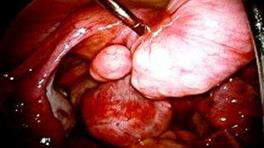
● Диагностическая лапароскопия. Лапароскопия.
Рис. 8. Лапароскопия. Миома матки. (Озолиня Л. А., 20009).
Достоверность диагностики миомы с субмукозным ростом:
o ГС- 99,2%
o Гистеросальпингография-96,4%,
o УЗД-95,7%
(А.Н.Стрижаков, А.И. Давыдов, 1997).
● Ангиография. Метод до настоящего времени не нашел широкого применения, но оно является обязательным при проведении ЭМА.
Особенностью кровоснабжения доброкачественных узлов миомы матки является формирование перифиброидного сплетения; образованного радиальными, реже – дугообразными артериями, которые отдают внутрь узла терминальные артерии мелкого калибра. Метод позволяет определить патологический кровоток, особенности кровоснабжения матки (Рис.
Рис.9. Миома матки. Этапы ЭМА.
Метод используется для топографической диагностики гигантских миоматозных узлов, для контроля эффективности ЭМА.
Чувствительность метода, без контрастирования, для выявления патологии миометрия и эндометрия составляет 67%, с контрастированием - 98%.
При обследовании больных с миомами матки особое значение приобретает онкологическая настороженность: необходимо исключить опухоли яичников, гиперпластические предраковые процессы, рак эндометрия.
Одним из важнейших исследований является в комплексной диагностике больных миомой матки является раздельное диагностическое выскабливание полости матки и цервикального канала с последующим гистологическим исследованием соскобов, результаты которых определяют дальнейшую тактику лечения больной. Выполнение тщательного раздельного диагностического выскабливания полости матки и цервикального канала являются обязательной процедурой перед оперативным вмешательством у больной.
Возможно заращение цервикального канала, проходимость которого можно восстановить во время зондирования, при этом разрушаются сращения в канале и из полости матки нередко в большом количестве изливаются гноевидные выделения. При гистологическом исследовании которых нередко обнаруживается саркома матки или рак эндометрия.
Диагноз «растущая миома матки» в постменопаузе следует ставить осторожно. Необходимо исключить причину увеличения матки, который в постменопаузе может быть связан с патологией яичников, либо со злокачественным процессом эндометрия. Важное значение имеет определение уровней гонадотропных гормонов, стероидных и других гормонов.
Достоверные УЗИ - признаки саркомы матки:
1). Быстрый рост узла или матки,
2). Характерна однородная «клеточная» эхоструктура среднего уровня
звукопроводимости с наличием повышенной эхогенности тонких тяжей,
соответствующих соединительнотканным прослойкам.
3). Наличие обширного беспорядочного расположения сосудов и мелких
лакунарных скоплений контрастированной крови.
4). Разъединенные сосуды, образование из них «сосудистых озер» в
некротической ткани указывают на быстрорастущую, злокачественную
опухоль, склонную к центральному некрозу.
5). При доплеровском исследовании: по всему объему опухоли диффузно
усилен кровоток (средне- резистентный).
Рис.10. Субсерозный узел миомы матки.
(Cнимок сделан в отделении УЗД ДКБ на ст. Хабаровск 1).


Рис.11. Миома матки на ножке (М.И.Буланов., 2005).
● Межмышечная миома с центрипетальным ростом -промежуточный вариант межмышечной миомы с тенденцией к внутреннему росту. Растущий узел постепенно отклоняет полость матки в противоположную сторону и деформирует М-эхо.
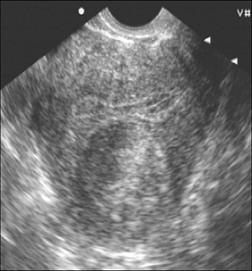
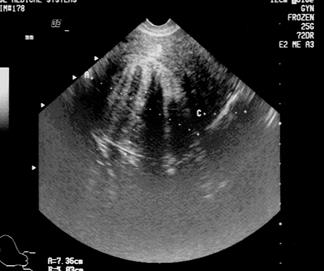
Рис.12. Межмышечная миома матки.
(Cнимки сделаны в отделении УЗД ДКБ на ст. Хабаровск 1).
●Эхографическим критерием субмукозной миомы считается деформация полости матки не менее, чем на половину диаметра узла.
На фоне маточного кровотечения - эхонегативная зона выполняет роль своеобразного контраста, позволяющего идентифицировать опухоль от стенок матки (Dodson M.J., 1995., А.Н.Стрижаков, А.И. Давыдов, 1997, М.И.Буланов., 2005).
Трансвагинальное УЗД
(дает уточнение деформаций срединного М-эха)
● Для субмукозных узлов характерно наличие округлой или овальной формы образования на фоне расширения полости матки.Образование, как правило, имеет ровные контуры, среднюю эхогенность, идентичную миометрию.
Эхографически миоматозный узел визуализируется как образование, локализованное в толще миометрия. Оно имеет округлую (или овоидную) форму с ровными контурами. Эхогенность обычно несколько снижена. (А.Н.Стрижаков, А.И. Давыдов, 1997 ).
У миомы нет анатомической капсулы, что, можно заметить при эхографии небольших узлов без нарушения трофики.
Граница между узлом и миометрием определяется только за счет разницы в эхогенности этих структур (М.И.Буланов., 2005).


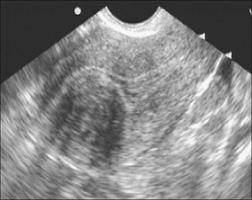

Рис.13. Миоматозные узлы с центрипетальным ростом.
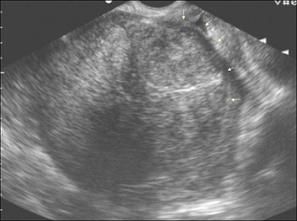
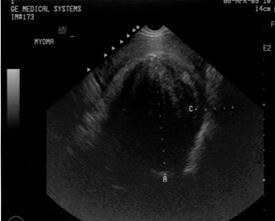
Рис. 14. Гигантский субмукозный узел.
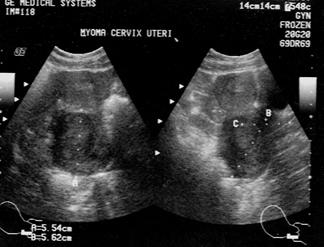

Рис. 15. Миома матки. (Cнимки сделаны в отделении УЗД ДКБ на
ст. Хабаровск 1).
● УЗИ признаки нарушения кровообращения в миоматозном узле.
Возникают в 20-40% миоматозных узлов. Причиной некроза узла является нарушение питания его за счет дегенеративных изменений сосудов, кровоснабжающих узел или за счет перекрута «ножки» субсерозного узла, что случается при больших размерах узлов, либо при наличии субсерозного узла на тонкой «ножке». Первым этапом нарушения питания узла является его отек, который проявляется существенным снижением эхогенности и диффузно - неоднородной эхоструктурой узла. При дальнейшем ухудшении кровообращения в узле развиваются некротические изменения, визуализируемые как эхонегативные участки, имеющие неправильную и разнообразную форму.

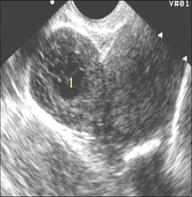
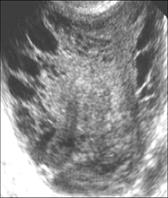

Рис.16. Некроз в узлах миомы матки.
Исходом асептического некроза миоматозного узла может стать процесс гиалиноза, при котором некротические массы замещаются однородным гиалиновым содержимым. Участки постнекротического гиалиноза обычно эхонегативны, в ряде случаев их содержимое может напоминать мелкодисперсную несмещаемую взвесь. Контуры этих образований четкие, неровные, имеют повышенную эхогенно