

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...
Топ:
Эволюция кровеносной системы позвоночных животных: Биологическая эволюция – необратимый процесс исторического развития живой природы...
Устройство и оснащение процедурного кабинета: Решающая роль в обеспечении правильного лечения пациентов отводится процедурной медсестре...
Установка замедленного коксования: Чем выше температура и ниже давление, тем место разрыва углеродной цепи всё больше смещается к её концу и значительно возрастает...
Интересное:
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Распространение рака на другие отдаленные от желудка органы: Характерных симптомов рака желудка не существует. Выраженные симптомы появляются, когда опухоль...
Финансовый рынок и его значение в управлении денежными потоками на современном этапе: любому предприятию для расширения производства и увеличения прибыли нужны...
Дисциплины:
|
из
5.00
|
Заказать работу |
Содержание книги
Поиск на нашем сайте
|
|
|
|
Оксиды-сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления -2.
| Формула | Название | Формула | Название |
| CO | оксид углерода (II) | Fe2O3 | оксид железа (III) |
| NO | оксид азота (II) | CrO3 | оксид хрома (VI) |
| N2O5 | оксид азота (V) | Mn2O7 | оксид марганца (VII) |
ПОЛУЧЕНИЕ ОКСИДОВ.
| Окисление кислородом | простых веществ | 2Mg +O2=2MgO |
| сложных веществ | 2H2S+3O2=2H2O+2SO2 | |
| Разложение | нагреванием солей | СaCO3=CaO+CO2 
|
| нагреванием оснований | Cu (OH)2=CuO+H2O | |
| нагреванием кислородсодержащих кислот | H2SO3=H2O+SO2 
| |
| нагреванием высших оксидов | 4CrO3=Cr2O3+3O2 
| |
| Окисление низших оксидов | 4FeO+O2=2Fe2O3 | |
| Вытеснение летучего оксида менее летучим | Na2CO3+SiO2=Na2SiO3+CO2 
|
КЛАССИФИКАЦИЯ И ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДОВ.
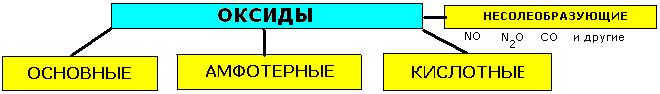
| ||
| Основные-реагируют с избытком кислоты с образованием соли и воды. Основным оксидам соответствуют основания. 1.Взаимодействие с водой(оксиды щелочных и щелочноземельных мет.) CaO+H2O=Ca(OH)2 2.Все-с кислотами МgO+2HCl=MgCl2+H2O 3.С кислотными оксидами CaO+CO2=CaCO34.С амфотерными оксидами Li2O+Al2O3=2LiAlO2 | Амфотерные (ZnO, Al2O3,Cr2O3, MnO2) 1.Взаимодействуют как с кислотами, так и с основаниями. ZnO+2HCl=ZnCl2+H2O ZnO+2NaOH+H2O=Na2[Zn(OH)4] 2.Реагируют с основными и кислотными оксидами ZnO+CaO=CaZnO2 ZnO+SiO2=ZnSiO3 | Кислотные-реагируют с избытком щелочи с образованием соли и воды. Кислотным оксидам часто соответствуют кислоты. 1.Большинство взаимодействуют с водой SO3+H2O=H2SO4 2.Со щелочами NaOH+SiO2=Na2SiO3+H2O 3.С основными оксидами SiO2+CaO=CaSiO3 4.С амфотерными оксидами Al2O3+3SO3=Al2(SO4)3 |
Кислоты.
Рассмотрим, что происходит при растворении кислот в воде и запишем соответствующие уравнения.
Диссоциация кислот:
HCl  H+ + Cl-
H+ + Cl-
HNO3  H+ + NO3-
H+ + NO3-
Диссоциация многоосновных кислот происходит ступенчато:
первая ступень H2S  H+ + HS-
H+ + HS-
вторая ступень HS-  H+ + S2-
H+ + S2-
Из уравнений диссоциации видно, что общим для всех кислот является присутствие в растворе катионов водорода(H+).
На основании этого можно дать определение кислотам с точки зрения Теории электролитической диссоциации:
Кислоты –
это электролиты, при диссоциации которых в качестве катионов образуются только ионы водорода (H+).
Именно катионы водорода являются причиной общих свойств всех кислот: они имеют кислый вкус, изменяют окраску индикаторов, взаимодействуют с металлами, основными оксидами, основаниями.
Химические свойства кислот
1) Диссоциация
HCl  H+ + Cl-
H+ + Cl-
2) Взаимодействие растворов кислот с металлами:
2HCl + Zn = ZnCl2 + H2#
2H+ + 2Cl- + Zn0 = Zn2+ + 2Cl- + H20#
2H+ + Zn0 = Zn2+ + H20#
3) Взаимодействие кислот с основными оксидами:
H2SO4 +MgO = MgSO4 + H2O
2H+ + SO42- +MgO = Mg2+ + SO42- + H2O
2H+ +MgO = Mg2+ + H2O
4) Взаимодействие кислот с основаниями (реакция нейтрализации):
HNO3 + NaOH = NaNO3 + H2O
H+ + NO3- +Na+ + OH- = Na+ + NO3- + H2O
H+ + OH- = H2O
5) Кислоты могут реагировать с солями, если образуется газ, осадок или слабый электролит
H2SO4 + K2CO3 = K2SO4 + CO2# + H2O
2Н+ + SO42- + 2K+ + CO32- = 2K+ + SO42- + CO2# + H2O
2Н+ + CO32- = CO2# + H2O
H2SO4 + Ва(NO3)2 = ВаSO4$ + 2HNO3
2Н+ + SO42- + Ba2+ + 2NO32- = BaSO4$ + 2H+ + 2NO32-
Ва2+ + SO42- = ВаSO4$
H2SO4 + 2NaF = Na2SO4 + 2HF
2Н+ + SO42- + 2Na+ +2F- = 2Na+ + SO42- + 2HF
Н+ + F- = HF
Сокращенные ионные уравнения этих взаимодействий еще раз показывают, что именно катионы водорода (H+) участвуют в реакциях со стороны кислот.
Основания.
Рассмотрим, что происходит при растворении оснований в воде и запишем соответствующие уравнения. Необходимо помнить, что растворимые в воде основания называются щелочами.
Диссоциация оснований:
NaOH D Na+ + OH-
KOH D K+ + OH-
Диссоциация многокислотных оснований происходит ступенчато:
первая ступень Ba(OH)2 D BaOH+ + OH-
вторая ступень BaOH+ D Ba+ + OH-
Из уравнений диссоциации видно, что общим для всех оснований является присутствие в растворе гидроксид-ионов(OH-).
Основания
– это электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы (OH-).
Именно гидроксид-ионы являются причиной общих свойств всех оснований:
изменение окраски индикаторов (для растворимых оснований – щелочей), взаимодействие с кислотными оксидами, с кислотами, с растворами солей.
|
|
|

Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим...

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...

Автоматическое растормаживание колес: Тормозные устройства колес предназначены для уменьшения длины пробега и улучшения маневрирования ВС при...

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...
© cyberpedia.su 2017-2025 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!