Окисление пирувата до ацетил-КоА происходит при участии ряда ферментов и коферментов, объединенных структурно в мультиферментную систему, получившую название «пируватдегидрогеназный комплекс».
На I стадии этого процесса пируват (рис. 10.8) теряет свою карбоксильную группу в результате взаимодействия с тиаминпирофосфатом (ТПФ) в составе активного центра фермента пируватдегидрогеназы (E1). На II стадии оксиэтильная группа комплекса E1–ТПФ–СНОН–СН3 окисляется с образованием ацетильной группы, которая одновременно переносится на амидлипоевой кислоты (кофермент), связанной с ферментом дигидроли-поилацетилтрансферазой (Е2). Этот фермент катализирует III стадию – перенос ацетильной группы на коэнзим КоА (HS-KoA) с образованием конечного продукта ацетил-КоА, который является высокоэнергетическим (макроэргическим) соединением.
На IV стадии регенерируется окисленная форма липоамида из восстановленного комплекса дигидролипоамид–Е2. При участиифермента дигидролипоилдегидрогеназы (Е3) осуществляется перенос атомов водорода от восстановленных сульфгидрильных групп дигидролипоамида на ФАД, который выполняет роль простетической группы данного фермента и прочно с ним связан. На V стадии восстановленный ФАДН2 дигидро-липоилдегидрогеназы передает водород на кофермент НАД с образованием НАДН + Н+.
Процесс окислительного декарбоксилирования пирувата происходит в матриксе митохондрий. В нем принимают участие (в составе сложного мультиферментного комплекса) 3 фермента (пируватдегидрогеназа, ди-гидролипоилацетилтрансфераза, дигидролипоилдегидрогеназа) и 5 кофер-ментов (ТПФ, амид липоевой кислоты, коэнзим А, ФАД и НАД), из которых три относительно прочно связаны с ферментами (ТПФ-E1, ли-поамид-Е2 и ФАД-Е3), а два – легко диссоциируют (HS-KoA и НАД).

Рис. 10.8. Механизм действия пируватдегидрогеназного комплекса.
Е1 - пируватдегидрогеназа; Е2 - ди-гидролипоилацетилтрансфсраза; Е3 -дигидролипоилдегидрогеназа; цифры в кружках обозначают стадии процесса.
Все эти ферменты, имеющие субъединичное строение, и коферменты организованы в единый комплекс. Поэтому промежуточные продукты способны быстро взаимодействовать друг с другом. Показано, что составляющие комплекс полипептидные цепи субъединиц дигидролипоил-ацетилтрансферазы составляют как бы ядро комплекса, вокруг которого расположены пируватдегидрогеназа и дигидролипоилдегидрогеназа. Принято считать, что нативный ферментный комплекс образуется путем самосборки.
Суммарную реакцию, катализируемую пируватдегидрогеназным комплексом, можно представить следующим образом:
Пируват + НАД+ + HS-KoA –> Ацетил-КоА + НАДН + Н+ + СO2.
Реакция сопровождается значительным уменьшением стандартной свободной энергии и практически необратима.
Образовавшийся в процессе окислительного декарбоксилирования аце-тил-КоА подвергается дальнейшему окислению с образованием СО2 и Н2О. Полное окисление ацетил-КоА происходит в цикле трикарбоновых кислот (цикл Кребса). Этот процесс, так же как окислительное декарбо-ксилирование пирувата, происходит в митохондриях клеток.
Значение:участие в анаэробной фазе дыхания и спиртовом брожении
Окислительное декарбоксилирование пирувата сопровождается образованием NADH, поставляющим электроны в дыхательную цепь и обеспечивающим синтез 3 молей АТФ на 1 моль пирувата путём окислительного фосфорилирования.
Билет 45
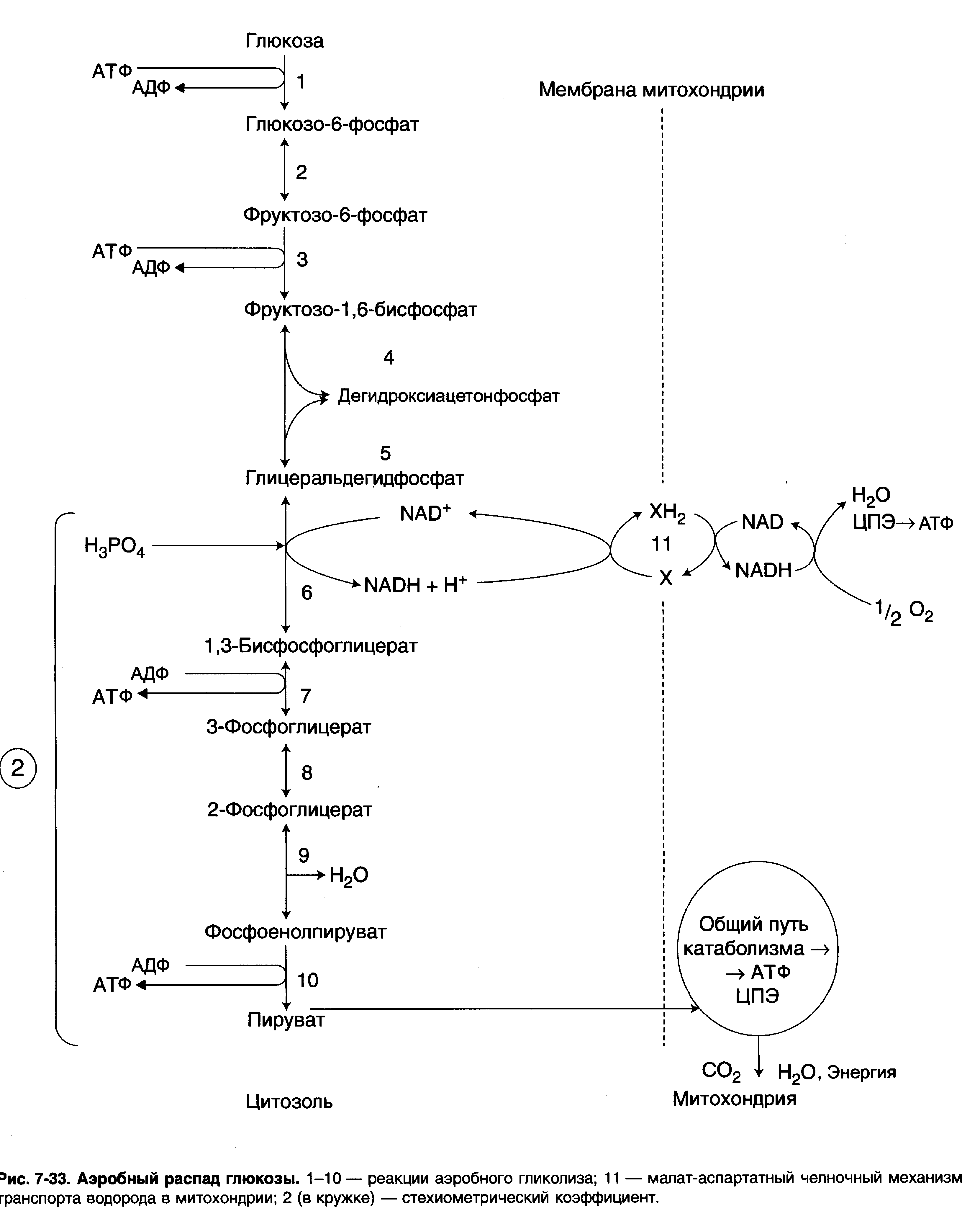
. Взаимоотношение аэробных и анаэробных путей образования энергии
Между обоими процессами — гликолизом и окислительным фосфор ил ирова-нием — существует тесная взаимосвязь несмотря на то, что бнн локализованы в разных участках клетки. На связь дыхания н гликолиза указывают два явления: эффекты Пастера и Кребтри. Эффект Пастера состоит в подавлении дыханием гликолиза, т.е. в присутствии кислорода прекращается брожение углеводов. Механизм пастеровского эффекта (несмотря на открытие егс в 1876 г.) еще неясен. Его объясняют наличием конкуренции между дыханием и гликолизом за неорганический фосфат (Ф„)- и АДФ. Дыхание приводит к снижению Фи и АДФ — необходимых субстратов и активаторов ферментов гликолиза, и повышает содержание АТФ. АТФ как аллостерический эффектор фосфофруктокиназы угнетает ее, что приводит к накоплению глюкозо-6-фос-фата нз фрухтозо-б-фосфата.
Глкжозо-6-фосфат инактивирует гексокиназу, что прекращает усвоение глюкозы в клетках.
Эффект Кребтри, или обратный пастеровский эффект, состоит в торможении дыхания избытком глюкозы. Правда, сначала он был показан для опухолевых клеток, а затем и для некоторых нормальных клеток. Механизм эффекта Кребтри, очевидно, тоже связан с конкуренцией за Ф„ н АДФ. Избыток глюкозы, которая является своего рода «ловушкой» для фосфата, приводит к повышению АДФ в цитоплазме н позволяет глнколнтическим ферментам более эффективно конкурировать за АДФ с дыханием.
В опухолях координация дыхания и гликолиза нарушена. В них оба процесса разобщены: активен и гликолиз, ведущий к образованию лактата, и дыхание.
Активный аэробный гликолиз считался даже характерным именно для опухолей, но впоследствии был обнаружен в йекоторых нормальных тканях (например, в сетчатке глаза).
Обычно же оба процесса, производящих энергию, — гликолиз и дыхание — работают согласованно. Клетки млекопитающих способны производить энергии больше, чем это необходимо для жизнедеятельности. Однако производство энергии не самоцель, поэтому образование АТФ путем гликолиза и окислительного фосфорилирования в клетках организма подчинено простому принципу: спрос диктует предложение. Энергии производится столько, сколько требуется для потребляющих ее процессов. Как только уровень АТФ в митохондриях и цитоплазме достигает определенного значения, дальнейшее его производство в дыхательной цепи и гликолизе прекращается, т. е. продукт (АТФ) регулирует свое образование. Снижение содержания АТФ, сопровождающееся обычно увеличением концентрации АДФ, АМФ н Ф„, активирует гликолиз и окислительное фосфорилирование и уровень АТФ восстанавливается.
Энергетическая ценность аэробного превращення углеводов
Выход энергии при аэробном превращении составляет 38 молекул АТФ на одну молекулу расщепленной глюкозы (рис. 41) в том случае, если нодород НАД * Н2 цитоплазмы доставляется к дыхательной цепи с помощью малат-аспар-татного цикла (или, возможно, лактатного). Если водород НАД • Hj переносится глицеро-фосфатным циклом, то энергии шести молекул АТФ теряется в виде теплоты, и чистый выход энергии составляет 32 молекулы АТФ на 1 молекулу расщепленной глюкозы.
Глихолиз дает две молекулы АТФ, а аэробный распад 38 (или 32) молекул. Это доказывает, насколько ценнее для энергетики клетки аэробный гликолиз. Чтобы произвести столько же энергии анаэробным путем, нужно потратить в 19 (или 16) раз больше глюкозы', чем в присутствии кислорода. Да к тому же образуется метаболический «шлак» — лактат.
Эффективность аэробного распада глюкозы можно рассчитать так. При полном окислении глюкозы до СОэ и Н20 освобождается 2861 кДж/моль. В физиологических условиях для образования-АТФ требуется 45—50 кДж/моль. Следовательно, для образования 38 (32) молей АТФ при аэробном распаде глюкозы требуется 19 000 (16 000) хДж энергии, т.е. энергетическая эффективность аэробного гликолиза составляет
19 000(16 000) - 100% = 65(55)%
Билет 46
Существует еще один путь распада углеводов в тканях, получивший название пентозофосфатного пути (
Пентоэофосфатный цикл представляет собой полнферментную систему, где важным промежуточным продуктом, судя по названию, служат пентозо-фосфаты. Этот цикл является как бы ответвлением, или шунтом, гликолиза на стадии глюкозо-6-фосфата.
Пентоэофосфатный цикл
Для протекания всех стадий пентозофосфатного цикла требуется не менее трех молекул глюкоэо-6-фосфата. Рассмотрим отдельные реакции этого цикла.
1. Дегидрирование глюкозо-б-фосфата — реакция, направляющая глю-коэо-6-фосфат по пентоэофосфатному пути, катализируется глюкоза-6-фосфат-дееидрогеназой по уравнению (для полного описания циклического процесса в уравнениях реакций сразу используем три молекулы глюкозо-б-фосфата)

2. Гидролиз 6-фосфоглюконолактона с образованием 6-фосфоглюконата:

3, Дегидрирование в-фосфоглюконата с образованием рибулозо-5-фосфа-
та. Эта реакция катализируется 6-фосфоелюконат-дегидрогеназой по уравнению 
Особенность реакции.состоит в том, что при дегидрировании образуется нестойкое промежуточное соединение, которое на поверхности этого же фермента декарбоксилируется. Это вторая реакция окисления в пентозофосфатном цикле, приводящая х образованию НАДФ • Н2) поэтому превращение глюкозо-6-фосфата до рибулозо-5-фосфата принято называть окислительной фазой пентозофосфатного цикла. Фаза от рнбулозо-5-фосфата до образования вновь глюкозо-6-фосфата называется неокислительной или анаэробной фазой этого цикла.
4. Взаимопревращение, или изомеризация, пеитозофосфатов. Рибулозо-5-фосфат может обратимо изомеризоваться в другие пентозофосфаты — кси-лулозо-5-фосфат и рабозо-5-фосфат. Катализируют эти реакции два разных фермента — пентозофосфат-эпимераэа и пентозофосфат-изомераза по уравнениям: 
5. Перенос глнколевого альдегида с ксилулозо-5-фосфата на рнбозо-5-фосфат, млн первая транскетолазнаи реакция. В следующей реакции, катали зируемоЙ транскетолазой, используются образовавшиеся в предыдущей реакции пентозофосфаты (в рамку взят переносимый фрагмент):

6.перенос дигидроксиацетонового фрагмента с седогептулозо -7 -фосфата на глицеральдегид -3 -фосфат. Эта обратимая реакция катализируется транс-альдолазой по уравнению 
7- перенос гликолевого альдегида с ксилулозо -5 -фосфата на эрнтрозо -4- фосфат, или вторая транскетолазная реакция. Эта реакция сродни первой транскетолазной реакции и катализируется тем же ферментом. Отличие ее в том, что акцептором гликолевого альдегида служит эрнтрозо-4-фосфат: 
Следовательно, в ходе реакций, катализируемых собственно ферментами пентозофосфатного цикла, из трех молекул глюкозо-6-фосфата образуется дв£ молекулы фруктозо-6-фосфата, одна молекула глицеральдегнд-3-фосфата и три молекулы диоксида углерода. Кроме того, образуется шесть молекул НАДФ • Н2. Суммарное уравнение пентозофосфатного цикла:
3 Г л юкоэо-6-фосфат + 6НАДФ+ -* 2Фруктоэо-6-фосфат + Глицеральдегнд-З-фосфат +
+6НАДФ-Н, + 3CO,
Биологическая функция пентозофосфатного цикла связана с производством двух веществ -— НАДФ • Н2, являющегося «восстановительной силой» при синтезе различных веществ, и метаболита — рибозо-5-фосфата, использующегося как строительный материал в синтезе различных веществ (см; рнс. 52). Перечислим его основные функции:
1) амфиболическая —он яаляется путем распада углеводов и одновременно веществ, используемых в синтетических реакциях (НАДФ • Н3 и рибо-зо-5-фосфат);
2) энергетическая, так как при подключении его продуктов (глицераль-дегид-3-фосфат) к гликолизу образуется энергия;,.
3) синтетическая — основная функция, связанная с использованием НАДФ • На и рибозо-5-фосфата.
НАДФ • Н, используется: 1) в обезвреживании лекарств и ядов в моно-окснгеназной цепи окисления эндоплазматической сети печени;
2) в синтезе Жирных кислот и других структурных и резервных липидов;
3) в синтезе холестерина и его производных — желчных кислот, стероидных гормонов (кортикостероиды, женские н мужские половые гормоны), витаминов D;
4) в обезвреживании аммиака при восстановительном аминировании.
Рибозо -5- фосфат используется в синтезе гистидина, нуклеозидов н нуклеотидов (нуклеотндмоно-, ди- н трифосфатов), нуклеотидных коферментов (НАД, НАДФ, ФАД, КоА) и полимерных производных нуклеотидов — поли-нуклеотидов (ДНК, РНК, коротких олигонуклеотидев).
ПентозофосфатныЙ путь превращения углеводов активен прежде всего в тех органах и тканях, в которых требуется интенсивное использование НАДФ * Н2 в реакциях восстановительных синтезов и рибозо-5-фосфата в синтезе иуклеотидов и нуклеиновых кислот. Поэтому высокая активность этого пути отмечается в жировой ткани, печени, ткани молочной железы, особенно в период лактации (так как необходимо синтезировать жир молока), надпочечниках, половых железах, костном мозге, лимфоидной ткани. Относительно активны дегидрогеназы пентозофосфатного шунта в эритроцитах. Низкая активность его наблюдается в мышечной ткани (сердцеЛскелетная мышца).
Билет47
Синтез глюкозы из неуглеводных источников называется глюконеогеявтл или новообразованием глюкозы. Он возможен не во всех тканях организма. Главным местом глюконеогенез.а является печень. В меньшей степени он про-.текает в почках, слизистой кишечника.
Механизм глюконеогенеза. Поскольку в гликолизе имеются три энергетически необратимые стадии на уровне пнруваткиназы, фосфофруктокиназы и гексокиназы, то образованна глюкозы нэ простых неуглеводных веществ, например пирувата или лактата, путем обратного гликолиза («снизу вверх>) невозможно. Необходимы обходные реакции.
Первый обходный путь при синтезе глюкозы связан е-образова-нием фосфоенолпирувата из пирувата в обход пнруваткиназы. Он катализируется двумя- ферментами. Сначала пируват превращается в оксалоацетат. Реакция происходит в митохондриях, куда проникает Пируват, н катализируется- пируваткарбоксилазой по уравнению

Этот фермент в качестве кофактора, как и все ферменты, усваивающие CO2, содержит биотин. Оксалоацетат поступает из митохондрий в цитоплазму, где протекает глюконеогенез. В цитоплазме оксалоацетат превращается в фосфо-енолпируват в реакции, катализируемой фосфоенолпируват-карбоксилазой: 
Равновесие реакции сдвинуто вправо. Источником фосфатных групп служит главным образом ГТФ, но может быть и АТФ.
От фосфоенолпирувата до фруктозо-1,6-бисфосфата все реакции гликолиза обратимы, поэтому образовавшиеся молекулы фосфоенолпирувата используются для образования фруктозо-1,6-бисфосфата теми же ферментами гликолиза.
Второй обходный путь связан с образованием нз фруктозо-1,6-бисфосфата фруктозо-6-фосфата в обход фосфофрукгокиназной реакции. Реакция катализируется фруктозо-бисфосфатаэой: 
Реакция необратимо сдвинута вправо. Фруктозо-6-фосфат изомеризуется в глюкозо-6- фосфат с помощью глюкозофосфатиэомеразы.
Третий обходный путь связан с образованием из глюкозо-б-фосфата свободной глюкозы в обход гёксокнназной реакции. Эта реакция катализируется глюкозо-6-фосфатаэой:

Свободная глюкоэа, образующаяся в этой реакции, поступает нз ткани в кровь. Общая схема глюконеогенеза нз пирувата представлена на рис. 50. На примере глюконеогенеза можно видеть экономичность организации путей обмена, поскольку помимо четырех специальных ферментов глюконеогенеза: пнруваткарбоксилазы, фосфопнруваткарбокснлазы, фруктозо-бис фосфат азы и глюкозо-6-фосфатазы для новообразования глюкозы используются отдельные ферменты гликолиза.
Взаимоотношение процессов синтеза н распада гликогена. Гликогенснн-тетаэа существует в двух формах, переходящих одна в другую. Фосфорилиро-вочная, или неактивная, форма ее называется гликогенсантетаза D, нефос-форилированная, или активная, форма — гликогенсинтетаза I. Переход из одной формы в другую осуществляется с помощью двух ферментов — киназы гликогенсинтетазы (1) и фосфатаэы гликогенсинтетазы (2) по уравнениям:

Процессы синтеза и 'распада гликогена в клетках регулируются благодаря включению механизмов фосфорилирования ключевых ферментов обмена гликогена — гликогенсинтетазы и гликогёнфосфорнлазы. Активация аденилатци-клаэы (например, под действием адреналина или глюкагона) приводит к образованию цАМФ, запускающего «каскадный» механизм фосфорилирования гликогенсинтетазы н гликогёнфосфорнлазы, что приводит, к образованию неактивной (фосфорилированной) гликогенсинтетазы D и активной (фосфори-лированйой) гликогёнфосфорнлазы А. Эта ситуация благоприятствует распаду гликогена. Напротив, включение механизма дефосфорилировання указанных ферментов с помощью фосфопротендфосфатазы приводит к образованию неактивной гликогёнфосфорнлазы В и активной гликогенсинтетазы I, что способствует синтезу, а не распаду гликогена.
Биологическое значение глюконеогенеза. Необходимость поддержание постоянного уровня глюкозы в крови связана с тем что, для многих тканей глюкоза является основным (нервная ткань), а для некоторых единственным (эритроциты) источником энергии. Потребность в синтезе глюкозы объясняется тем что, гликогенолиз печени может самостоятельно обеспечивать гомеостаз глюкозы в крови только в течение 8-12 часов, далее запас гликогена в течение суток почти полностью истощается. В условиях длительного голодания (больше суток) глюконеогенез является единственным источником глюкозы в организме.
Билет 48
Аэробным гликолизом называют процесс окисления глюкозы до пировиноградной кислоты, протекающий в присутствии кислорода. Все ферменты, катализирующие реакции этого процесса, локализованы в цитозоле клетки.
Этапы аэробного гликолиза
В аэробном гликолизе можно выделить 2 этапа.
- Подготовительный этап, в ходе которого глюкоза фосфорилируется и расщепляется на две молекулы фосфотриоз. Эта серия реакций протекает с использованием 2 молекул АТФ.
- Этап, сопряжённый с синтезом АТФ. В результате этой серии реакций фосфотриозы превращаются в пируват. Энергия, высвобождающаяся на этом этапе, используется для синтеза 10 моль АТФ.
Реакции аэробного гликолиза










