

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...
Топ:
Техника безопасности при работе на пароконвектомате: К обслуживанию пароконвектомата допускаются лица, прошедшие технический минимум по эксплуатации оборудования...
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного...
Выпускная квалификационная работа: Основная часть ВКР, как правило, состоит из двух-трех глав, каждая из которых, в свою очередь...
Интересное:
Инженерная защита территорий, зданий и сооружений от опасных геологических процессов: Изучение оползневых явлений, оценка устойчивости склонов и проектирование противооползневых сооружений — актуальнейшие задачи, стоящие перед отечественными...
Подходы к решению темы фильма: Существует три основных типа исторического фильма, имеющих между собой много общего...
Влияние предпринимательской среды на эффективное функционирование предприятия: Предпринимательская среда – это совокупность внешних и внутренних факторов, оказывающих влияние на функционирование фирмы...
Дисциплины:
|
из
5.00
|
Заказать работу |
Содержание книги
Поиск на нашем сайте
|
|
|
|
Эквивалентная электропроводность λ определяется как электропроводность объема раствора, в котором содержится 1 кг-экв растворенного вещества, помещенного между двумя параллельными электродами на расстоянии 1 м друг от друга с бесконечно большой площадью. Таким образом, между электродами при любой концентрации раствора находится 1 кг-экв растворенного вещества, поэтому изменение эквивалентной электропроводности при изменении концентрации раствора обусловлено изменением степени диссоциации (для слабых электролитов) или межионными взаимодействиями (для сильных электролитов).
Эквивалентная электропроводность определяется по уравнению
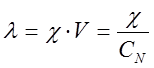 , (2)
, (2)
где V – разведение, т.е. объем, в котором содержится 1 кг-экв растворенного вещества; СN – эквивалентная концентрация (нормальная) раствора.
Размерность эквивалентной электропроводности 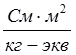 (система СИ) или
(система СИ) или 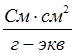 (система СГС). При переходе к системе СГС следует учитывать перевод квадратного метра (м2) на квадратный сантиметр (см2), тогда уравнение (2) примет вид
(система СГС). При переходе к системе СГС следует учитывать перевод квадратного метра (м2) на квадратный сантиметр (см2), тогда уравнение (2) примет вид
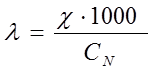 . (3)
. (3)
При разбавлении раствора эквивалентная электропроводность как сильных, так и слабых электролитов возрастает (рис. 2): для слабых электролитов – вследствие увеличения степени диссоциации α, для сильных – в результате повышения абсолютной скорости движения ионов. При бесконечном разбавлении (т.е. при бесконечно малой концентрации) эквивалентная электропроводность асимптотически приближается к предельному значению 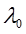 , которое называется предельной эквивалентной электропроводностью раствора при бесконечном разведении
, которое называется предельной эквивалентной электропроводностью раствора при бесконечном разведении 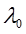 .
.
Предельная эквивалентная электропроводность раствора 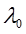 – это электрическая проводимость гипотетически бесконечно разбавленного раствора, характеризующегося полной диссоциацией электролита и отсутствием сил электростатического взаимодействия между ионами. Предельная подвижность ионов зависит только от природы растворителя и температуры; для многих ионов эта величина экспериментально определена и приведена в справочниках [1]. Для слабых электролитов предельное значение
– это электрическая проводимость гипотетически бесконечно разбавленного раствора, характеризующегося полной диссоциацией электролита и отсутствием сил электростатического взаимодействия между ионами. Предельная подвижность ионов зависит только от природы растворителя и температуры; для многих ионов эта величина экспериментально определена и приведена в справочниках [1]. Для слабых электролитов предельное значение 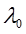 , экспериментально достичь не удается.
, экспериментально достичь не удается.
Молярная электрическая проводимость – это мера электрической проводимости всех ионов, образующихся при диссоциации 1 кмоль электролита заданной концентрации. Она численно равна электропроводности объема раствора, в котором содержится 1 кмоль растворенного вещества, помещенного между двумя параллельными электродами на расстоянии 1 м друг от друга с площадью 1 м2, и определяется по уравнению
|
|
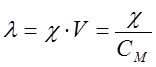 , (4)
, (4)
где V – разведение, т.е. объем, в котором содержится 1 кмоль растворенного вещества; СM – молярная концентрация раствора. Размерность молярной электропроводности 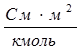 (система СИ) или
(система СИ) или 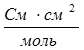 (система СГС).
(система СГС).
Характер зависимости эквивалентной электропроводности от разведения (рис. 2) для сильных и слабых электролитов различен, поскольку влияние разведения (разведение есть обратная величина концентрации) обусловлено различными причинами.
Эквивалентная электрическая проводимость растворов слабых электролитов меньше, чем сильных. Это связано с тем, что даже при низких концентрациях степень диссоциации слабых электролитов мала (α < 1), следовательно, несмотря на то, что в объеме раствора, заключенного между электродами, содержится 1 кг-экв растворенного вещества, ионов – переносчиков электрического тока в этом объеме меньше, чем в растворе сильного электролита. Повышение эквивалентной электрической проводимости слабых электролитов при разбавлении растворов связано именно с увеличением степени диссоциации (рис. 2).
В отличие от слабых электролитов сильные диссоциируют полностью (α = 1), поэтому уменьшение эквивалентной электрической проводимости при переходе от бесконечно разбавленного раствора к растворам конечных концентраций связано только с уменьшением скоростей движения ионов.
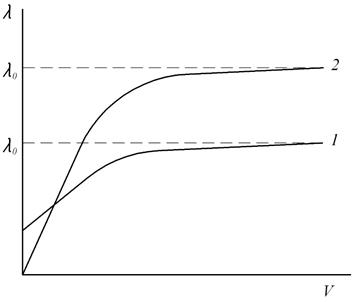
Рис. 2. Зависимость эквивалентной электропроводности от разведения:
1 - сильный электролит; 2 - слабый электролит
Дебаем и Онзагером предложена теория электрической проводимости растворов сильных электролитов. Теория представляет собой развитие основных положений электростатической теории растворов, согласно которой вокруг каждого иона формируется ионная атмосфера и свойства раствора определяются электростатическим взаимодействием центрального иона и его ионной атмосферы.
|
|
При движении иона в электрическом поле наличие ионной атмосферы вызывает появление двух эффектов, тормозящих движение иона в растворе: релаксационного эффекта, обусловленного нарушением симметрии ионной атмосферы вокруг центрального иона, и электрофоретического эффекта, обусловленного движением иона против потока сольватированных ионов противоположного знака. Силы релаксационного и электрофоретического торможения определяются ионной силой раствора, природой растворителя и температурой. Для данного электролита при прочих постоянных условиях эти силы возрастают с увеличением концентрации раствора.
Для эквивалентной электропроводности ионов в растворе электролита 1,1-валентного типа с учетом двух тормозящих эффектов уравнение Дебая –Онзагера будет иметь вид:
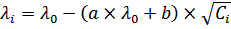 , (5)
, (5)
где
а=0,224 – коэффициент, зависящий от температуры, ионной силы, концентрации, природы электролита, диэлектрической проницаемости;
в= 50,5 – коэффициент, учитывающий помимо перечисленного еще и вязкость среды.
Уравнение Дебая-Онзагера указывает на линейную зависимость эквивалентной электропроводности от корня квадратного из концентрации.
|
|
|

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...

Историки об Елизавете Петровне: Елизавета попала между двумя встречными культурными течениями, воспитывалась среди новых европейских веяний и преданий...

История развития хранилищ для нефти: Первые склады нефти появились в XVII веке. Они представляли собой землянные ямы-амбара глубиной 4…5 м...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!