

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...
Топ:
Техника безопасности при работе на пароконвектомате: К обслуживанию пароконвектомата допускаются лица, прошедшие технический минимум по эксплуатации оборудования...
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов...
Интересное:
Наиболее распространенные виды рака: Раковая опухоль — это самостоятельное новообразование, которое может возникнуть и от повышенного давления...
Уполаживание и террасирование склонов: Если глубина оврага более 5 м необходимо устройство берм. Варианты использования оврагов для градостроительных целей...
Берегоукрепление оползневых склонов: На прибрежных склонах основной причиной развития оползневых процессов является подмыв водами рек естественных склонов...
Дисциплины:
|
из
5.00
|
Заказать работу |
Содержание книги
Поиск на нашем сайте
|
|
|
|
Теория Дебая –Хюккеля исходит из представления о полной диссоциации электролита. Как и в теории Кхоша, в теории Дебая-Хюккеля предполагается, что в растворе электролитов существует правильное чередование положительных и отрицательных ионов. Но если в теории Кхоша предполагалось, что заряды закреплены в какой-то определенной кристаллической решетке, то в теории Дебая-Хюккеля такое предположение не делается. Предполагается, что правильное чередование положительных и отрицательных ионов является следствием статистического распределения. Это распределение происходит в результате свободного кинетического движения ионов и наличия у них зарядов.
Вокруг каждого положительного иона в растворе могут находится любые ионы и положительные, и отрицательные. Но вероятность нахождения отрицательных ионов будет больше. Аналогичное рассуждение применимо и к отрицательному иону. Отсюда Дебай и Хюккель пришли к представлению о так называемой ионной атмосфере. Они предположили, что вокруг каждого центрального иона образуется ионное облако, состоящее из положительных и отрицательных зарядов с избытком положительных (или отрицательных) зарядов с тем, однако, условием, что весь раствор остается электронейтральным.
Рассмотрим положительный ион в качестве центрального (рис. 6).
Вокруг этого иона могут находиться и положительные, и отрицательные ионы при этом может быть любое распределение положительных и отрицательных ионов. В отдельный момент может быть избыток положительных ионов. Но если проследить за этой системой некоторый промежуток времени, то окажется, что в среднем имеется некоторый избыток отрицательных зарядов над положительными. Этот избыток равен заряду центрального иона. При этом отрицательный заряд распределен по всей оболочке, окружающей ион. Можно сказать, что ион окружен отрицательно заряженной атмосферой. (Те же самые рассуждения применимы и к отрицательно заряженному центральному иону).
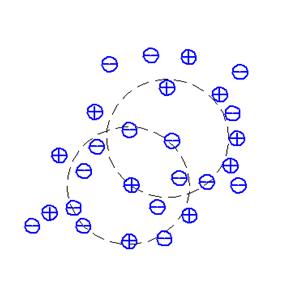
Рис.6. Модель ионной атмосферы, принятая теорией Дебая-Хюккеля
Плотность ионной атмосферы различна. Наибольший избыток отрицательных зарядов находится вблизи центрального иона. По мере удаления от него плотность избыточного заряда становится все меньше, и на некотором расстоянии от иона количество положительных и отрицательных зарядов становится одинаковым. На этом и заканчивается ионная атмосфера. Следовательно, ионная атмосфера имеет некоторые конечные размеры: она характеризуется некоторой длиной и плотностью. Чем разбавленнее раствор, тем ионная атмосфера имеет меньшую плотность, занимает больший объем и имеет большую длину. И наоборот. С повышением температуры плотность ионной атмосферы уменьшается за счет увеличения кинетической энергии ионов. Электростатическое взаимодействие между ионами в жидкой среде сильно зависит от диэлектрической проницаемости. Дебай и Хюккель приняли, что диэлектрическая проницаемость растворителя вблизи иона равна диэлектрической проницаемости самого раствора. Тем самым они не учитывали зависимость диэлектрической проницаемости от дипольного момента растворителя, от ассоциации молекул и структуры жидкости. Следует отметить, что теория не учитывает явление сольватации ионов и изменение сольватации ионов с концентрацией электролита. Кроме того, теория пренебрегает индивидуальными свойствами ионов, их строением и т.д.
Таким образом, при выводе основного уравнения теории Дебая-Хюккеля учитываются следующие допущения (положения):
- электролит в растворе полностью диссоциирован и концентрация ионов рассчитывается по аналитической концентрации электролита;
- между ионами существует только электростатическое и кинетическое взаимодействие;
- растворитель представляет собой непрерывную среду, диэлектрическая проницаемость ε которой одинакова в любой точке раствора, т.е. диэлектрическая проницаемость раствора равна диэлектрической проницаемости растворителя;
- распределение ионов в растворе описывается моделью ионной атмосферы, все отклонения раствора от идеальности обусловлены взаимодействием ионов с ионной атмосферой;
- распределение заряда вокруг центрального иона описывается уравнением Пуассона;
- распределение ионов в растворе описывается распределением Больцмана.
Если принять, что ионы представляют собой заряженные материальные точки, то в рамках первого приближения теории Дебая-Хюккеля получают следующее выражение для расчета среднего ионного коэффициента активности:
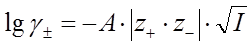 , (39)
, (39)
где z+ и z- заряды катиона и аниона; I – ионная сила раствора; A – константа, зависящая от плотности ρ; диэлектрической проницаемости ε растворителя и температуры Т. 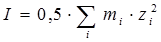 , где mi – моляльная концентрация. Однако с увеличением заряда ионов их размеры в значительной мере отличаются от материальной точки, что приводит к погрешности при расчетах по уравнению Дебая-Хюккеля.
, где mi – моляльная концентрация. Однако с увеличением заряда ионов их размеры в значительной мере отличаются от материальной точки, что приводит к погрешности при расчетах по уравнению Дебая-Хюккеля.
Первое приближение теории Дебая-Хюккеля справедливо до ионной силы менее 0,01  . При таких концентрациях логарифм среднего коэффициента активности линейно зависит от
. При таких концентрациях логарифм среднего коэффициента активности линейно зависит от 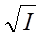 .
.
Учет конечного собственного размера ионов позволяет получить уравнение второго приближения теории Дебая-Хюккеля:
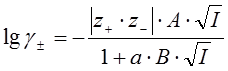 , (40)
, (40)
где параметр а связан с эффективным диаметром ионов в растворе, а
В ~ (kT)–1/2.
Второе приближение позволяет расширить область применения уравнения Дебая-Хюккеля до ионной силы 0,1 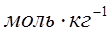 . Если ионная сила раствора не превосходит 0,1
. Если ионная сила раствора не превосходит 0,1 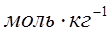 , то коэффициенты активности отдельных ионов одинакового заряда приблизительно одинаковы (табл. 1).
, то коэффициенты активности отдельных ионов одинакового заряда приблизительно одинаковы (табл. 1).
Таблица 1
Зависимость коэффициентов активности ионов от ионной силы раствора
| Ионы | Коэффициенты активности ионов при ионной силе I | |||||
| 0,001 | 0,005 | 0,01 | 0,02 | 0,05 | 0,10 | |
| Однозарядные | 0,98 | 0,95 | 0,92 | 0,89 | 0,85 | 0,80 |
| Двухзарядные | 0,77 | 0,65 | 0,58 | 0,50 | 0,40 | 0,30 |
| Трехзарядные | 0,73 | 0,55 | 0,47 | 0,37 | 0,28 | 0,21 |
Для описания дальнейшего роста коэффициентов активности с увеличением концентрации раствора вводят дополнительные слагаемые, не имеющие однозначной физической интерпретации. Так, в рамках третьего приближения теории Дебая-Хюккеля:
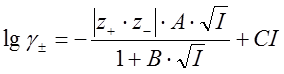 . (41)
. (41)
При соответствующем подборе параметров B и C это уравнение позволяет описать экспериментальные величины коэффициентов активности при ионной силе порядка 1 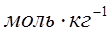 .
.
|
|
|

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...

Автоматическое растормаживание колес: Тормозные устройства колес предназначены для уменьшения длины пробега и улучшения маневрирования ВС при...
© cyberpedia.su 2017-2025 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!