

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...
Топ:
Комплексной системы оценки состояния охраны труда на производственном объекте (КСОТ-П): Цели и задачи Комплексной системы оценки состояния охраны труда и определению факторов рисков по охране труда...
Марксистская теория происхождения государства: По мнению Маркса и Энгельса, в основе развития общества, происходящих в нем изменений лежит...
Когда производится ограждение поезда, остановившегося на перегоне: Во всех случаях немедленно должно быть ограждено место препятствия для движения поездов на смежном пути двухпутного...
Интересное:
Искусственное повышение поверхности территории: Варианты искусственного повышения поверхности территории необходимо выбирать на основе анализа следующих характеристик защищаемой территории...
Национальное богатство страны и его составляющие: для оценки элементов национального богатства используются...
Уполаживание и террасирование склонов: Если глубина оврага более 5 м необходимо устройство берм. Варианты использования оврагов для градостроительных целей...
Дисциплины:
|
из
5.00
|
Заказать работу |
Содержание книги
Поиск на нашем сайте
|
|
|
|
ЭЛЕКТРОХИМИЯ
Электрохимия – это раздел физической химии, в котором изучаются законы взаимного превращения химической и электрохимической форм энергии и системы, где эти превращения осуществляются.
В зависимости от природы токопроводящих частиц и от их электропроводности все вещества можно условно разделить на пять основных групп:
- непроводящие тела или изоляторы – вещества, в которых даже при больших электрических полях не наблюдается прохождения тока;
- проводники I рода или электропроводящие тела – вещества, электрическая проводимость которых обусловлена электронами. К ним относятся металлы, их некоторые оксиды, углеродистые материалы. Удельное сопротивление лежит в пределах 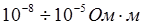 ;
;
- полупроводники – вещества, ток в которых переносится электронами и дырками. По электропроводности они располагаются между изоляторами и металлами. Удельное сопротивление полупроводников изменяется в широких пределах от 10-7 до 103 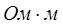 ;
;
- проводники II рода – вещества, обладающие ионной проводимостью (твердые соли 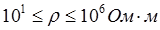 , ионные расплавы
, ионные расплавы 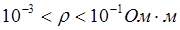 , растворы электролитов
, растворы электролитов 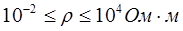 );
);
- смешанные проводники – вещества, сочетающие электронную и ионную проводимости.
В электрохимии рассматривают проводники второго рода.
ЭЛЕКТРИЧЕСКАЯ ПРОВОДИМОСТЬ РАСТВОРОВ ЭЛЕКТРОЛИТОВ
Движение ионов в электрическом поле
Согласно теории Аррениуса, молекулы электролитов в водном растворе диссоциируют на электрически заряженные частицы – ионы, которые и являются переносчиками электричества. Не все электролиты диссоциируют в одинаковой степени: одни – сильные электролиты – диссоциируют в растворе полностью; другие – слабые электролиты – диссоциируют частично. Электропроводность слабых электролитов определяется степенью диссоциации α, которая зависит от концентрации электролита и температуры. В растворе слабого электролита между недиссоциированными молекулами и ионами устанавливается равновесие:
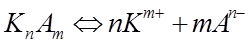 .
.
Независимо от степени диссоциации электролита соблюдается электронейтральность раствора, т.е. числа положительных и отрицательных зарядов в растворе равны.
Ионы в растворе электролита находятся в непрерывном беспорядочном движении. При наложении внешнего электрического поля на хаотичное тепловое движение ионов накладывается ориентированное поступательное движение к поверхности электродов. На скорость передвижения катионов и анионов в преимущественном направлении влияет ряд факторов:
а) размер иона: чем меньше ион, тем он более подвижен. При этом следует помнить, что ионы в водном растворе гидратированы, а значит, речь идет о размерах гидратированного иона;
б) заряд иона: скорость движения иона тем больше, чем выше его заряд;
в) напряженность внешнего электрического поля (отношение разности потенциалов между электродами к расстоянию между ними); чтобы исключить влияние этого фактора, принято сравнивать абсолютные скорости движения ионов: абсолютной скоростью иона назы вают скорость его передвижения в поле с напряженн стью 1 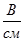 ;
;
г) концентрация электролита: с уменьшением концентрации электролита в растворе абсолютные скорости ионов растут, так как увеличивается расстояние между ними и уменьшаются силы электростатического взаимодействия. При бесконечном разбавлении С→0 абсолютные скорости ионов достигают максимального значения;
д) температура: абсолютная скорость движения любого иона тем больше, чем меньше вязкость растворителя η. С увеличением температуры вязкость растворителя уменьшается, а абсолютная скорость движения ионов растет;
е) аномально высокими значениями абсолютных скоростей в водных растворах обладают ионы Н3О+ и ОН-, что принято объяснять особым механизмом движения этих ионов в водных растворах – эстафетным.
Между ионами гидроксония Н3О+ и молекулами воды Н2О, а также гидроксидионами ОН- и Н2О происходит обмен ионами Н+. Эти процессы протекают с огромной скоростью – средняя продолжительность существования иона Н3О+ составляет около 10-11 с. В отсутствие внешнего поля такой обмен протекает в любых направлениях; под действием электрического поля передача ионов Н+ происходит направленно.
Величина, характеризующая способность веществ проводить электрический ток под действием внешнего электрического поля, называется электрической проводимостью (электропроводностью) .
Для оценки проводимости растворов и влияния на нее различных факторов на практике используют величины удельной электропроводности χ, эквивалентной электропроводности λ и молярной электропроводности μ.
|
|
|

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...

История развития хранилищ для нефти: Первые склады нефти появились в XVII веке. Они представляли собой землянные ямы-амбара глубиной 4…5 м...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...
© cyberpedia.su 2017-2026 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!