ФГОУВПО «Майкопский Государственный Технологический Университет»
Медицинский институт
Малова И.Ю.
ОБЩЕЕ УЧЕНИЕ
О ДИСТРОФИЯХ
(Учебное пособие)
Майкоп-2013
УДК 616 – 007.17 (07)
ББК 54.15
М - 19
ОБЩЕЕ УЧЕНИЕ О ДИСТРОФИЯХ.
Дистрофия – это патологический процесс, который является следствием нарушения обменных процессов, при этом происходит повреждение структур клетки и появление в клетках и тканях организма веществ, которые в норме не определяются.
Классификация дистрофий.
1. В зависимости от преобладания морфологических изменений в специализированных клетках или строме и сосудах:
А) клеточные (паренхиматозные);
Б) стромально-сосудистые (мезенхимальные);
В) смешанные (наблюдаются в паренхиме и в соединительной ткани).
2. В зависимости от вида нарушенного обмена:
А) белковые (диспротеинозы);
Б) жировые (липидозы);
В) углеводные;
Г) минеральные.
3. По масштабу распространенности процесса:
А) местные (локализованные);
Б) Общие (генерализованные).
4. В зависимости от происхождения:
А) приобретенные;
Б) наследственные.
Морфогенетические механизмы дистрофий.
1. Трансформация - это способность одних веществ преобразовываться в другие, имеющие сходное строение и состав. Например, данной способностью обладают углеводы, трансформируясь в жиры.
2. Инфильтрация – это способность клеток или тканей наполняться избыточным количеством разнообразных веществ. Существует два типа инфильтрации. Для инфильтрации первого типа характерно, что клетка, которая участвует в нормальной жизнедеятельности, получает избыточное количество какого либо вещества. Через некоторое время наступает предел, когда клетка не может переработать, ассимилировать этот избыток. Для инфильтрации второго типа характерно понижение уровня жизнедеятельности клетки, в результате они не справляется даже с нормальным количеством вещества, поступающего в нее.
3. Декомпозиция – характеризуется распадом внутриклеточных и внутритканевых структур. Происходит распад белково-липидных комплексов, которые входят в состав мембран органелл. В мембране белки и липиды находятся в связанном состоянии, и поэтому они не видны. Но при распаде мембран они образуются в клетках и становятся заметными под микроскопом.
4. Извращенный синтез – происходит образование в клетке аномальных чужеродных веществ, которые при нормальном функционировании организма не образуются. Например, при амилоидной дистрофии в клетках происходит синтез аномального белка, из которого затем образуется амилоид.
У больных хроническим алкоголизмом в клетках печени (гепатоцитах) начинает происходить синтез чужеродных белков, из которых в дальнейшем формируется так называемый алкогольный гиалин.
Для различных видов дистрофий характерно свое нарушение функции ткани. При дистрофии расстройство бывает двояким: количественным, со снижением функции, и качественным, с извращением функции, т.е. появляются черты, несвойственные нормальной клетке.
Примером такой извращенной функции является появление в моче белка при заболеваниях почек, когда имеются дистрофические изменения почки, или изменения печеночных проб, появляющиеся при заболеваниях печени, а при заболеваниях сердца – изменение сердечных тонов.
ПАРЕНХИМАТОЗНЫЕ ДИСТРОФИИ
Паренхиматозные дистрофии делятся на белковые, жировые и углеводные.
БЕЛКОВЫЕ ДИСТРОФИИ
Белковая дистрофия - это дистрофия, при которой нарушается белковый обмен. Процесс дистрофии развивается внутри клетки. Среди белковых паренхиматозных дистрофий выделяют зернистую, гиалиново-капельную, гидропическую и роговую дистрофии.
2.1.1. При зернистой дистрофии во время гистологического исследования в цитоплазме клеток можно увидеть белковые зерна. Зернистая дистрофия поражает паренхиматозные органы: почки, печень и сердце. Это дистрофия получила название мутное или тусклое набухание. Это имеет связь с макроскопическими особенностями. Органы при данной дистрофии становятся слегка набухшими, а поверхность при разрезе смотрится тусклой, мутной, как бы «ошпаренная кипятком».
Способствует развитию зернистой дистрофии несколько причин, которые можно разделить на две группы: инфекции и интоксикации.
Почка, пораженная зернистой дистрофией, увеличивается в размерах, становится дряблой, может быть определена положительная проба Шорра (при приведении друг к другу полюсов ткань почки рвется). На разрезе ткань тусклая, границы мозгового и коркового вещества смазаны или вообще могут быть не различимы. При этом виде дистрофии поражается эпителий извитых канальцев почки. В нормальных канальцах могут наблюдаться ровные просветы, а при зернистой дистрофии апикальный отдел цитоплазмы подвергается разрушению и становится звездчатой формы. В цитоплазме эпителия почечных канальцев находятся многочисленные зерна (розового цвета).
Почечная зернистая дистрофия заканчивается двумя вариантами. Благоприятный исход возможен при устранении причины, эпителий канальцев в данном случае возвращается к норме. Неблагоприятный исход наступает при продолжающемся воздействии патологического фактора – процесс становится необратимым, дистрофия преобразуется в некроз (часто наблюдается при отравлении почечными ядами).
Печень при зернистой дистрофии также немного увеличена. На разрезе ткань приобретает цвет глины. Гистологический признак зернистой дистрофии печени – непостоянное наличие белковых зерен. Необходимо обращать внимание – имеется или разрушена балочная структура. При этой дистрофии белки разделяются на отдельно располагающиеся группы или отдельно лежащие гепатоциты, что получило название дискомплексация печеночных балок.
Сердечная зернистая дистрофия: сердце внешне также слегка увеличено, миокард становится дряблым, на разрезе напоминает вареное мясо. При гистологическим исследовании критерием данной дистрофии является базофилия. Волокна миокарда различно воспринимают гематоксилин и эозин. Одни участки волокон интенсивно окрашиваются гематоксилином в сиреневый, а другие интенсивно красятся эозином в синий.
2.1.2. Гиалиново-капельная дистрофия развивается в почках (поражается эпителий извитых канальцев) и печени (гепатоцитах). Макроскопически органы не изменяются. Микроскопически в цитоплазме клетки появляются крупные гиалиноподобные капли белка. Гиалиново-капельная дистрофия приводит к фокальному коагуляционному некрозу и смерти клетки.
Гиалиново-капельная дистрофия в почках (рис. 1) развивается при нефротическом синдроме (сочетание массивной протеинурии с отеками, гипо- и диспротеинемией, гиперлипопротеидемией), осложняющем различные заболевания почек: мембранозную нефропатию, гломерулонефрит, амилоидоз и др. Гиалиново-капельная дистрофия нефроцитов связана с механизмами инфильтрации (в условиях повышенной порозности гломерулярного фильтра) и последующей декомпозицией – поломом вакуолярно-лизосомального аппарата нефроцита, обеспечивающего реабсорбцию белка.

Рис. 1. Белковые гиалиновые капли в эпителии проксимальных извитых канальцев почки.
В цитоплазме клеток эпителия извитых канальцев видны крупные гиалиноподобные капли, окрашенные эозином в розовый цвет (1). Эпителиальные клетки увеличены в объеме, границы нечеткие; просветы канальцев сужены, в них встречаются белковые преципитаты
Гиалиново-капельная дистрофия печени возникает в гепатоцитах при остром алкогольном гепатите (реже при первичном билиарном циррозе, холестазе и некоторых других заболеваниях печени). Гиалиноподобные включения (при исследовании в световом микроскопе напоминают гиалиново-капельную дистрофию, в электронном микроскопе представлены фибриллярным белком), носят название алкогольного гиалина, или телец Мэллори. Эти тельца располагаются обычно перинуклеарно в виде ацидофильных глыбок или сетчатых масс. Основной механизм данной дистрофии- это извращенный синтез. Алкогольный гиалин определяет ряд реакций как в печени, так и за ее пределами, что обусловлено рядом его свойств. Он обладает хемотаксическими свойствами и определяет прежде всего лейкотаксис. Поэтому он окружен, как правило, полиморфно-ядерными лейкоцитами (характерный признак острого алкогольного гепатита).
Алкогольный гиалин оказывает цитолитическое действие на гепатоциты, с чем связано развитие в печени своеобразного «склерозирующего гиалинового некроза», и коллагеностимулирующее действие, определяя хроническое прогрессирующее течение алкогольного гепатита и развитие цирроза печени.
2.1.3. При гидропической дистрофии дистрофии макроскопически органы не изменяются. Микроскопически в цитоплазме клетки появляются вакуоли. Гидропическая дистрофия может завершиться развитием баллонной дистрофии (фокальный колликвационный некроз) и смертью клетки (тотальный колликвационный некроз). Гидропическая дистрофия встречается в основном в печени и почках, иногда в эпидермисе. Гидропическая дистрофия в почках (рис. 2) 
Рис. 2. Гидропическая дистрофия эпителия проксимальных извитых канальцев почки.
Набухание и вакуолизация цитоплазмы клеток эпителия проксимальных извитых канальцев (1). Ядра смещены к базальной мембране клеток, бледно окрашены. Просветы канальцев сужены, отмечается слущивание эпителия.
развивается также при нефротическом синдроме. Гидропическая дистрофия эпителия канальцев почек при нефротическом синдроме возникает при повреждении различных мембранно-ферментных систем, ответственных за реабсорбцию белка и воды.
Гидропическая дистрофия нефроцитов связана с механизмами инфильтрации и декомпозиции системы реабсорции – базального лабиринта, работающего на натрий-калий -зависимых АТФ-азах и обеспечивающего реабсорбцию натрия и воды.
Гидропическая дистрофия печени (рис. 3) возникает при вирусных гепатитах В и С и отражает извращение белково-синтетической функции гепатоцита вследствие репродукции вируса.
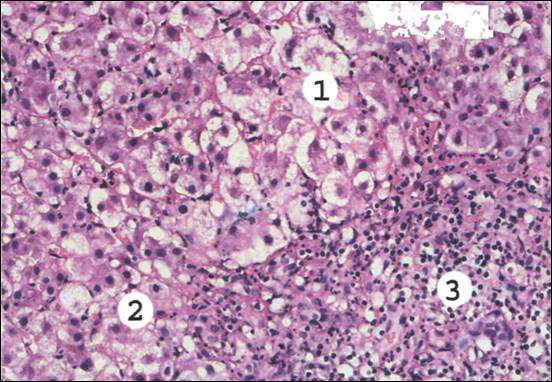
Рис. 3. Острый вирусный гепатит.
Дискомплексация печеночных балок, гепатоциты в состоянии гидропической и баллонной дистрофии (7), местами виден колликваиионный некроз гепатоцитов. Встречаются тельца Каунсильмена (уменьшенные в размерах гепатоциты с эозинофильной цитоплазмой и пикнотичным. ядром) (2). В портальных трактах и дольках небольшой лимфогистиоцитарный инфильтрат
При этом в гепатоцитах образуются крупные светлые капли, часто заполняющие всю клетку (баллонная дистрофия). При оценке гидропической дистрофии гепатоцитов следует руководствоваться морфологическим анализом особенностей функционирования печеночных клеток, обеспечивающих специализированные функции органа.
Известно, что для выполнения белковосинтетической и антитоксической функции гепатоциты детерминированы структурно; темные гепатоциты периферии долек богаты ультраструктурами синтеза, светлые гепатоциты центров долек – ультраструктурами детоксикации и гидролиза.
При воздействии на печень вируса гепатита В избирательно реагируют темные, а токсических веществ – светлые гепатоциты. При этом дистрофия их отражает разные по своей сути процессы: гидропическая дистрофия темных гепатоцитов – извращенную белковосинтетическую функцию, подчиненную репродукции вируса, та же гидропическая дистрофия светлых гепатоцитов – недостаточность системы детоксикации.
Гидропическая дистрофия в эпидермисе может обнаружиться при ожогах и натуральной оспе.
2.1.4. Роговая дистрофия, или патологическое ороговение, характеризуется избыточным образованием рогового вещества в ороговевающем эпителии (рис. 4) (гиперкератоз, ихтиоз) или образованием рогового вещества там, где в норме его не бывает (патологическое ороговение на слизистых оболочках, или лейкоплакия;образование «раковых жемчужин» в плоскоклеточном раке (рис. 5). Процесс может быть местным или распространенным. Причиныроговой дистрофии разнообразны: нарушение развития кожи, хроническое воспаление, вирусные инфекции, авитаминозы и др.
Исход может быть двояким: устранение вызывающей причины в начале процесса может привести к восстановлению ткани, однако в далеко зашедших случаях наступает гибель клеток.
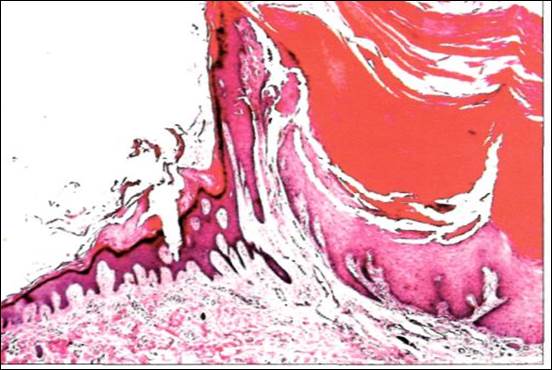
Рис. 4. Кожный рог. Гиперкератоз.
Кожный рог.-это палочковидное образование длиной до 2-3см. Чаще возникает на лице или волосистой части головы
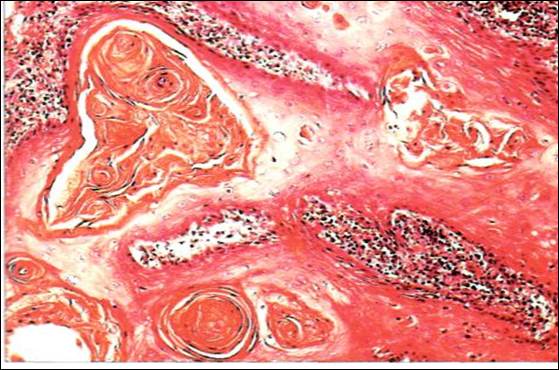
Рис. 5. Плоскоклеточный рак. Раковые жемчужины
Значение роговой дистрофии определяется ее степенью, распространенностью и длительностью. Длительно существующее патологическое ороговение слизистой оболочки" (лейкоплакия) может явиться источником развития раковой опухоли.
Роговые дистрофии подразделяются на наследственные и приобретенные, общие и местные.
К наследственной общей роговой дистрофии относится ихтиоз, который наиболее часто встречается среди группы болезней, протекающих нарушением процессов кератинизации.
Ихтиоз обычный - наиболее часто встречающаяся форма заболевания (рис. 6), наследуется по аутосомно-доминантному типу.
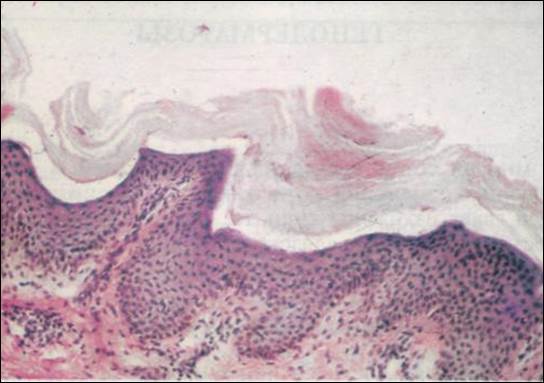
Рис. 6. Ихтиоз обычный.
ЖИРОВАЯ ДИСТРОФИЯ.
Существует два вида жиров. Количество подвижных (лабильных) жиров меняется на протяжении всей жизни человека. Они локализуются в жировых депо. Стабильные (неподвижные) жиры включены в состав клеточных структур и мембран.
Жиры определяются при помощи специальных красителей:
1) Судан – III обладает способностью окрашивать жир в оранжево- красный цвет;
2) Шарлах окрашивает в красный цвет;
3) Судан – IV (осмиевая кислота) окрашивает жир в черный цвет;
4) Нильская голубая имеет метахромазию: она окрашивает нейтральные жиры в красный, а все остальные жиры под ее воздействием приобретают синий или голубой цвет.
Причины жировой дистрофии можно разделить на две основные группы: инфекции и интоксикации. В наше время основным видом хронической интоксикации является алкогольная интоксикация. Нередко могут наблюдаться медикаментозные интоксикации, эндокринные интоксикации – развивающиеся при сахарном диабете.
Паренхиматозная жировая дистрофия наиболее часто встречается в печени, миокарде и почках.
О жировой дистрофии печени, которая по сравнению другими липидозами паренхиматозных органов встречается особенно часто, говорят в тех случаях, когда жир, преимущественно нейтральный, содержит более 50 % гепатоцитов. Выделяют три стадии жировой печени: "чистая" жировая печень, жировая печень с мезенхимальной реакцией, фиброз и цирроз печени.
Непосредственной причиной накопления нейтральных жиров в печени является дезорганизация ферментативных процессов на том или ином этапе обмена липидов, которая проявляется в следующих ситуациях:
1) при чрезмерном поступлении в клетку жирных кислот или повышенном их синтезе в гепатоците, что создает относительный дефицит ферментов;
2) при воздействии на клетку токсичных веществ, блокирующих окисление жирных кислот, синтез апопротеинов;
3) при недостаточном поступлении в гепатоциты аминокислот, необходимых для синтеза фосфолипидов и липопротеидов.
Из сказанного следует, что жировая дистрофия печени может развиваться в следующих случаях:
1) при состояниях, для которых характерен высокий уровень жирных кислот в плазме крови — алкоголизм, сахарный диабет, общее ожирение и др.;
2) при воздействии на гепатоциты токсичных веществ — этанола, четыреххлористого углерода, фосфора и др.;
3) при нарушении питания вследствие недостатка белка в пище (алипотропное ожирение печени) или заболеваний желудочно-кишечного тракта;
4) при генетических дефектах ферментов, участвующих в жировом обмене — наследственные липидозы.
Более подробного рассмотрения заслуживает жировая дистрофия печени при алкоголизме, сахарном диабете и интоксикациях.
Алкоголизм. Установлено, что среди других причин развития жировой печени этанолу отводится от 30 до 50 %. Этанол усиливает мобилизацию жира из депо, увеличивает синтез жирных кислот в гепатоцитах, усиливает этерификацию жирных кислот до триглицеридов, снижает уровень окисления жирных кислот, уменьшает синтез и освобождение липопротеидов, а также проницаемость клеточной мембраны гепатоцита в связи с усилением синтеза и накоплением холестерина.
Отложения жира в алкогольной печени могут быть очаговыми и диффузными. В случае диффузного ожирения алкогольная печень увеличена в размерах, дряблая, охряно-желтая.
При гистологическом исследовании в зависимости от размеров жировых капель различают мелкокапельную, среднекапелъную и крупнокапельную дистрофию гепатоцитов (рис. 8А и 8Б).При крупнокапельной жировой дистрофии — крайнем выражении дистрофии — ядро гепатоцита оттесняется к наружной мембране клетки/Ободок цитоплазмы, свободной от жировых включений, остается структурно и функционально сохранным: при электронной микроскопии органеллы его изменены мало, в нем высоки содержание гликогена, РНК и активность ферментов гликолиза, пентозного шунта, дезаминирования; достаточна и активность сукцинатдегидрогеназы.
Видимо, возможный исход алкогольной жировой печени (алкогольного стеатоза печени) объясняется тем, прекратит ли больной употребление алкоголя или будет продолжать злоупотреблять им. На основании результатов исследования повторных биоптатов печени у больных алкоголизмом показано, что при полной абстиненции жир исчезает из печени через 2—4 нед, а прогрессирование алкогольного стеатоза ведет к формированию цирроза печени, при этом большое значение имеют повторные атаки острого алкогольного гепатита.
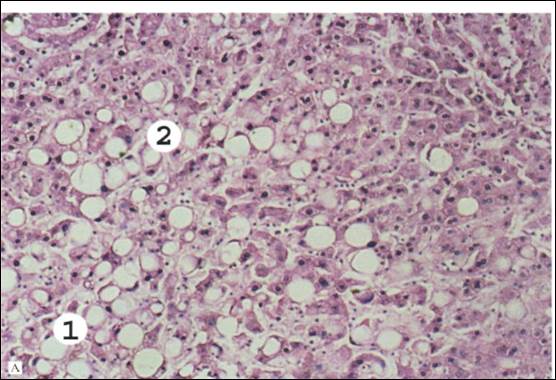
Рис. 8А. Жировая дистрофия печени.
Более крупные капли жира видны в периферических отделах долек (1), более мелкие — в центре долек (2). В периферических отделах долек встречаются гепатоциты, цитоплазма которых заполнена жиром, ядро смешено к клеточной оболочке ("перстневидные клетки").
Сахарный диабет. Жировая дистрофия печени у больных сахарным диабетом встречается в 50—75 % случаев, причем выраженность стеатоза коррелирует с возрастом (при юношеской форме сахарного диабета жировая печень встречается редко), массой тела больных и тяжестью кетоацидоза.
Развитие стеатоза печени при сахарном диабете обусловлено усиленными мобилизацией жира из жировых депо, транспортом их в печень, нарушением синтеза фосфолипидов и окисления жирных кислот. Усиленный липолиз обусловлен недостатком инсулина, который является антилиполитическим гормоном, — липолитические гормоны "берут верх" над антилиполитическими.
Авторадиография подтверждает сохранение синтетических процессов в ожиревших гепатоцитах.
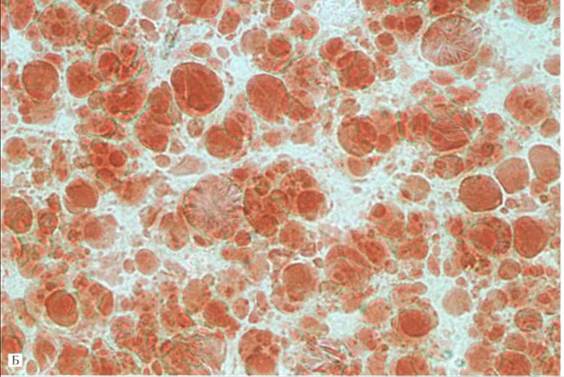
Рис. 8Б. Жировая дистрофия печени.
УГЛЕВОДНЫЕ ДИСТРОФИИ.
Углеводы, которые определяются в клетках и тканях и могут быть идентифицированы гистохимически, делят на полисахариды, из которых в животных тканях выявляются лишь гликоген, гликозаминогликаны (мукополисахариды) и гликопротеиды.
Среди гликозаминогликанов различают нейтральные, прочно связанные с белками, и кислые, к которым относятся гиалуроновая, хондроитинсерная кислоты и гепарин. Кислые гликозаминогликаны как биополимеры способны вступать в непрочные соединения с рядом метаболитов и осуществлять их транспорт. Главными представителями гликопротеидов являются муцины.
2.3.1. Наследственные углеводные дистрофии, в основе которых лежат нарушения обмена гликогена, называются гликогенозами. Гликогенозы обусловлены отсутствием или недостаточностью фермента, участвующего в расщеплении депонированного гликогена, и относятся поэтому к наследственным ферментопатиям, или болезням накопления.
В настоящее время хорошо изучены 6 типов гликогенозов, обусловленных наследственной недостаточностью 6 различных ферментов. Это болезни Гирке (I тип), Помпе (II тип), Мак-Ардля (V тип) и Герса (VI тип), при которых структура накапливаемого в тканях гликогена не нарушена, и болезни Форбса—Кори (III тип) и Андерсена (IV тип), при которых она резко изменена.
Морфологическая диагностика гликогеноза того или иного типа возможна при биопсии с помощью гистоферментативных методов.
2.3.2. Углеводные дистрофии, связанные с нарушением обмена гликопротеидов. При нарушении обмена гликопротеидов в клетках или в межклеточном веществе происходит накопление муцинов и мукоидов, называемых также слизистыми или слизеподобными веществами. В связи с этим при нарушении обмена гликопротеидов говорят о слизистой дистрофии.
Микроскопическое исследование. Оно позволяет выявить не только усиленное слизеобразование, но и изменения физико-химических свойств слизи. Многие секретирующие клетки погибают и десквамируются, выводные протоки желез обтурируются слизью, что ведет к развитию кист. Нередко в этих случаях присоединяется воспаление. Слизь может закрывать просветы бронхов (рис. 10), следствием чего является возникновение ателектазов и очагов пневмонии.
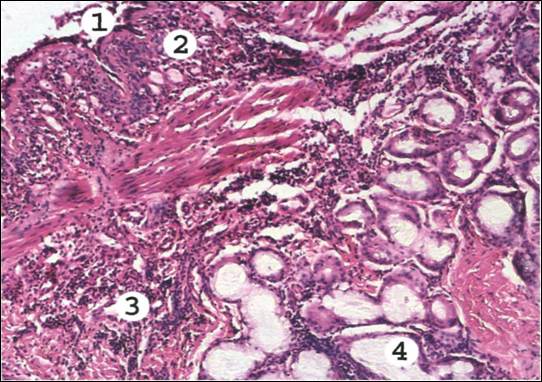
Рис. 10. Биоптат бронха при бронхиальной астме.
В просвете бронха слоистый слизистый секрет с примесью эозинофилов и десквамированного эпителия (1). Слизистая оболочка инфильтрирована эозинофилами, базофилами, лимфоидными и плазматическими клетками (2). Базальная мембрана эпителия утолщена, набухшая. Сосуды микроциркуляторного русла резко полнокровны, их проницаемость повышена, отмечается серозный периваскулярный отек слизистой оболочки и подслизистого слоя (3). Слизистые железы стенки бронха в состоянии гиперсекреции, их протоки расширены, заполнены слизью (4). Мышечная оболочка гипертрофирована.
Причиныслизистой дистрофии разнообразны, но чаще всего это воспаление слизистых оболочек в результате действия различных патогенных раздражителей.
Муцины составляют основу слизи, продуцируемой эпителием слизистых оболочек и железами, мукоиды входят в состав многих тканей.
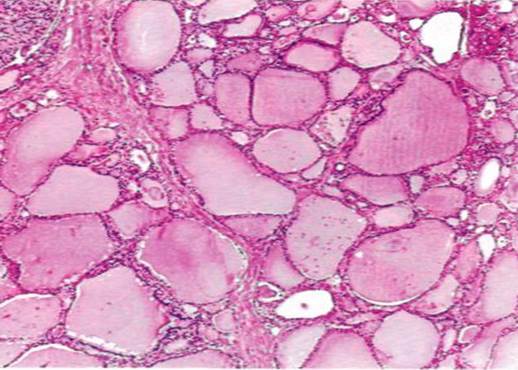
Иногда в железистых структурах накапливается не истинная слизь, а слизеподобные вещества (псевдомуцины). Эти вещества могут уплотняться и принимать характер коллоида. Тогда говорят о коллоидной дистрофии, которая наблюдается, например, при коллоидном зобе (рис. 11).
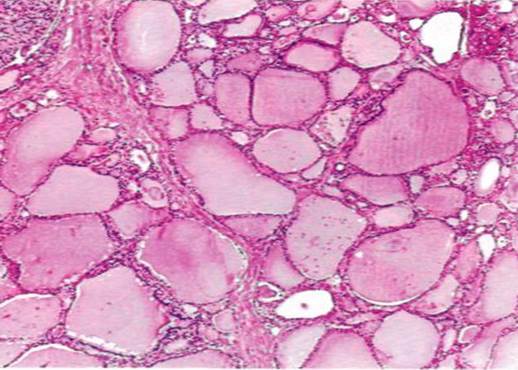
Рис. 11. Коллоидный зоб
Поджелудочная железа спаяна со стенкой нисходящей части двенадцатиперстной кишки. Главный выводной проток в головке поджелудочной железы расширен. Тело и хвост — фиброзированы, в них видны многочисленные кисты.

Рис. 13. Цирроз печени при муковисцидозе. Цирроз иногда осложняет муковисцидоз
окрашивание. Для выявления гликогена ШИК-реакцию дополняют ферментативным контролем — обработкой срезов амилазой. Гликоген окрашивается кармином Беста в красный цвет. Гликозаминогликаны и гликопротеиды определяют с помощью ряда методов, из которых наиболее часто применяют окраски толуидиновым синим или метиленовым синим. Эти окраски позволяют выявлять хромотропные вещества, дающие реакцию метахромазии. Обработка срезов ткани гиалуронидазами (бактериальной, тестикулярной) с последующей окраской теми же красителями позволяет дифференцировать различные гликозаминогликаны.
2.3.3. Углеводные дистрофии, связанные с нарушением обмена гликогена. Основные запасы гликогена находятся в_печени и скелетных мышцах. Гликоген печени и мышц расходуется в зависимости от потребностей организма (лабильный гликоген). Гликоген нервных клеток, проводящей системы сердца, аорты, эндотелия, эпителиальных покровов, слизистой оболочки матки, соединительной ткани, эмбриональных тканей, хряща и лейкоцитов является необходимым компонентом клеток, и его содержание не подвергается заметным колебаниям (стабильный гликоген). Однако деление гликогена на лабильный и стабильный условно.
Регуляция обмена углеводов осуществляется нейроэндокринным путем. Основная роль принадлежит гипоталамической области, гипофизу (АКТГ, тиреотропный, соматотропный гормоны), В-клеткам поджелудочной железы (инсулин), надпочечникам (глюкокортикоиды, адреналин) и щитовидной железе. Нарушения содержания гликогена проявляются в уменьшении или увеличении количества его в тканях и появлении там, где он обычно не выявляется. Эти нарушения наиболее ярко выражены при сахарном диабете и при наследственных углеводных дистрофиях — гликогенозах.
При сахарном диабете, развитие которого связывают с патологией В-клеток островков поджелудочной железы, происходят недостаточное использование глюкозы тканями, увеличение ее содержания в крови (гипергликемия) и выведение с мочой (глюкозурия). Тканевые запасы гликогена резко уменьшаются. Это в первую очередь касается печени, в которой нарушается синтез гликогена, что ведет к инфильтрации ее жирами — развивается жировая дистрофия печени; при этом в ядрах гепатоцитов появляются включения гликогена, они становятся светлыми («дырчатые», «пустые», ядра).
С глюкозурией связаны характерные изменения почек при диабете. Они выражаются в гликогенной инфильтрации эпителия канальцев, главным образом узкого и дистального сегментов. Эпителий становится высоким, со светлой пенистой цитоплазмой; зерна гликогена видны и в просвете канальцев. Эти изменения отражают состояние синтеза гликогена (полимеризация глюкозы) в канальцевом эпителии при резорбции богатого глюкозой ультрафильтрата плазмы.
При диабете страдают не только почечные канальцы, но и клубочки, их капиллярные петли, базальная мембрана которых становится значительно более проницаемой для сахаров и белков плазмы. Возникает одно из проявлений диабетической микроангиопатии — интеркапиллярный (диабетический) гломерулосклероз.
Смерть при диабете возникает в результате гангрены конечностей, инфаркта миокарда, уремии и редко – от диабетической комы.
БЕЛКОВЫЕ ДИСТРОФИИ.
Системная дезорганизация соединительной ткани как следствие ее деструкции. Этот вид системной дезорганизации обусловлен в большинстве случаев инфекцией, чаще стрептококковой, и тяжелыми иммунными (аутоиммунными) нарушениями, которые наиболее ярко выражены при ревматических заболеваниях. Определенное значение в их возникновении имеют и наследственные факторы.
При мукоидном набухании (рис.14) часто развиваются клеточные реакции в виде лимфоцитарно-макрофагальных скоплений (полиморфно-ядерные лейкоциты редки), что свидетельствует об участии иммунных реакций при этой поверхностной и обратимой дезорганизации соединительной ткани. Начальные изменения системной дезорганизации соединительной ткани находят в парапластической субстанции (основное вещество соединительной ткани), где накапливаются гликозаминогликаны (хромотропные вещества), главным образом за счет гидрофильных гиалуроновых структур, а также плазменные белки, преимущественно глобулины. Накопление гликозаминогликанов связано с активной деятельностью фибробластов, а глобулинов — как с усиливающейся гидрофильностью соединительной ткани, так и с нарастающей плазморрагией. Коллагеновые фибриллы практически не страдают, если не считать некоторого их разволокнения; однако "упаковка" коллагеновых фибрилл в волокне становится более рыхлой.

Рис. 14 Мукоидное набухание эндокарда при ревматизме (окраска толуидиновым синим).
Неизмененная часть клапанного эндокарда окрашена в синий цвет (1), а участки его, находящиеся в состоянии мукоидного набухания, — в сиренево-розовый цвет (метахромазия) (2).
Если учесть, что при ревматических заболеваниях (особенно ревматизме и ревматоидном артрите) иммунные реакции индуцированы стрептококком, с чем связано резкое повышение активности гиалуронидаз, то накопление гиалуроновых структур в соединительной ткани в этой ситуации можно рассматривать как проявление адаптации.
Макроскопически орган или ткань обычно не изменены. Микроскопически: выявляется феномен метахромазии, особенно с толуидиновым синим: в фокусах мукоидного набухания видно скопление гликозаминогликанов, дающих метахроматичное (сиреневое) окрашивание.
Несмотря на общие пато- и морфогенетические механизмы мукоидного набухания при ревматических заболеваниях, оно имеет определенное своеобразие в зависимости от особенностей этиологии и патогенеза каждого из заболеваний; следует учитывать также и структурно-функциональные особенности органов, что показано при ревматизме, системной красной волчанке, ревматоидном артрите.
3.1.2. Фибриноидное набухание развивается, когда поверхностная дезорганизация соединительной ткани прогрессирует, становится глубокой, захватывающей как интерстициальное (межуточное) вещество, так и коллагеновые структуры. Это уже необратимый процесс, завершающийся фибриноидным некрозом, гиалинозом, склерозом.
При исследованиях было показано, что в формировании фибриноида, помимо деструкции коллагеновых волокон, большую роль играет состояние основного вещества, прежде всего его гликозаминогликанов, которые способны осаждаться щелочными белками, высвобождающимися при повреждении волокнистых и клеточных структур соединительной ткани. Было установлено, что в построении фибриноида принимают участие и белки плазмы, в первую очередь фибриноген с последующим превращением его в фибрин.
Фибрин — обязательный компонент фибриноида, что лишний раз свидетельствует о важной роли плазморрагии в его развитии
Обнаружение же в фибриноиде иммунных комплексов подтверждает важную роль не только плазморрагии, но и нарушений иммунологического гомеостаза при фибриноидных изменениях. Становится понятной клеточная реакция при фибриноидных изменениях, преимущественно плазмоцитарная и лимфоцитарно-макрофагальная (в случаях фибриноидного некроза и нейтрофильная).
При нарушениях иммунологического гомеостаза образование фибриноида обусловлено главным образом иммунокомплексным повреждением соединительной ткани с последующей абсорбцией фибрина — "фибриноид иммунных комплексов", "фибриноид деструкции". Однако при различных ревматических болезнях (рис.15), патогенез которых связан с нарушением иммунологического гомеостаза, образуется разный фибриноид.

Рис.15. Фибриноидное набухание при ревматоидном артрите.
Морфргенез амилоидоза.
I. Клеточная трансформация ретикуло-эндотелиальной системы, предшествующая образованию клонов клеток – амилоидобластов.
II. Синтез амилоидобластами главного компонента амилоида – фибриллярного белка.
III. Агрегация фибрилл друг с другом с образованием каркаса амилоида.
IV. Соединение агрегированных фибрилл с белками плазмы крови, а также с гликозоаминогликанами тканей, что приводит к выпадению в тканях аномального вещества – амилоида.
На первой стадии происходит образование в органах ретикуло-эндотелиальной системы плазматических клеток (плазматизация костного мозга, селезенки, лимфаимческих узлов, печени). Плазматизация отмечается и в строме органов. Плазматические клетки преобразуются в клетки-амилоидобласты. Синтез фибриллярного белка всегда происходит в клетках, имеющих мезенхимное происхождение. Это лимфоциты, плазматические клетки, фибробласты, ретикулярные клетки. Фибробласты чаще всего встречаются при семейном амилоидозе, плазматические - при первичном амилоидозе, ретикулярные – при вторичном амилоидозе. Также в качестве амилоидобластов могут выступать купферовские клетки печени, звездчатые эндотелиоциты, мезангиальные клетки (в почке). Когда белка накапливается достаточно, происходит формирование каркаса.
Фибриллярный белок рассматривается как чужеродный, аномальный. В ответ на его образование появляется дополнительная группа клеток, которая начинает пытаться лизировать амилоид. Эти клетки называются амилоидокластами. Функцию таких клеток могут осуществлять свободные и фиксированные макрофаги. В течение долгого времени между клетками, которые образуют и рассасывают амилоид, происходит равная борьба, но она всегда заканчивается победой амилоидобластов, так как в тканях возникает иммунологическая толерантность к белку фибрилл амилоида. На фибриллярный скелет происходит осаждение белков и полисахаридов.
Образуется амилоид всегда вне клеток и всегда имеет тесную связь с волокнами соединительной ткани: с ретикулярными и коллагеновыми. Если выпадение амилоида происходит по ходу ретикулярных волокон в мембранах сосудов или желез, то он называется периретикулярным амилоидом и наблюдается в селезенке, надпочечниках и кишечнике. Если образование и выпадение амилоида приходится на коллагеновые волокна, то он называется периколлагеновым или мезенхимальным. В данном случае поражается адвентиция крупных сосудов, строма миокарда, поперечно-полосатая и гладкая мускулатура, нервы и кожа.
Существует три старых и одна современная теория патогенеза амилоидоза.
Патогенез амилоидоза.
1. Теория диспротеиноза. По данным этой теории, развивается диспротеинемия, при ней происходит накопление в плазме крови грубодисперсных белковых фракций и аномальных белков – парапротеинов. Они появляются за счет нарушенного белкового обмена. Потом они выходят за пределы сосудистого русла, взаимодействуют с мукополисахаридами тканей. Эта теория является прямолинейной и не дает объяснения возникновения диспротеинемии.
2. Иммунологическая теория. При разнообразных заболеваниях накапливаются продукты распада тканей, лейкоцитов, в крови циркулируют также токсины бактерий – все эти вещества имеют антигенные свойства и приводят к образованию антител самим себе. Развивается иммунная реакция соединения антигенов с антителами в тех местах, где происходила продукция антител, т.е. в органах ретикуло-эндотелиальной системы. Эта теория объяснила только часть амилоидной дистрофии, т.е. ту, где имеется хроническое нагноение, и не объясняет генетические формы амилоидоза.
3. Теория клеточно-локального синтеза. Эта теория изучает амилоид как секрет мезенхимальных клеток.
4. Универсальная теория .- мутационная. Мутагенные факторы оказывают влияние на клетки, тем самым выз






















