Производство серной кислоты и извести
Большой интерес вызывает возможность переработки фосфогипас в элементарную серу и известь. Для этого сульфат кальция восстанавливают коксом или продуктами конверсии природного газа:
CaSO4 + 2C = CaS + 2CO2
CaSO4 + 4CO = CaS + 4CO2
CaSO4 + 4H2 = CaS + 4H2O
Далее сульфид кальция обрабатывают водой, а полученную суспензию – диоксидом углерода:
CaS + H2O + CO2 = H2S + CaCO3
Полученный сероводород можно полностью окислить, а образующийся печной газ переработать в серную кислоту методом мокрого катализа.
Получение сульфата аммония
Процесс заключается во взаимодействии предварительно приготовленного раствора карбоната аммония с суспензией фосфогипса:
CaSO4 + (NH4)2CO3 = (NH4)2SO4+ CaCO3
Процесс можно осуществлять при атмосферном и повышенном давлении. Равновесие реакции сдвинуто вправо, так как в системе образуется CaCO3 - менее растворимая соль, чем CaSO4. Выпавший в осадок CaCO3 отделяют от 35-40% раствора сульфата аммония. Избыток аммиака в этом растворе нейтрализуют серной кислотой. Полученный раствор упаривают, выпавшие кристаллы (NH4)2SO4 отделяют на центрифуге и сушат. Для получения 1 т (NH4)2SO4 расходуется 1340 кг гипса, 340 кг СО2, 60 кг Н2SO4 и 260 кг аммиака. На 1 т (NH4)2SO4 образуется до 0,76 т CaCO3, который можно использовать для известкования почв или в производстве строительных материалов.
Также возможно использование фосфогипса в сельском хозяйстве для солонцовых почв. При внесении в такие почвы гипса происходит образование сульфата натрия, который легко вымывается поливной водой и почвенный покров обессоливается.
Задачи.
1. Рассчитайте стехиометрический расход хлоргаза, содержащего 95%  , и известкового молока концентрации 160 кг/м3 СаО для обезвреживания 135 м3 сточной воды, имеющей в своем составе 0,12 кг/м3 фосфора и 0,35 кг/м3 фосфорной кислоты.
, и известкового молока концентрации 160 кг/м3 СаО для обезвреживания 135 м3 сточной воды, имеющей в своем составе 0,12 кг/м3 фосфора и 0,35 кг/м3 фосфорной кислоты.
2. Рассчитайте необходимое количество электрофильтров ГПФ-22-9 для очистки 50000 нм 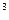 /час газа и степень очистки газа, если допустимая линейная скорость составляет 0,3 м/с, начальная концентрация фосфорнокислого тумана 1500 мг/м3, конечная 80 мг/м3. Температура газа — 373К.
/час газа и степень очистки газа, если допустимая линейная скорость составляет 0,3 м/с, начальная концентрация фосфорнокислого тумана 1500 мг/м3, конечная 80 мг/м3. Температура газа — 373К.
3. На абсорбционную очистку поступает 7500 м3 газа, содержащего 7,5 г/м3 фтора в виде SiF4. Степень абсорбции составляет 0,9. Определить расход воды на орошение (если концентрация образующейся кислоты 7% Н2SiF6) и расход поваренной соли (92% NаСI) для осаждения кремнефторида натрия из полученной кислоты.
4. Рассчитайте количество осадка, образующегося при разложении 15,3 т/час фосфорита состава: 39% СаО; 23% Р2О5; 17,8% нерастворимого остатка при условии, что осадок состоит из СаSO4*2Н2O и нерастворимого остатка; растворимость гипса в жидкой фазе 0,9%, концентрация Р2О5 в жидкой фазе 18%.
5. Рассчитайте массы образующихся фосфорной кислоты концентрацией 20% Р2O5, фосфогипса влажностью 40% и фтористых газов с концентрацией 0,15% F (объемных) при разложении 5 т фосфоритов Каратау следующего состава: 24,5% Р2O5; 40,2% СаО; 2,6% F. Гипсовое число принять равным 1,45, степень выделения фтора в газовую фазу — 0,25, степень разложения сырья 0,96.
6. Определите расход известкового молока, необходимого для обезвреживания 125 м3 сточной воды производства фосфорных удобрений, содержащей 0,25 г/л фтора в виде кремнефтористоводородной кислоты и 1,2 г/л Р2O5 в виде фосфорной кислоты. Известковое молоко содержит 100 г/л СаО.
7. В производстве фосфатов аммония образуется 2100 м3 отходящего газа, содержащего 0,65% NНз. Улавливание аммиака осуществляется раствором фосфорной кислоты с концентрацией 18% Р2O5, содержащим моноаммонийфосфат в массовом соотношении Р2O5: NH4H2PO4 =2:1. Рассчитайте расход абсорбента и массу моноаммонийфосфата в вытекающем растворе, полагая, что в результате взаимодействия газа и раствора образуется моноаммонийфосфат.
8. Определите массу образующихся фосфорной кислоты (28% НзРO4), гипса, объем фтористых газов концентрации 2,5 г/м3 при разложении 1 т фосфорита состава, %: Р2O5 — 25,0; СаО—41,5; F—2,1. Степень выделения фтора в газовую фазу составляет 0,2, степень разложения сырья 0,95.
9. Рассчитайте необходимое количество электрофильтров ГПФ-22-9 для очистки 35000- нм3/час газа и степень его очистки, если принять допустимую линейную скорость газа равной 0,35 м/с, начальную концентрацию фосфорнокислотного тумана 1350 мг/м3, конечную — 85 мг/м3, температура газа -343К.
10. Рассчитайте массы осадка и раствора фосфорной кислоты, образующихся при разложении 16 т/час фосфорита состава, %: СаО — 40,5; Р2O5 - 22,5; 16,3 - нерастворимого остатка, при условии, что осадок состоит из гипса и нерастворимого остатка, растворимость CaSO4*2H2O в жидкой фазе – 1,1%, концентрация Р2O5 в жидкой фазе - 18,5%.
11. На станцию нейтрализации химического завода поступает 150 м3/час сточных вод фосфорнокислотного производства, содержащих 0,35 кг/м3  в виде фосфорной кислоты и 20 кг/м3 механических примесей. Рассчитайте расход известкового молока концентрацией 115,0 кг/м3 для нейтрализации сточных вод, а также количество образующегося шлама влажностью 30%, предположив, что фосфат кальция полностью переходит в осадок.
в виде фосфорной кислоты и 20 кг/м3 механических примесей. Рассчитайте расход известкового молока концентрацией 115,0 кг/м3 для нейтрализации сточных вод, а также количество образующегося шлама влажностью 30%, предположив, что фосфат кальция полностью переходит в осадок.
12. Рассчитайте количества серной кислоты (93% 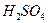 ) и оксида кальция, которые можно получить из 15*104 кг фосфогипса, содержащего 78%
) и оксида кальция, которые можно получить из 15*104 кг фосфогипса, содержащего 78% 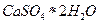 при степени его разложения 0,95. Степень окисления
при степени его разложения 0,95. Степень окисления 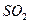 составляет 0,98, абсорбции
составляет 0,98, абсорбции 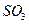 — 0,99. Определите стехиометрическое количество кокса, необходимого для проведения процесса разложения гипса.
— 0,99. Определите стехиометрическое количество кокса, необходимого для проведения процесса разложения гипса.
13. Рассчитайте массы фосфорной кислоты (30%  ), фосфогипса (влажность 40%) и фтористых газов, образующихся при разложении 5 т апатитового концентрата, содержащего 39,5%
), фосфогипса (влажность 40%) и фтористых газов, образующихся при разложении 5 т апатитового концентрата, содержащего 39,5%  , 52,1% СаО, 3,2% F. Степень разложения сырья составляет 97%, в газовую фазу выделяется 33% от всего количества фтора, при этом соотношение
, 52,1% СаО, 3,2% F. Степень разложения сырья составляет 97%, в газовую фазу выделяется 33% от всего количества фтора, при этом соотношение  = 1:4 (молярное).
= 1:4 (молярное).
14. Рассчитайте объем сернистого газа и массу оксида кальция, которые могут быть получены из 5*103 кг фосфогипса, содержащего 70,5% 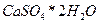 при степени разложения его 87%; концентрация сернистого ангидрида в газе 8,3%. Рассчитайте также количество кокса, необходимого для разложения фосфогипса, если коэффициент избытка его составляет 2,7.
при степени разложения его 87%; концентрация сернистого ангидрида в газе 8,3%. Рассчитайте также количество кокса, необходимого для разложения фосфогипса, если коэффициент избытка его составляет 2,7.
15. Для очистки 125 м3 сточных вод, содержащих 2,3 г/л 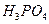 , 0,5 г/л
, 0,5 г/л  и 2,7 г/л взвешенных примесей, использовали известковое молоко концентрации 15% СаО. Рассчитайте расход известкового молока при коэффициенте избытка его — 1,15 и массу образующегося осадка, если пренебречь растворимостью образующихся солей.
и 2,7 г/л взвешенных примесей, использовали известковое молоко концентрации 15% СаО. Рассчитайте расход известкового молока при коэффициенте избытка его — 1,15 и массу образующегося осадка, если пренебречь растворимостью образующихся солей.
16. Рассчитайте расход орошающего раствора, содержащего 1,5%  и 3% NaF, для очистки 15000 м3 газа, в котором 4 г/м3 НF и 1,6 г/м3
и 3% NaF, для очистки 15000 м3 газа, в котором 4 г/м3 НF и 1,6 г/м3 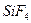 . Считать, что в результате взаимодействия газа и орошающего раствора образуются
. Считать, что в результате взаимодействия газа и орошающего раствора образуются  и
и 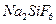 . Коэффициент избытка раствора принять равным 2,3; расчет массы раствора вести по расходу карбоната аммония.
. Коэффициент избытка раствора принять равным 2,3; расчет массы раствора вести по расходу карбоната аммония.
17. Рассчитайте расход абсорбента, содержащего 2,3%  и 2,8% NaF, для очистки 38000 м3 газа, в котором присутствует 5 г/м3 фтора в виде НF и
и 2,8% NaF, для очистки 38000 м3 газа, в котором присутствует 5 г/м3 фтора в виде НF и 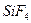 в массовом соотношении 4:1. В результате взаимодействия абсорбента и фтористых соединений газа образуются фторид аммония и кремнефторид натрия. Расход раствора необходимо рассчитать по карбонату аммония, коэффициент избытка его составляет 2,1.
в массовом соотношении 4:1. В результате взаимодействия абсорбента и фтористых соединений газа образуются фторид аммония и кремнефторид натрия. Расход раствора необходимо рассчитать по карбонату аммония, коэффициент избытка его составляет 2,1.
18. Рассчитайте расход аммиачной воды, содержащей 10%  , для улавливания фтора из 8000 м3 газов, содержащих 15 г/
, для улавливания фтора из 8000 м3 газов, содержащих 15 г/ 
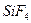 . Коэффициент избытка раствора составляет 1,8. Определите остаточное содержание
. Коэффициент избытка раствора составляет 1,8. Определите остаточное содержание 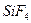 в выбрасываемом газе, если степень улавливания составляет 0,9.
в выбрасываемом газе, если степень улавливания составляет 0,9.
19. На абсорбцию водой поступает 5000 м3 газа, содержащего 5*10-3 кг/м3 фтора в виде НF и 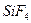 в молярном соотношении 1:1. Концентрация образующейся при абсорбции кислоты — 8%
в молярном соотношении 1:1. Концентрация образующейся при абсорбции кислоты — 8%  , степень абсорбции — 0,80. Определите количество кремнефторида натрия, полученного при обработке кремнефтористоводородной, кислоты содой, при степени ее осаждения 0,95.
, степень абсорбции — 0,80. Определите количество кремнефторида натрия, полученного при обработке кремнефтористоводородной, кислоты содой, при степени ее осаждения 0,95.
20. Составьте материальный баланс установки абсорбции фтористых газов, полученных при разложении 120*103 кг апатитового концентрата, содержащего 2,9%F, при степени выделения фтора (в виде 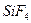 ) в газовую фазу 0,6. Абсорбция осуществляется водой. Концентрация получаемой кислоты 10%
) в газовую фазу 0,6. Абсорбция осуществляется водой. Концентрация получаемой кислоты 10%  .
.
21. Составьте материальный баланс установки абсорбции фтористых газов, полученных при разложении 120*103 кг апатитового концентрата, содержащего 2,9%F, при степени выделения фтора (в виде 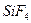 ) в газовую фазу 0,6. Абсорбция осуществляется водой. Концентрация получаемой кислоты 10%
) в газовую фазу 0,6. Абсорбция осуществляется водой. Концентрация получаемой кислоты 10%  .
.
22. Составьте материальный баланс получения кремнефторида натрия из 1520 кг раствора кремнефтористоводородной кислоты (9%  ). Осаждение ведут сульфатом натрия (содержание основного вещества
). Осаждение ведут сульфатом натрия (содержание основного вещества  — 90,2), коэффициент избытка сульфата натрия — 1,15.
— 90,2), коэффициент избытка сульфата натрия — 1,15.
23. В абсорбционную систему поступает 8000 м3/ час газа, содержащего 12*103 кг/м3 фтора в виде  . Степень улавливания фтора 0,95. Рассчитайте количество воды, подаваемой на орошение башни, количество образующейся кремнефтористоводородной кислоты концентрации 3% и размеры абсорбционной башни. Плотность орошения башни 5 м3/м2 час. Отношение высоты башни к диаметру принять равным 4.
. Степень улавливания фтора 0,95. Рассчитайте количество воды, подаваемой на орошение башни, количество образующейся кремнефтористоводородной кислоты концентрации 3% и размеры абсорбционной башни. Плотность орошения башни 5 м3/м2 час. Отношение высоты башни к диаметру принять равным 4.
24. Подберите реагент и рассчитайте его количество для очистки 80 м3 сточных вод, содержащих 4 г/л однозамещенного фосфата аммония и 2 г/л кремнефтористого аммония.
25. Рассчитайте расход извести, содержащей 95% СаО, для дистилляции аммиака из 120 м3 сточной воды, содержащей 12 г/л 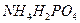 и 2 г/л (
и 2 г/л ( )
) 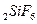 . Коэффициент избытка извести составляет 1,5.
. Коэффициент избытка извести составляет 1,5.
26. Составьте материальный баланс процесса очистки 120 м3 сточных вод, содержащих 5 г/л 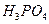 и 75 г/л
и 75 г/л  , известковым молоком, если концентрация СаО в нем составляет 15%. Избыток известкового молока сверх стехиометрического составляет 20%.
, известковым молоком, если концентрация СаО в нем составляет 15%. Избыток известкового молока сверх стехиометрического составляет 20%.
27. Определите массу образующегося осадка фторида натрия и расход кальцинированной соды при обработке 1170 м3 раствора, содержащего 4,5%  (d = 1020 кг/м3), если расход соды составляет 0,9 от стехиометрического количества, а растворимость NаF в растворе составляет 2,8%.
(d = 1020 кг/м3), если расход соды составляет 0,9 от стехиометрического количества, а растворимость NаF в растворе составляет 2,8%.
28. Определите массу образующегося осадка фторида натрия и расход сульфата натрия в процессе обработки 65 м3 раствора, содержащего 5,4% NH4 F(d = 1050), если расход сульфата натрия составляет 0,95 от стехиометрического количества, растворимость NaF в растворе принять равной 2,9%.





 , и известкового молока концентрации 160 кг/м3 СаО для обезвреживания 135 м3 сточной воды, имеющей в своем составе 0,12 кг/м3 фосфора и 0,35 кг/м3 фосфорной кислоты.
, и известкового молока концентрации 160 кг/м3 СаО для обезвреживания 135 м3 сточной воды, имеющей в своем составе 0,12 кг/м3 фосфора и 0,35 кг/м3 фосфорной кислоты.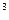 /час газа и степень очистки газа, если допустимая линейная скорость составляет 0,3 м/с, начальная концентрация фосфорнокислого тумана 1500 мг/м3, конечная 80 мг/м3. Температура газа — 373К.
/час газа и степень очистки газа, если допустимая линейная скорость составляет 0,3 м/с, начальная концентрация фосфорнокислого тумана 1500 мг/м3, конечная 80 мг/м3. Температура газа — 373К. в виде фосфорной кислоты и 20 кг/м3 механических примесей. Рассчитайте расход известкового молока концентрацией 115,0 кг/м3 для нейтрализации сточных вод, а также количество образующегося шлама влажностью 30%, предположив, что фосфат кальция полностью переходит в осадок.
в виде фосфорной кислоты и 20 кг/м3 механических примесей. Рассчитайте расход известкового молока концентрацией 115,0 кг/м3 для нейтрализации сточных вод, а также количество образующегося шлама влажностью 30%, предположив, что фосфат кальция полностью переходит в осадок.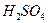 ) и оксида кальция, которые можно получить из 15*104 кг фосфогипса, содержащего 78%
) и оксида кальция, которые можно получить из 15*104 кг фосфогипса, содержащего 78% 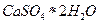 при степени его разложения 0,95. Степень окисления
при степени его разложения 0,95. Степень окисления 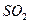 составляет 0,98, абсорбции
составляет 0,98, абсорбции 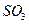 — 0,99. Определите стехиометрическое количество кокса, необходимого для проведения процесса разложения гипса.
— 0,99. Определите стехиометрическое количество кокса, необходимого для проведения процесса разложения гипса. = 1:4 (молярное).
= 1:4 (молярное).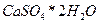 при степени разложения его 87%; концентрация сернистого ангидрида в газе 8,3%. Рассчитайте также количество кокса, необходимого для разложения фосфогипса, если коэффициент избытка его составляет 2,7.
при степени разложения его 87%; концентрация сернистого ангидрида в газе 8,3%. Рассчитайте также количество кокса, необходимого для разложения фосфогипса, если коэффициент избытка его составляет 2,7.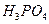 , 0,5 г/л
, 0,5 г/л  и 2,7 г/л взвешенных примесей, использовали известковое молоко концентрации 15% СаО. Рассчитайте расход известкового молока при коэффициенте избытка его — 1,15 и массу образующегося осадка, если пренебречь растворимостью образующихся солей.
и 2,7 г/л взвешенных примесей, использовали известковое молоко концентрации 15% СаО. Рассчитайте расход известкового молока при коэффициенте избытка его — 1,15 и массу образующегося осадка, если пренебречь растворимостью образующихся солей. и 3% NaF, для очистки 15000 м3 газа, в котором 4 г/м3 НF и 1,6 г/м3
и 3% NaF, для очистки 15000 м3 газа, в котором 4 г/м3 НF и 1,6 г/м3 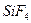 . Считать, что в результате взаимодействия газа и орошающего раствора образуются
. Считать, что в результате взаимодействия газа и орошающего раствора образуются  и
и 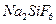 . Коэффициент избытка раствора принять равным 2,3; расчет массы раствора вести по расходу карбоната аммония.
. Коэффициент избытка раствора принять равным 2,3; расчет массы раствора вести по расходу карбоната аммония. и 2,8% NaF, для очистки 38000 м3 газа, в котором присутствует 5 г/м3 фтора в виде НF и
и 2,8% NaF, для очистки 38000 м3 газа, в котором присутствует 5 г/м3 фтора в виде НF и  , для улавливания фтора из 8000 м3 газов, содержащих 15 г/
, для улавливания фтора из 8000 м3 газов, содержащих 15 г/ 
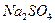 — 90,2), коэффициент избытка сульфата натрия — 1,15.
— 90,2), коэффициент избытка сульфата натрия — 1,15.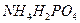 и 2 г/л (
и 2 г/л ( )
) 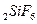 . Коэффициент избытка извести составляет 1,5.
. Коэффициент избытка извести составляет 1,5.


