

Историки об Елизавете Петровне: Елизавета попала между двумя встречными культурными течениями, воспитывалась среди новых европейских веяний и преданий...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Историки об Елизавете Петровне: Елизавета попала между двумя встречными культурными течениями, воспитывалась среди новых европейских веяний и преданий...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...
Топ:
Особенности труда и отдыха в условиях низких температур: К работам при низких температурах на открытом воздухе и в не отапливаемых помещениях допускаются лица не моложе 18 лет, прошедшие...
Основы обеспечения единства измерений: Обеспечение единства измерений - деятельность метрологических служб, направленная на достижение...
Процедура выполнения команд. Рабочий цикл процессора: Функционирование процессора в основном состоит из повторяющихся рабочих циклов, каждый из которых соответствует...
Интересное:
Что нужно делать при лейкемии: Прежде всего, необходимо выяснить, не страдаете ли вы каким-либо душевным недугом...
Берегоукрепление оползневых склонов: На прибрежных склонах основной причиной развития оползневых процессов является подмыв водами рек естественных склонов...
Мероприятия для защиты от морозного пучения грунтов: Инженерная защита от морозного (криогенного) пучения грунтов необходима для легких малоэтажных зданий и других сооружений...
Дисциплины:
|
из
5.00
|
Заказать работу |
Содержание книги
Поиск на нашем сайте
|
|
|
|
Серная кислота – один из многотоннажных продуктов химической промышленности. Сырьем для производства серной кислоты служат элементарная сера, серосодержащие минералы (колчедан и CaSO4) и отходящие газы, содержащие SO2 и H2S.
Существуют два способа получения серной кислоты: контактный и нитрозный. В первом случае окисление сернистого ангидрида в серный ангидрид происходит на катализаторе, а во втором – с помощью оксидов азота, растворенных в серной кислоте (нитроза). Второй путь получения серной кислоты в настоящее время утратил свое практическое значение, поэтому мы будем рассматривать способы утилизации отходов, образующихся в производстве серной кислоты контактным методом.
Основные стадии получения серной кислоты контактным способом:
- обжиг серосодержащего сырья с получением сернистого ангидрида;
- окисление SO2 в SO3 кислородом воздуха на платиновом катализаторе;
- абсорбция серного ангидрида водой или растворами серной кислоты.
В настоящее время созданы технологические схемы с аппаратами большой единичной мощности (1000-2000 т/сутки H2SO4).
Основные отходы производства H2SO4: огарок и селеновый шлам (при работе системы на колчедане), отходящие газы, содержащие SO2 и туман H2SO4, а также кислые стоки.
Способы утилизации огарков. Основной минерал, входящий в состав пиритных руд, - сульфид железа. Кроме него, руда содержит также соединения меди в виде CuFeS2, Cu2S, CuS, цинка ZnS, мышьяка FeAsS, а также в небольших количествах соединения Se, Co, Ni, Mn, Ag, Au и т.д. После флотации таких полиметаллических руд получают флотационный концентрат и флотационный колчедан, содержащий от 40 до 45% серы и от 35 до 39% железа. Соединения цветных и драгоценных металлов, содержащиеся в исходной руде, также частично переходят во флотационный колчедан. При высокотемпературном обжиге флотационного колчедана (750-8000С) образуется около 700 кг огарка на 1 т колчедана.
Наиболее рациональным способом переработки огарков сернокислотного производства является низкотемпературный хлорирующий обжиг, позволяющий комплексно извлекать редкие и цветные металлы и перерабатывать железосодержащий остаток на чугун, причем извлечение одной только меди из огарков является экономически оправданным за счет ее реализации.
В качестве хлорирующего агента используют избыток хлорида натрия. Сначала огарок измельчают и рассеивают. Гранулы размером 4 мм смешивают с хлоридом натрия (8-20% масс.). Полученную шихту обжигают в печах при 550-6000С. Из отходящих газов HCl и SO3 улавливают в абсорбционных башнях, орошаемых водой, с получением соляной и серной кислоты. Твердый осадок, содержащий хлориды металлов, обрабатывают раствором серной кислоты (кислотное выщелачивание), при этом в раствор переходят медь, цинк, кобальт, таллий, кадмий и серебро. Из этого раствора осаждают медь вместе с серебром и золотом путем цементации ее скрапом. Далее цементная медь подвергается переплавке, очистке, отливке анодов и электролитическому рафинированию. После отделения меди из раствора путем вакуум-кристаллизации осаждают глауберову соль (Na2SO4 . 10H2O), а затем обжигом – сульфат натрия.
|
|
Маточник после вакуум-кристаллизации содержит кобальт, цинк, железо и марганец.
Вначале маточный раствор окисляют хлором и обрабатывают СаСО3; железо выделяется в виде железогипсового осадка.
Кобальт выделяется путем окисления его соединений хлором с последующим осаждением Са(ОН)2. Образование Со(ОН)3 происходит при 500С и рН=4. Вместе с кобальтом осаждаются также гидроксиды марганца и цинка. Для получения металлического кобальта полученный осадок растворяют в серной кислоте с последующим переосаждением гидроксидов, прокаливают при 11000С и подвергают восстановительной плавке.
Извлечение кадмия, таллия и индия проводят амальгамным методом из растворов перед осаждением цинка.
При комплексной переработке огарков низкотемпературным хлорирующим обжигом достигается следующая степень извлечения металлов (в %): железа в кек и агломерат – 80, серы в сульфат натрия – 40, меди – 80, цинка в ZnO – 80, свинца – 40, серебра – 65, кадмия – 40, кобальта – 50, таллия – 17.
Существуют другие способы переработки огарка:
1) Высокотемпературный хлорирующий обжиг огарков или метод возгонки (10000С). В данном случае хлориды металлов возгоняются во время обжига и затем улавливаются и растворяются в воде с последующим разделением.
2) Сульфатизирующий обжиг пиритного сырья с последующей гидрометаллургической переработкой огарка.
3) Огарок можно использовать в качестве исходного сырья для производства минеральных пигментов (железный сурик, мумия, охра). Для получения минеральных пигментов хорошего качества огарок необходимо очистить от соединений серы, которые вызывают коррозию аппаратуры, и размолоть. Водорастворимые соединения серы извлекаются из огарка промывкой водой, а полное удаление серы - путем обжига при 800-9000С. После обжига получается продукт, состоящий на 90-95% из Fe2O3, который размельчают и смешивают с наполнителем. В качестве наполнителей используются мел, алебастр, глина.
|
|
4) Крупным потребителем огарка является цементная промышленность. Огарок используется в качестве железосодержащего флюса.
Утилизация селенового шлама
Содержащиеся в колчедане примеси соединений селена (0,002-0,02%) при обжиге переходят в газовую фазу в виде SeO2, который улавливается серной кислотой в промывном отделении. Под воздействием SO2 обжигового газа диоксид селена, содержащийся в растворе серной кислоты, восстанавливается до металлического селена. Металлический селен адсорбируется на огарковой пыли и вместе с серной кислотой частично осаждается в промывном отделении. Там он накапливается в отстойниках и сборниках кислоты в виде бедного селенового шлама (до 5% Se). При дальнейшей очистке обжигового газа от брызг и тумана серной кислоты в мокрых электрофильтрах происходит выделение богатого селенового шлама (до 50% Se).
Технология выделения селена проста и одинакова для бедного и богатого шлама. Метод состоит из следующих стадий:
1) разбавление шлама водой и подогрев раствора острым паром для довосстановления селена;
2) фильтрование пульпы и промывка ее 50% раствором соды;
3) сушка шлама при 90-1000С;
4) приготовление усредненного шлама, содержащего 10-12% селена.
Очистка отходящих газов от SO2 и тумана серной кислоты
В мировом масштабе доля SO2, выбрасываемого в атмосферу с технологическими газами сернокислотных заводов, составляет только 0,5% по сравнению с общим количеством выбрасываемого SO2. Основное количество SO2 выбрасывается в атмосферу тепловыми электростанциями (50%), транспортом (20%), предприятиями цветной и черной металлургии (25%), нефтехимическими заводами (3%).
Известные методы извлечения SO2 из различных технологических газов можно подразделить на абсорбционные, адсорбционные и каталитические.
1. Абсорбционные или мокрые способы основаны на поглощении SO2 растворами аммиачных солей (NH4)2SO3, сульфита натрия Na2SO3, едкого натра NaOH, соды Na2CO3, суспензиями CaO, MgO, ZnO, другими растворами. Происходит химическое взаимодействие SO2 с компонентом с последующим отделением образовавшегося соединения.
2. Адсорбционные или сухие методы заключаются в извлечении SO2 с помощью твердых сорбентов, таких как активированный уголь, карбонаты щелочных металлов, порошкообразный диоксид марганца, специально подготовленный торф.
|
|
3. Каталитические методы дают возможность получать непосредственно серную кислоту путем окисления SO2 на различных катализаторах.
В сернокислотном производстве наиболее широко используются два процесса утилизации SO2:
1) использование для производства серной кислоты метода двойного контактирования;
2) аммиачные методы очистки отходящих газов от SO2.
Метод двойного контактирования. Особенность метода – промежуточная абсорбция, которая приводит к увеличению общей степени окисления SO2 в SO3 до 99,5-99,8% (следовательно, увеличивается общая степень использования серосодержащего сырья) и соответственному уменьшению концентрации SO2 в отходящих газах. Высокая степень окисления сернистого ангидрида в серный приводит к уменьшению выбросов SO2 на 90% по сравнению с классической схемой. Концентрация SO2 в выбрасываемом газе не превышает предельно допустимой концентрации (0,02-0,03 объемных %).
Недостатки процесса:
1) необходимость дополнительного оборудования;
2) система перерабатывает газы, содержащие более 8 объемных % SO2.
Аммиачные способы позволяют проводить очистку газов до 0,1 объем. % SO2. Процесс включает следующие стадии:
- абсорбция SO2 аммиачной водой;
- регенерация аммиака путем разложения абсорбционного раствора сульфита-гидросульфита аммония.
Основным недостатком процесса является накопление в системе сульфата аммония за счет поглощения SO3 и тумана серной кислоты и окисления сульфита-гидросульфита аммония в сульфат кислородом, содержащимся в отходящих газах. 30-50% SO2 превращается в сульфат аммония, что приводит к потере большого количества серосодержащего сырья
.
Очистка сточных вод
Расход воды на 1 т серной кислоты составляет 40-60 м3/т, однако основное ее количество расходуется на охлаждение кислоты, в то время как технологическая вода составляет примерно 1,5 м3/т. Основное количество кислых стоков образуется за счет утечки и проливов кислоты в отделении мокрой очистки газа, в абсорбционном и сушильном отделениях и в процессах охлаждения кислоты.
Для обезвреживания этих стоков наиболее рациональным решением является нейтрализация их известью или содой с последующей рециркуляцией воды и удалением осадков. Основная стадия процесса – нейтрализация стоков известью до рН=6:
CaO + H2O + H2SO4 = CaSO4 + 2H2O
В этом случае происходит осаждение иона SO4-2 в виде сульфата кальция. После осветления и охлаждения вода присоединяется к общей канализационной системе или направляется на рециркуляцию.
Один из путей решения проблемы стоков – это замена водяного охлаждения серной кислоты воздушным охлаждением, что привело бы к значительному сокращению потребления воды в производстве H2SO4.
|
|
Задачи
1. Определите массу образующегося огарка в производстве серной кислоты, если производительность цеха 45 т/час 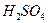 . В составе колчедана 41% серы в виде
. В составе колчедана 41% серы в виде 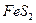 и пустая порода. Считать, что огарок состоит из гематита (
и пустая порода. Считать, что огарок состоит из гематита (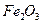 ) и пустой породы.
) и пустой породы.
2. Рассчитайте массу образующегося богатого селенового шлама (51% Sе) в сернокислотном цехе мощностью 540 т/сутки 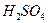 . Сырьем служит серный колчедан (42% S, 0,075% Sе), при обжиге которого в газовую фазу выделяется 65% Sе, при этом 45% Sе переходит в богатый шлам.
. Сырьем служит серный колчедан (42% S, 0,075% Sе), при обжиге которого в газовую фазу выделяется 65% Sе, при этом 45% Sе переходит в богатый шлам.
3. Составьте материальный баланс процесса очистки 23000 м3/час отходящих газов, содержащих 5,5% О2, 85% N2, 9% 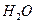 и 0,5%
и 0,5% 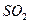 , от сернистого ангидрида известковым методом. Концентрация известкового молока составляет 125 г/л СаО, коэффициент избытка раствора равен 1,3. Считайте, что влажность газа в процессе очистки не изменяется.
, от сернистого ангидрида известковым методом. Концентрация известкового молока составляет 125 г/л СаО, коэффициент избытка раствора равен 1,3. Считайте, что влажность газа в процессе очистки не изменяется.
4. На обжиг в печь «КС» поступает 18*103 кг колчедана, содержащего 42% S. Степень выгорания серы составляет 0,98. Определите: а) количество образующегося огарка, предположив, что колчедан состоит только из гематита и пустой породы; б) содержание серы в огарке.
5. Определите количество циклонов НИИОГАЗ, необходимых для очистки печного газа сернокислотного цеха, содержащего 0,1 кг/м3 огарковой пыли, и количество осаждающейся в циклонах пыли при степени очистки газа 0,95. Плотность газа при н.у. 1,4 кг/м3, температура 683 К. Количество поступающегогаза76000 м 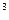 /час.
/час.
6. Рассчитайте массу образующегося богатого селенового шлама (концентрация селена 45%) в сернокислотном производстве с мощностью 1000 т/сутки Н2SO4 . В качестве сырья используется серный колчедан, содержащий 40% S и 0,05% SeO2. В богатый шлам переходит 30% от всей массы селена.
7. Составьте материальный баланс процесса очистки отходящих газов сернокислотного производства. Объем газов 35000 м3, содержание SO2 — 0,3%, SO3 — 0,1%. Абсорбентом служит содовый раствор концентрации 5% Nа2СOз, коэффициент избытка раствора принять равным 1,7.
8. Рассчитайте массу орошающего раствора сульфита аммония для улавливания сернистого ангидрида из 50000 м3 газа с концентрацией 0,4% SO2. Концентрация (NH4)2SOз в поступающем растворе 5%, в реакцию вступает 50% сульфита аммония.
9. Составьте материальный баланс процесса обжига колчедана при производстве 40 т/час 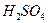 . Состав колчедана: 41% S в виде
. Состав колчедана: 41% S в виде 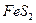 и пустая порода. Обжиг происходит при избытке воздуха, коэффициент избытка равен 1,4. Принять, что огарок состоит из гематита (
и пустая порода. Обжиг происходит при избытке воздуха, коэффициент избытка равен 1,4. Принять, что огарок состоит из гематита (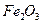 ) и пустой породы и не содержит сернистые соединения.
) и пустой породы и не содержит сернистые соединения.
10. Составьте материальный баланс процесса очистки 56000 м3 отходящего газа, содержащего 6,2% 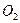 , 93,5%
, 93,5% 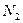 , 0,145%
, 0,145% 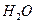 , 0,15%
, 0,15% 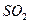 , и 005%
, и 005% 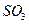 содовым раствором концентрации 5%
содовым раствором концентрации 5% 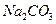 . Коэффициент избытка раствора а =1,5.
. Коэффициент избытка раствора а =1,5.
11. Производительность сернокислотного цеха составляет 43,5 т/час моногидрата (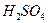 ). Сырьем является колчедан, содержащий 38% серы в составе пирита и пустую породу. Определите массу образующегося огарка, состоящего из пустой породы и магнетита.
). Сырьем является колчедан, содержащий 38% серы в составе пирита и пустую породу. Определите массу образующегося огарка, состоящего из пустой породы и магнетита.
|
|
12. Определите расход раствора известкового молока концентрации 120 г/л для обезвреживания 4500 м3 газа, содержащего 0,2% 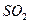 . Коэффициент избытка раствора составляет 1,3 от стехиометрического в расчете на получение сульфита кальция.
. Коэффициент избытка раствора составляет 1,3 от стехиометрического в расчете на получение сульфита кальция.
13. Отходящий газ объемом 98800 м3, содержащий 0,25% 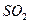 и 0,005% SOз, подвергается кислотно-каталитической очистке. Определите количество раствора серной кислоты, необходимого для улавливания примесей, если исходная концентрация его составляет 20%
и 0,005% SOз, подвергается кислотно-каталитической очистке. Определите количество раствора серной кислоты, необходимого для улавливания примесей, если исходная концентрация его составляет 20% 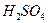 , концентрация вытекающего раствора 22%
, концентрация вытекающего раствора 22% 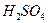 .
.
14. Рассчитаете расход водного раствора серной кислоты концентрации 22% 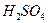 , содержащего ионы Мп3, для каталитической очистки 15000 м3 газа, если в нем содержится 0,15%
, содержащего ионы Мп3, для каталитической очистки 15000 м3 газа, если в нем содержится 0,15% 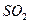 и 0,08% SOз. Концентрация вытекающего из абсорбера раствора составляет 23,5%
и 0,08% SOз. Концентрация вытекающего из абсорбера раствора составляет 23,5% 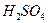 .
.
15. Подберите реагент, его количество, концентрацию для очистки отходящего газа сернокислотного производства мощностью 360000 т/год. Концентрация газа перед окислением составляет 9%, степень окисления 0,98. Рассчитайте также концентрацию 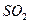 в газе после очистки, если степень очистки газов от
в газе после очистки, если степень очистки газов от 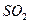 обычно составляет 0,9. Расчет необходимо вести на часовую производительность с учетом эффективного фонда работы основного оборудования.
обычно составляет 0,9. Расчет необходимо вести на часовую производительность с учетом эффективного фонда работы основного оборудования.
16. Определите повышение концентрации раствора серной кислоты при улавливании 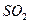 кислотно-каталитическим методом из газа объемом 60000 мз/час, содержащего 0,6%
кислотно-каталитическим методом из газа объемом 60000 мз/час, содержащего 0,6% 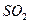 . Количество орошающей кислоты 15
. Количество орошающей кислоты 15 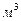 /час, концентрация ее 20%
/час, концентрация ее 20% 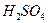 , степень улавливания составляет 0,9.
, степень улавливания составляет 0,9.
17. Рассчитайте расход водного раствора сульфит-бисульфита аммония концентрации 10% (в пересчете на NНз) и массовым соотношением сульфит: бисульфит = 1:1, необходимого для очистки 10000 м3/час газа, содержащего 0,2% сернистого ангидрида.
18. 150 м3 кислых сточных вод сернокислотного производства подаются на станцию нейтрализации. Сточные воды содержат 2 кг/м3 H2SO4 и 0,5 кг/м3 огаркового шлама. Для нейтрализации серной кислоты используют известковое молоко с концентрацией 100 кг/м3 СаО, плотность раствора 1120 кг/м3. Рассчитайте материальный баланс процесса, если сульфит кальция полностью переходит в гипс.
Тема 6: Очистка и утилизация промышленных отходов производства триполифосфата натрия (Na5P 3O10)
Триполифосфат натрия применяется для умягчения хозяйственно-питьевой воды, для обработки промышленных вод, эмульгирования смесей, в кожевенной и пищевой промышленности, в производстве моющих, очищающих и отбеливающих средств.
Триполифосфат натрия (Na5P3O10) существует в двух изомерных кристаллических формах Na5P3O10 – 1, высокотемпературная, и Na5P3O10 – 2, низкотемпературная, дающих идентичные водные растворы и кристаллогидрат Na5P3O10∙ 6 Н2О, но отличающихся теплотой гидратации, гигроскопичностью, скоростью растворения.
Форма Na5P3O10 – 1 известна как комкующаяся, так как при добавлении ее в неперемешиваемую воду, она образует, комки или слипается. Причиной комкования является ее высокая растворимость, что объясняется большей метастабильностью формы 1 при соприкосновении с водой по сравнению с формой 2. Во избежание комкования при растворении формы 1 раствор необходимо интенсивно перемешивать. Форму 2 можно добавлять к воде без перемешивания.
Плотность ТПФН – 2500 кг/м3, насыпная масса – 600-800 кг/м3.
В качестве катализирующего и отбеливающего вещества используются азотная кислота, карбамид, но чаще аммонийная селитра.
В качестве фильтрующего, сорбирующего материала при очистке растворов используют кизельгур или порошок «Арагац», имеющие высокую удельную поверхность и содержание в основном SiO2.
Получение триполифосфата натрия сводится к нейтрализации фосфорной кислоты определенной концентрации кальцинированной содой по суммарному уравнению реакции:
2,5 Na2CO3 +3H3PO4=NaH2PO4+2Na2HPO4+2,5CO2+2,5H2O+ q1
Нейтрализованный раствор очищают от взвесей путем фильтрации, сушат, полученные соли фосфатов натрия подвергают кальцинации, в результате образуется продукт - триполифосфат натрия, согласно суммарной реакции:
NaH2PO4 + 2 Na2HPO4 = Na5P3O10 + 2 H2O - q2
Качество продукта зависит от состава исходного сырья, металлического титра нейтрализованного раствора, температуры и продолжительности нейтрализации и кальцинации и других факторов. Согласно ГОСТ 13493-92 полученный продукт (из термической фосфорной кислоты) должен содержать 92...94% Na5P3O10.
Отделение нейтрализации
73 % фосфорная кислота из цеха производства фосфорной кислоты поступает в хранилища.
Расход кислоты замеряется прибором. Достижение верхнего и нижнего уровней кислоты в хранилище контролируется и сигнализируется приборами.
Проливы из хранилища собираются в приямок, откуда насосом возвращаются в хранилище. Из хранилища насосами кислота подается в напорный бак. Избыток кислоты из напорного бака по переливу возвращается в хранилище. Отсутствие перелива контролируется и сигнализируется прибором.
Из напорного бака кислота самотеком поступает в бак смеситель, снабженный воздушным барботером, где разбавляется до 42- 45 % водой, поступающей из напорного бака.
Избыток воды из напорного бака по переливу поступает в сборник промвод. Отсутствие перелива контролируется и сигнализируется прибором.
Разбавленная кислота самотеком поступает в резервуар разбавленной кислоты. Сюда же поступает 50 % раствор аммиачной селитры, расход которой регулируется приборами.
В сборнике готовится 50 % раствор аммиачной селитры. Для растворения селитры подается горячая умягченная вода.
Из сборника насосами раствор селитры подается в напорный бак, откуда самотеком поступает в сборник нейтрализованного раствора или в емкость разбавленной фосфорной кислоты. Избыток раствора селитры из напорного бака по переливу возвращается в сборник.
Расход раствора селитры контролируется и дистанционно регулируется приборами.
Разбавленная кислота из сборника самотеком подается в нейтрализаторы.
Расход кислоты контролируется приборами.
Сода со склада пневмотранспортом подается в бункер через разгрузители.
Уровни в бункерах сигнализируются приборами. Предусмотрена блокировка работы пневмотранспорта при достижении верхнего уровня в бункерах.
Очистка воздуха от пыли соды осуществляется в циклофильтрах. Очищенный воздух выбрасывается в атмосферу через выхлопную трубу:
диаметром – 700 мм;
высотой – 49500 мм;
количество источников – 2;
суммарный объем отходящих газов – 5,976 м3/ч
температура – 20;
состав выброса от двух источников – 0,4г/сек.
Допустимое количество нормируемых компонентов вредных веществ, сбрасываемых в атмосферу от двух источников, составляет 2,6 т/год. В процессе нейтрализации выделяется углекислый газ СО2 и идет интенсивное испарение воды. Отходящие газы из нейтрализаторов подаются вентилятором на отчистку в абсорбционную колонну с насадкой из колец Рашига и выбрасываются в атмосферу через выхлопную трубу:
диаметром – 800 мм;
высотой – 49500 мм.
количество источников – 1;
суммарный объем отходящих газов – 62,582 м3/ч;
температура – 60.
Состав выброса от одного источника составляет:
пыль соды – 0,62 г/с;
углекислый газ – 416 г/с.
Допустимое количество нормируемых компонентов вредных веществ, сбрасываемых в атмосферу от одного источника, составляет:
пыль соды – 17,39т/год;
углекислый газ – 10500т/год.
|
|
|

Археология об основании Рима: Новые раскопки проясняют и такой острый дискуссионный вопрос, как дата самого возникновения Рима...

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!