Биохимия, ее задачи, значение биохимии для медицины.
Биохимия – наука о структуре химических веществ, входящих в состав животного организма, их превращений и физико-химических процессов, лежащих в основе жизнедеятельности.
Объектами изучения биохимии являются различные живые организмы - вирусы, бактерии, растения, животные и организм человека.
Биохимия состоит из нескольких разделов:
1.) Статическая биохимия изучает химический состав организмов и структуру составляющих их молекул (белков, аминокислот, нуклеиновых кислот, нуклеотидов, углеводов и их производных, липидов, витаминов, гормонов).
2.) Динамическая биохимия изучает химические реакции, представляющие обмен веществ (метаболизм), а именно пути превращения молекул и механизмы происходящих между ними реакций. Простые молекулы и их производные (моносахариды, жирные кислоты, аминокислоты, нуклеотиды и др.), образующиеся в процессе метаболизма, называются метаболитами. Биоэнергетика представляет раздел динамической биохимии, который изучает закономерности образования, аккумуляции и потребления энергии в биологических системах.
3.) Функциональная биохимия изучает биохимические реакции, лежащие в основе физиологических функций. Она изучает биохимические основы переваривания питательных веществ в желудочно-кишечном тракте; механизмы мышечного сокращения, проведения нервного импульса, дыхательной функции крови, регуляции кислотно-щелочного равновесия, функции печени и почек, иммунной системы и др.
4.) Биохимия человека или медицинская биохимия – это раздел биохимии, который изучает закономерности обмена веществ в человеческом организме, в том числе и при заболеваниях. С целью изучения механизмов развития болезней широко используют метод моделирования патологических процессов на животных.
Задачи биохимии:
1) Изучение строения и обмена белков.
2) Изучение строения нуклеиновых кислот.
3) Изучение молекулярных механизмов наследственности.
4) Изучение биологического катализа.
5) Изучение превращения углеводов.
6) Изучение обмена липидов.
7) Изучение роли биологических регуляторов.
8) Изучения значения витаминов.
Задачи в медицине:
1) Выяснить, сущность заболевания.
2) Улучшить эффективность диагностики заболеваний.
3) Обеспечить разработки лекарственных средств.
4) Обосновать основы профилактики.
Значение в медицине.
Основные задачи медицины: патогенез, диагностика, лечение, профилактика заболеваний.
1) Значение БХ для понимания механизма заболевания (пример: сердечно-сосудистые заболевания (атеросклероз). В настоящее время предполагают, что важным является чувствительность рецепторов клеток к ЛПНП).
2) Значение БХ для диагностики заболеваний. Широкое использование биохимических исследований биологических жидкостей (количество субстратов, исследование активности ферментов, исследование уровня гормонов, методы РИА, ИФА. Выявление предзаболеваний).
3) Значение БХ для лечения. Выявление нарушенных звеньев метаболизма, создание соответствующих лекарственных препаратов, широкое использование природных препаратов.
4) Значение БХ для профилактики заболеваний. Пример: недостаток витамина С — цинга—для профилактики витамина С. Недостаток витамина D— рахит—для профилактики витамина D.
Аминокислоты, строение, классификация по химической природе и свойствам боковой цепи. Уровни структурной организации белков. Характеристика связей, стабилизирующих белки. Понятие о доменных белках.
Аминокислотами называют бифункциональные производные углеводородов, которые содержат карбоксильную группу -COOH и аминогруппу -NH2.
Строение. В молекуле аминокислоты к центральному атому углерода (а-углероду) всегда присоединена одна кислотная группа, —СООН (карбоксильная), одна основная —NH2 (аминогруппа) и один атом водорода. Варьирует только остальная часть молекулы — R-группа -радикал аминокислот - в простейшем случае представлен атомом водорода (глицин), но может иметь и более сложное строение.
Общая формула:
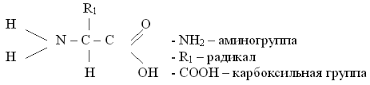
Оксиаминокислоты.
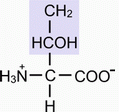
а) Серин (СЕР) - α-амино-β-оксипропионовая кислота
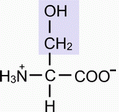
б) Треонин (ТРЕ) - α-амино-β-оксимасляная кислота (боковые радикалы гидрофильные, неионогенные (имеют спиртовую природу)).
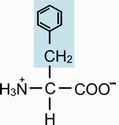
Ароматические аминокислоты.
а) Фенилаланин (ФЕН) - α-амино-β-фенилпропионовая кислота (боковой радикал гидрофобный, неионогенный).
б) Тирозин (ТИР) - α-амино-β-параоксифенилпропионовая кислота (боковой радикал гидрофильный, ионогенный, несёт отрицательный заряд).
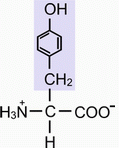
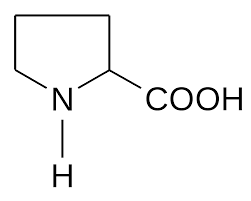
Иминокислоты.
а) Пролин (ПРО) (боковой радикал гидрофобный, неионогенный).
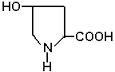
б) Оксипролин (ОПР) (боковой радикал гидрофильный, ионогенный).
Связи в белках.
Пептидная связь – это связь между α-карбоксильной группой одной аминокислоты и α-аминогруппой другой аминокислоты.
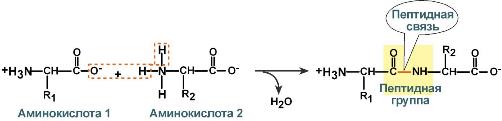
Образование пептидной связи
При необходимости назвать пептид ко всем названиям аминокислот добавляют суффикс "-ил", только последняя аминокислота сохраняет свое название неизменным.
Например, аланил-серил-триптофан или γ-глутаминил-цистеинил-глицин (по-другому называемый глутатион).
Мономеры аминокислот, входящих в состав белков, называют " аминокислотные остатки ". Аминокислотный остаток, имеющий свободную аминогруппу, называется N-концевым и пишется слева, а имеющий свободную карбоксильную группу - С-концевым и пишется справа. Пептиды пишутся и читаются с N-конца. Цепь повторяющихся атомов в полипептидной цепи -NH-CH-CO- носит название " пептидный остов ".
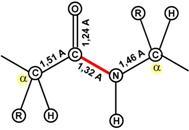
К свойствам пептидной связи относятся:
1.) Копланарность. Все атомы, входящие в пептидную группу находятся в одной плоскости, при этом атомы "Н" и "О" расположены по разные стороны от пептидной связи.
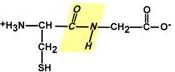
2.) Транс-положение заместителей. Радикалы аминокислот по отношению к оси C-N связи находятся по "разные" стороны, в транс-положении.
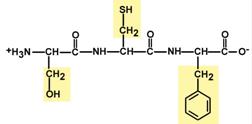
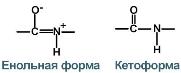
3.) Две равнозначные формы. Пептидная связь имеет кетоформу и енольную форму.
4.) Способность к образованию водородных связей. Атомы углерода и азота, входящие в пептидную связь обладают способностью образовывать две водородные связи с другими пептидными группами.
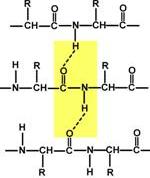
5.) Пептидная связь имеет частично характер двойной связи. Длина пептидной связи меньше, чем одинарной связи, она является жесткой структурой, и вращение вокруг нее затруднено. Но так как, кроме пептидной, в белке есть и другие связи, цепочка аминокислот способна вращаться вокруг основной оси, что придает белкам различную конформацию (пространственное расположение атомов).
Межцепочечные и внутрицепочечные поперечные дисульфидные связи. Дисульфидная связь образуется между двумя остатками цистеина и «сшивает» два участка полипептидной цепи (или цепей), которым принадлежат эти остатки. Эта связь остается стабильной в тех условиях, при которых белок обычно денатурирует. Обработка белка надмуравьиной кислотой (окисляющей связи S-S) или бета-меркаптоэтанолом (восстанавливающим связи S-S с регенерацией двух остатков цистеина) приводит к разделению полипептидных цепей, связанных дисульфидными связями; их первичная структура при этом не затрагивается.
Водородные связи образуются: 1) между группами, входящими в состав боковых цепей и способными к формированию водородных связей; 2) между атомами азота и кислорода, принадлежащими пептидным группам остова; 3) между полярными остатками, расположенными на поверхности молекулы белка, и молекулами воды. Все они играют важную роль в стабилизации вторичной, третичной и т. д. структур белка.
Гидрофобные взаимодействия. Неполярные боковые цепи нейтральных аминокислот в белках имеют тенденцию к ассоциации. Стехиометрические соотношения при этом не соблюдаются, так что никаких связей в обычном смысле не возникает. Тем не менее, эти взаимодействия играют важную роль в поддержании структуры белка.
Электростатические связи. Эти солевые связи возникают между разноименнно заряженными группами, входящими в состав боковых цепей аминокислот. Например, аминогруппа лизина при физиологических рН несет заряд +1, а карбоксильная группа аспартата или глутамата в составе боковой цепи несет заряд -1. Следовательно, эти группы могут электростатически взаимодействовать, стабилизируя структуру белка.
Прочность связей. В ходе денатурации белков (например, при обработке мочевиной или додецилсульфатом натрия в присутствии избытка ионов Н+ и ОН-) водородные и гидрофобные связи, а также связи электростатической природы разрушаются, а пептидные и дисульфидные сохраняются.
Доменные белки содержат в своей структуре домены (структурные участки молекул с третичной структурой). Некоторые домены являются функционально автономными образованиями в составе белковых молекул. Отдельные домены связаны между собой пептидными фрагментами («шарнирными» участками). Примерами доменных белков являются ферменты 7 – глицеральдегидфосфатдегидрогеназа и фосфоглицераткиназа. В их составе отдельные домены реализуют разные этапы сложного каталитического пути.
Аденин (А) Гуанин (Г) Цитозин (Ц) Урацил (У) Тимин (Т)
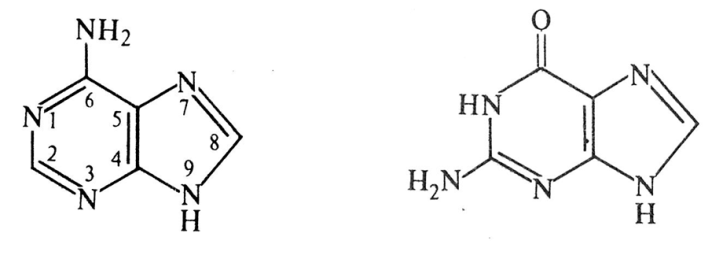
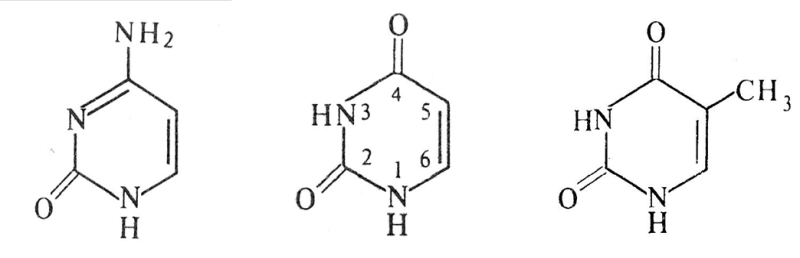
Схема образования нуклеотида.
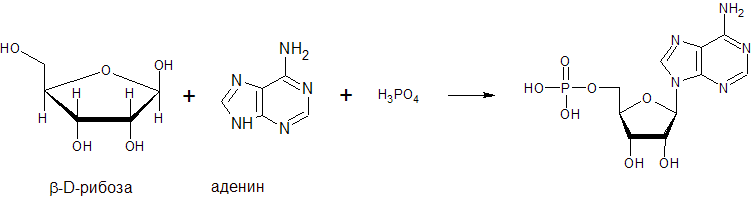
Образуется нуклеотид - адениловая кислота или аденозинмонофосфат (АМФ). Соединение основания и пентозы называют нуклеозидом (аденозин), связь между пентозой и азотистым основанием (β-гликозидная) образована - первым атомом углерода пентозы с первым атомом азота в пиримидиновых нуклеозидах и девятым атомом азота в пуриновых нуклеозидах. Нуклеотиды представляют собой соединения нуклеозидов с фосфорной кислотой (связь сложно – эфирная). В составе РНК и ДНК по 4 аденозин- или нуклеозидмонофосфата (нуклеотида).
Эту схему ещё можно посмотреть на сайте в лекции «Сложные белки» J
Номенклатура нуклеотидов.
Рибонуклеозидмонофосфаты: Дезоксирибонуклеозидмонофосфаты:
1. Аденозинмонофосфат (АМФ), адениловая кислота. 1. д.Аденозинмонофосфат (д.АМФ).
2. Гуанозинмонофосфат (ГМФ), гуаниловая кислота. 2. д.Гуанозинмонофосфат (д.ГМФ).
3. Цитидинмонофосфат (ЦМФ), цитидиловая кислота. 3. д.Цитидинмонофосфат (д.ЦМФ).
4. Уридинмонофосфат (УМФ), уридиловая кислота. 4. д.тимидинмонофосфат (д.ТМФ).
Вторичная структура ДНК.
Особенностью нуклеотидного состава ДНК является то, что число адениловых нуклеотидов равно числу цитидиловых: А=Т, Г=Ц, следовательно, А+Г=Т+Ц, т.е. число пуриновых нуклеотидов равно числу пиримидиновых (правила Чаргаффа). Такие соотношения не свойственны РНК. Исходя из правил Чаргоффа о нуклеотидном составе ДНК и из рентгеноструктурных исследований, Дж. Уотсон и Ф. Крик (Великобритания) предложили модель строения ДНК (1953).
Согласно этой модели молекула ДНК представляет собой двойную спираль, образованную двумя полинуклеотидными цепями, закрученными относительно друг друга и вокруг общей оси. Двойная спираль правозакрученная, полинуклеотидные цепи в ней антипараллельны, т.е. если одна из них ориентирована в направлении 3' 5', то вторая – в направлении 5' 3'. Поэтому на каждом из концов молекулы ДНК расположены 5' – конец одной цепи и 3' – конец другой цепи.
Все основания цепей ДНК (гидрофобные по свойствам) расположены внутри двойной спирали, а пентозы и остатки фосфорной кислоты – снаружи. Полинуклеотидные цепи удерживаются относительно друг друга за счет водородных связей, образующихся за счет специфического взаимодействия между парами комплементарных оснований. Комплементарными являются А и Т, они образуют две водородные связи, а также Г и Ц образуют три водородные связи.
ЦИТОЗИН ГУАНИН ТИМИН АДЕНИН
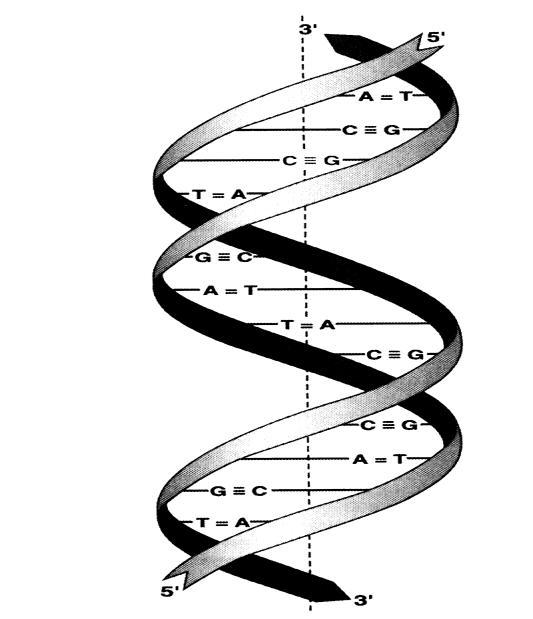 Кроме водородных связей в стабилизации вторичной структуры ДНК участвуют гидрофобные взаимодействия возникающие за счет гидрофобных азотистых оснований, обращенных внутрь спирали. Гидрофобные взаимодействия вносят основной вклад в стабилизацию двойной спирали, больший, чем водородные связи между цепями. Рибозофосфатные связи располагаются по периферии, образуя ковалентный остов спирали.
Кроме водородных связей в стабилизации вторичной структуры ДНК участвуют гидрофобные взаимодействия возникающие за счет гидрофобных азотистых оснований, обращенных внутрь спирали. Гидрофобные взаимодействия вносят основной вклад в стабилизацию двойной спирали, больший, чем водородные связи между цепями. Рибозофосфатные связи располагаются по периферии, образуя ковалентный остов спирали.
Особенности структуры РНК.
Первичная структура РНК аналогична первичной структуре ДНК ипредставляет полинуклеотидную цепь, состоящую из мононуклеотидов, соединенных 3' 5' – фосфодиэфирными связями.
Вторичная структура РНК.
Молекулы РНК построены из одной полинуклеотидной цепи. Отдельные участки цепи РНК образуют спирализованные петли "шпильки", за счет водородных связей между комплементарными азотистыми основаниями А-У и Г-Ц. Участки цепи РНК в таких спирализованных участках антипараллельны, но не всегда полностью комплементарны. Наличие спирализованных участков характерно для всех типов РНК. Такие спирализованные участки содержат небольшое число нуклеотидных пар (до 20-30) и чередуются с неспирализованными участками.
Основные типы РНК.
По особенностям структуры и функциям различают 2 типа рибонуклеиновых кислот – матричные РНК (мРНК) и некодирующие РНК (рибосомальные, транспортные, сплайсосомные, малые ядрышковые и т.д.). Они различаются по первичной структуре, молекулярной массе, конформации, продолжительности жизни и по функциональной активности.
1.) Матричные РНК (мРНК) составляют около 2% от всей РНК клетки. Матричные РНК называются также информационными РНК (иРНК).
2.) Транспортные РНК (тРНК). Пространственную структуру тРНК, независимо от различий в последовательности нуклеотидов, описывают универсальной моделью "клеверного листа". В каждой молекуле тРНК есть участки цепи, не участвующие в образовании водородных связей между нуклеотидными остатками. К ним в частности, относят участок, ответственный за связывание с аминокислотой на 3'-конце молекулы и антикодон – специфический триплет нуклеотидов, взаимодействующий комплементарно с кодоном мРНК. Транспортные РНК составляют около 15% всей РНК клетки, они участвуют в транспорте аминокислот.
3.) Рибосомные РНК (рРНК) – компоненты рибосом. На долю рРНК приходится около 80% всей РНК клетки. 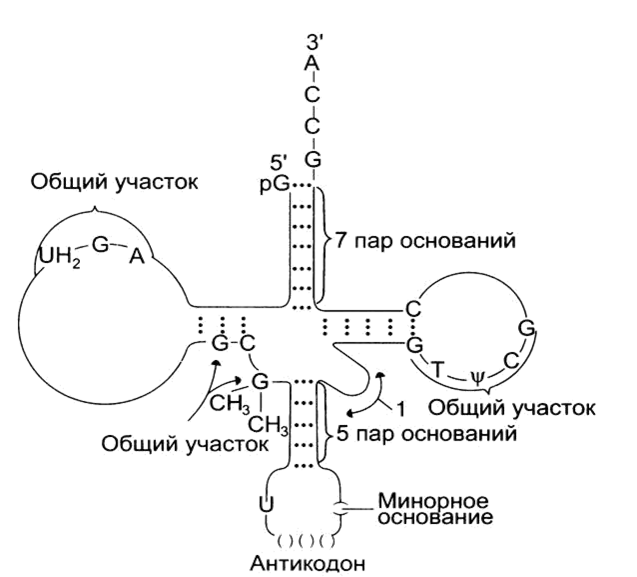
Типы гемоглобинов.
Гемоглобины могут различаться по белковой части. Различают физиологические и аномальные типы гемоглобинов. Физиологические типы образуются на разных этапах нормального развития организма, а аномальные - вследствие нарушения последовательности аминокислот в белке глобине физиологических типов гемоглобина.
Физиологические типы гемоглобинов отличаются друг от друга набором полипептидных цепей или субъединиц, образующихся на разных этапах развития организма человека – от эмбрионального до взрослого состояния. Различаются следующие физиологические типы гемоглобинов:
а) Примитивный НвР, появляется на самых ранних стадиях развития эмбриона (1 – 2 недели) Эмбриональный гемоглобин – тетрамер (2α,2ε);
б) Фетальный гемоглобин НвF (от лат. Fetus – плод). НвF является главным типом гемоглобина плода и составляет к моменту рождения 70% всего гемоглобина – это тетрамер (2α, 2γ);
в) Гемоглобин взрослого НвА, НвА2, НвА3 (от лат. Adultus – взрослый). НвА появляется на более поздних стадиях развития плода, в крови взрослого человека примерно 95 – 96% НвА – это тетрамер (2α, 2β). Гемоглобин А2 – тетрамер (2α, 2σ). Его содержание в эритроцитах взрослого человека равно 2%.
Аномальные гемоглобины. Их обнаружено более 200 и отличаются они составом цепей или заменой аминокислот в полипептидных цепях. Из аномальных гемоглобинов часто встречается HвS или серповидно-клеточный Нв. Он обнаруживается у больных серповидно-клеточной анемией. Это широко распространенное заболевание в странах Южной Америки, Африки и Юго-Восточной Азии. При этой патологии эритроциты в условиях низкого парциального давления кислорода принимают форму серпа. Гемоглобин S отличается по ряду свойств от нормального гемоглобина. После отдачи кислорода в тканях он превращается в плохо растворимую форму и начинает выпадать в осадок в виде веретенообразных кристаллоидов. Последние деформируют клетку и приводят к массивному гемолизу.
Химический дефект при серповидно-клеточной анемии сводится к замене в белке одной аминокислоты на другую. В норме в - субъединицах тетрамерной структуры гемоглобина в шестом положении со стороны N – конца находится глутаминовая аминокислота, боковая группа которой имеет отрицательный заряд и характеризуется высокой гидрофильностью. При серповидно-клеточной анемии глутаминовая аминокислота заменена на гидрофобную аминокислоту – валин. Однако одной этой замены оказалось достаточно не только для нарушения формы эритроцита, но и для развития болезни.
Миоглобин также относится к хромопротеинам. Это белок, имеющий третичную структуру. Вторичная и третичная структура миоглобина и протомеров гемоглобина очень сходны. Функции миоглобина и гемоглобина одинаковы. Оба белка участвуют в транспорте кислорода. Гемоглобин присоединяет кислород из альвеолярного воздуха и доставляет его в ткани. Миоглобин присоединяет кислород, доставленный гемоглобином и служит промежуточным звеном в транспорте кислорода внутри клетки к митохондриям, а также для запасания кислорода в тканях, создавая кислородный резерв, который расходуется по мере необходимости. В условиях интенсивной мышечной работы, когда парциальное давление кислорода в тканях падает, кислород освобождается из комплекса с миоглобином и используется в митохондриях клеток для получения энергии, необходимой для работы мышц.
Протеогликаны.
Это углевод-белковые комплексы, углеводный компонент которых представлен гетерополисахаридами, построенными из большого числа повторяющихся единиц. В отличие от гликопротеинов, которые содержат только несколько процентов углеводов (по массе), протеогликаны могут содержать до 95 % и более углеводов. Кроме того, по свойствам они ближе к углеводам, чем к белкам. Белки в протеогликанах представлены одной полипептидной цепью разной молекулярной массы.
|
| CООН
|
|
|
|
| |
|
|
|
|
| |
| O
|
|
| H
| H
|
| OH
|
| 4 |
|
|
| | 1
|
| |
|
|
| |
|
| НО
| OH
| H
| H
|
|
| |
| |
|
|
|
| |
| |
|
|
|
| H
| ОH
|
|
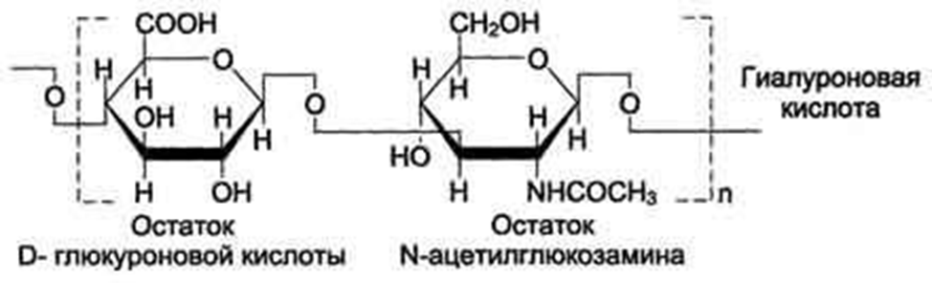
В состав протеогликанов входят кислые гетерополисахариды (гликозамингликаны) линейного строения. Они построены из повторяющихся дисахаридных единиц – димеров. Одним из компонентов этих димеров является D-глюкуроновая кислота.
В составе протеогликанов содержатся следующие гетерополисахариды: гиалуроновая кислота, хондроитинсульфаты, гепарин, кератансульфаты, гепарансульфаты, дерматансульфаты. Гиалуроновая кислота состоит из повторяющихся единиц (димеров) включающих D-глюкуроновую кислоту и N-ацетилглюкозамин.
 D-глюкуроновая кислота D-глюкуроновая кислота
|
 Хондроитинсульфаты
Хондроитинсульфаты содержат структурные единицы из глюкуроновый кислоты и сульфатированного N-ацетилгалактозамина.
Протеогликаны являются обязательными компонентами межклеточного матрикса, играют важную роль в межклеточных взаимодействиях, формировании и поддержании формы клеток и органов, образовании каркаса при формировании тканей.
Благодаря особенностям структуры и физико-химическим свойствам протеогликаны выполняют в организме следующие функции:
- являются структурными компонентами межклеточного матрикса;
- являясь поликатионами они могут присоединять, кроме воды большие количества катионов (Na+, K+, Ca2+) и таким образом участвовать в формировании тургора различных тканей;
- протеогликаны играют роль молекулярного сита в межклеточном матриксе и препятствуют распространению патогенных микроорганизмов.
Эта группа полисахаридов представляет собой сильно гидратированные, желеподобные, липкие вещества, имеющие значительный отрицательный заряд. Все они находятся в межклеточном веществе, но не в свободном состоянии, а связаны с белками. Такие смешанные макромолекулы называются протеогликанами, поскольку основные свойства этих макромолекул определяются углеводной, а не белковой частью. Схема строения протеогликана:

8. Классификация сложных белков. Липид-белковые комплексы, биологическая роль. Особенности строения структурных протеолипидов и свободных липопротеинов.
Это комплексы белков с липидными компонентами, их условно подразделяют на две группы:
1.) Свободные липопротеины. Липопротеины плазмы крови, молока, растворимы в воде.
2.) Структурные протеолипиды. Входят в состав биомембран, растворимы в жирах.
Липид – белковые комплексы в качестве небелковой части содержат липидные компоненты.
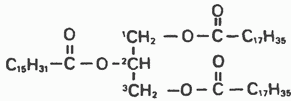
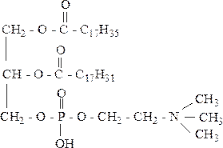
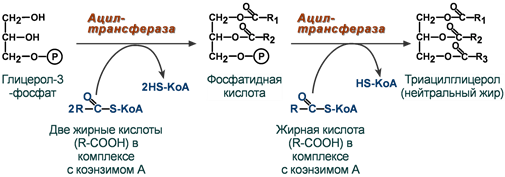
Триацилглицеролы (ТГ) (только в последнем Фосфолипиды (ФЛ) – фосфатидилэтаноламин (ФЭА) нижнем радикале не 35, а 33) (только во втором радикале не 31, а 33)
Высшие жирные кислоты:
С17Н35СООН – стеариновая
С15Н31СООН – пальмитиновая
С17Н33СООН – олеиновая
С17Н31СООН – линолевая
С17Н29СООН – линоленовая
С19Н29СООН – арахидоновая
1.) Свободные липопротеины. Содержатся в плазме крови, все они имеют разную плотность (от 0,92 до 1,21 кг/л) благодаря липидному компоненту. В крови человека присутствуют несколько фракций ЛП, отличающихся по плотности, что связано с различным соотношением липидного и белкового компонента в молекуле.
Фракции ЛП:
А) Хиломикроны (ХМ). Это самая низкая по плотности фракция, т.к. в составе их преобладают липидные комплексы и на долю белка приходится до 2 %. Плотность 0,95 кг/л. Хиломикроны появляются в сыворотке крови после приема жирной пищи;
Б) Липопротеины очень низкой плотности (ЛПОНП) или пре-β-липопротеины, их плотность 0,94 – 1,006 кг/л;
В) Липопротеины низкой плотности (ЛПНП) или β-липопротеины. Плотность их 1,006 – 1,063 кг/л;
Г) Липопротеины высокой плотности (ЛПВП) или α-липопротеины. Плотность их 1,063 – 1,210 кг/л. В составе их преобладает белковый компонент.
Роль свободных (плазменных) липопротеинов.
Свободные ЛП играют транспортную роль, поэтому их называют - транспортными формами липидов. Благодаря своей растворимости в водной среде они могут переносить липиды, поступающие в кровь при всасывании из кишечника, а также распределять липиды между тканями, одни из которых их синтезируют, а другие используют.
ЛП переносят триацилглицеролы, фосфолипиды, стероиды, а также небольшое количество жирорастворимых витаминов, β-каротина.
В настоящее время доказана роль фракций липопротеинов в патогенезе атеросклероза – они называются атерогенными ЛП. К ним относятся ЛПНП и ЛПОНП, а фракцию ЛПВП называют антиатерогенной, так как её увеличение препятствует развитию атеросклероза.
2.) Структурные липопротеины (протеолипиды). Они входят в состав биологических мембран и растворяются в неполярных растворителях (хлороформ, метанол). Причина такого поведения протеолипидов в том, что белок составляет сердцевину их молекулы, а оболочку образует липидный компонент. Содержание белка в протеолипидах 65 – 85 %. Они обнаружены в сердце, почках, легких, скелетных мышцах. В клетках перечисленных органов они представляют основу биологических мембран, образуя двойной липидный слой, в формировании которого участвуют фосфо- и гликолипиды. Состав протеолипидов в различных органах неодинаков.
Специфичность действия
| • абсолютная; • групповая; • стереоспецифичность.
|
| • обеспечивается каталитическим участком; • происходит выбор пути превращения субстрата.
|
 Пример абсолютной субстратной специфичности: Каталитическая специфичность:
Пример абсолютной субстратной специфичности: Каталитическая специфичность:
| (посмотрите ещё один пример в своих тетрадях с лекциямиJ)
|
| Групповая специфичность – действие нескольких субстратов одного класса.
|
| Зависимость скорости реакции от рН среды:
|
Термолабильность: 
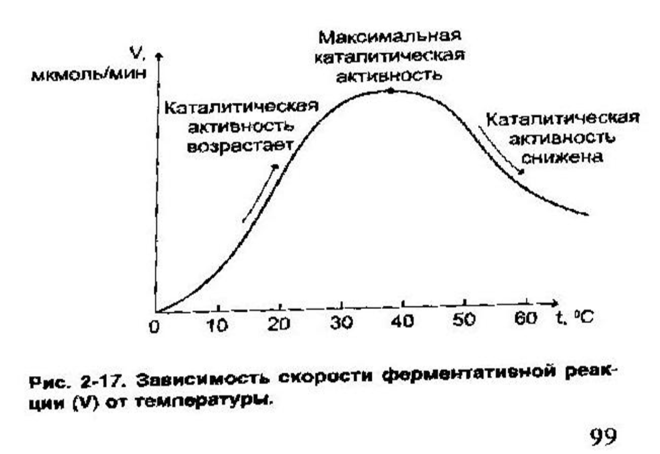
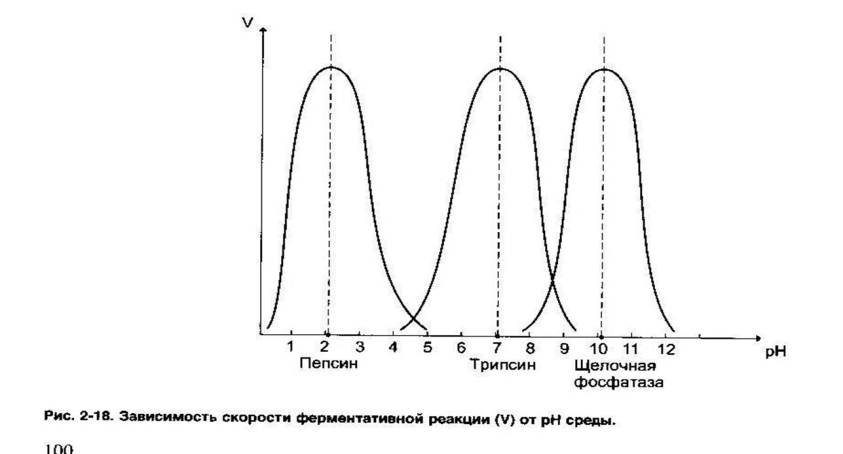 10. Коферменты, классификация, функции в ферментативных реакциях, примеры реакций.
10. Коферменты, классификация, функции в ферментативных реакциях, примеры реакций.
Коферменты, или коэнзимы — малые молекулы небелковой природы, специфически соединяющиеся с соответствующими белками, называемыми апоферментами, и играющие роль активного центра или простетической группы молекулы фермента.
Коферменты
| 1.) Нуклеотиды; 2.) Производные порфирина; 3.) Глутатион.
|
| 1.) Тиаминовые; 2.) Флавиновые; 3.) Пантотеновые; 4.) Никотинамидные; 5.) Пиридоксиновые.
|
Тиаминовые коферменты: • Производные витамина B1 (тиамина); • Участвуют в реакциях декарбоксилирования кетокислот (входят в состав пируватдегидрогеназного и α-кетоглутаратдегидрогеназного комплексов); • Являются коферментами транскетолаз (неокислительная стадия пентозофосфатного пути распада глюкозы); • Основной представитель тиаминдифосфат (ТДФ).
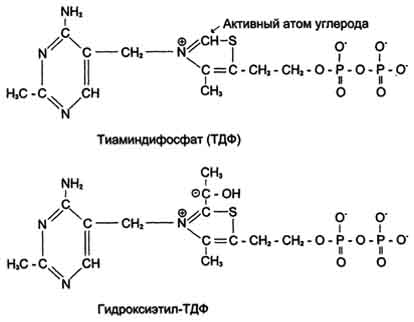

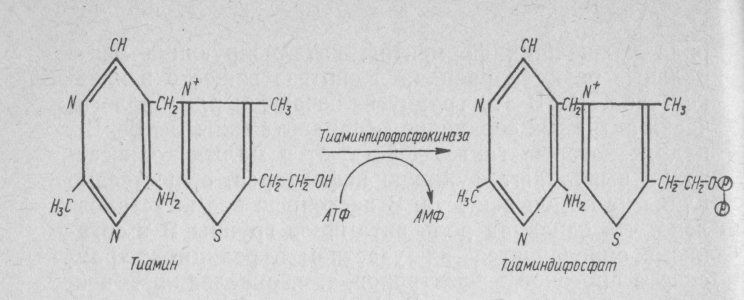
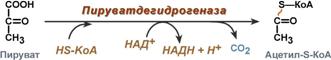
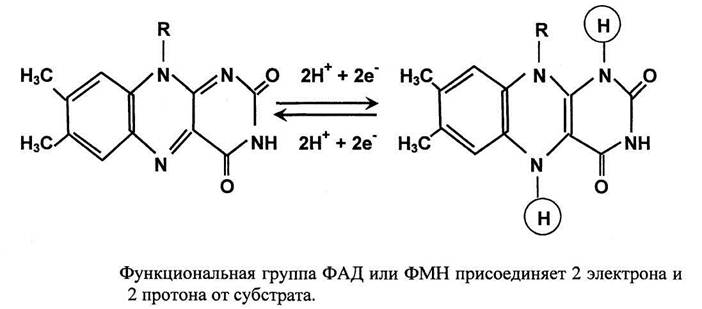
Флавиновые коферменты: •Производные витамина B2 (рибофлавина); • ФМН – флавинмононуклеотид; • ФАД – флавинадениндинуклеотид; • Могут быть в окисленной и восстановленной формах; • Коферменты дегидрогеназ.
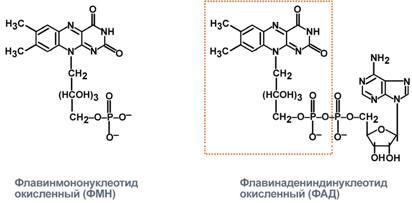


Никотинамидные коферменты: • Производные витамина РР (никотинамид); • НАД (никотинамидадениндинуклеотид); • НАДФ (никотинамидадениндинуклеотидфосфат); • Коферменты могут быть в окисленной и восстановленной формах; • НАД и НАДФ связаны с ферментами дегидрогеназами, которые участвуют в окислительно-восстановительных реакциях.
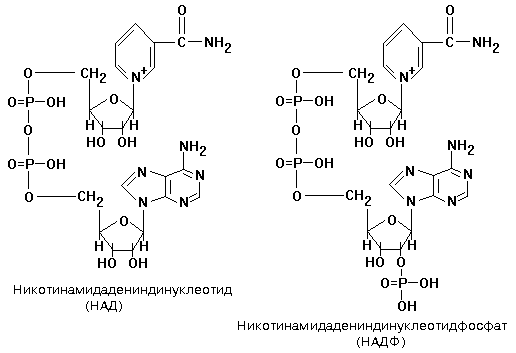
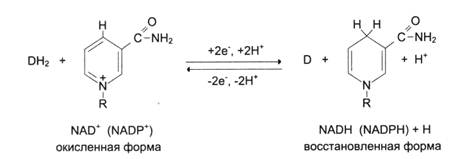
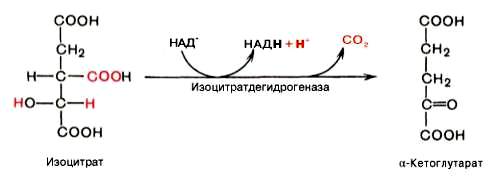
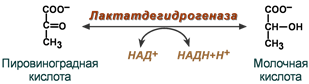
Пантотеновые коферменты: • Производные витамина B5 (пантотеновая кислота); • Основной представитель – кофермент А; Участвует: • В переносе кислотных остатков; • Синтезе холестерола и кетоновых тел; • Активации жирных кислот; • Обезвреживании ксенобиотиков.
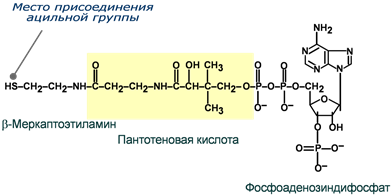
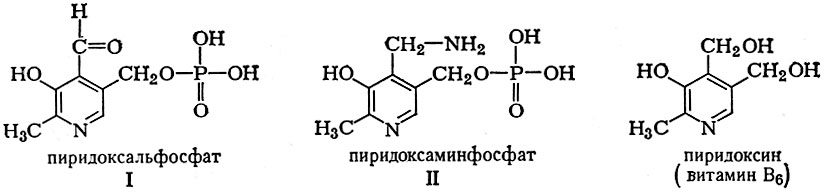
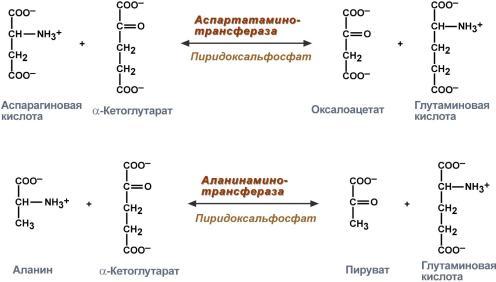
Пиридоксиновые коферменты: • Производные витамина В6 (пиридоксин); • Кофермент – пиридоксальфосфат; Участвует в: • Реакциях переаминирования (трансаминирование). Связан с ферментами аминотрансферазами; • Реакциях декарбоксилирования аминокислот.
11. Классификация и номенклатура ферментов. Характеристика ферментов первого и второго классов, примеры реакций.
Номенклатура ферментов.
Существует несколько способов назвать фермент.
1. Тривиальная номенклатура. У многих ферментов есть название, которое сложилось исторически. Такое название можно легко запомнить, если вы знаете происхождение слова и характерную особенность фермента, связанную с этим словом. Оно не отражает ни название субстрата, ни тип катализируемой реакции. Пример: пепсин (от греч. pepsine - пищеварение), цитохромы – от лат. citos- клетка, croma-цвет).
2. Рабочая номенклатура. Удобно пользоваться рабочим названием фермента, которое составляется путем прибавления к корню слова (латинского, греческого или химического названия субстрата, на который действует фермент), или к названию процесса, катализируемого данным ферментом окончания -аза. Вещество, имеющее это окончание, принимают за фермент. Ферменты, действующие на крахмал (amylum), сахарозу, мочевину (urea), пептиды получили соответственно названия: амилаза, сахараза, уреаза, пептидаза; ферменты, катализирующие процессы гидролиза называют гидролазами, процессы окисления - оксидазами, перенос групп - трнсферазами и т.д. Название S + тип превращения + окончание «аза». Пример: лактатдегидрогеназа. Рабочим названием фермента пользуются в повседневной практике.
3. Систематическая номенклатура. Более полная характеристика фермента отражена в его систематическом названии. Название S: донор или акцептор (второй S) – класс фермента Но на практике пользоваться таким названием не удобно, поэтому в тех случаях, когда фермент имеет длинное или труднопроизносимое систематическое название, можно пользоваться его тривиальным или рабочим названием. Например, рабочее название фермента АТФ: гексоза-6-фосфотрансфераза - гексокиназа.
4. Шифр. Кроме того, каждому ферменту присвоен четырехзначный классификационный номер, включающий класс, подкласс, подподкласс и порядковый номер в подподклассе, согласно положению фермента в Международной классификации. Например, алкогольдегидрогеназа имеет номер 1.1.1.1. – это оксидоредуктаза, действует на ОН-группу донора с НАД в качестве акцептора, имеет первый порядковый номер в своем подподклассе.
Классификация ферментов.
Схема номенклатуры и классификации ферментов была впервые разработана в 1955 году, когда Международный конгресс биохимиков в Брюсселе учредил Комиссию по ферментам (Enzyme Commission). Первая версия номенклатуры появилась в 1961 году на заседании международной комиссии в Москве и включала около 900 ферментов, версия 1995 года содержит более 2000 ферментов. Согласно рекомендациям Международной комиссии по ферментам, было выделено 6 классов. В основе деления на классы - тип катализируемой реакции. Номер закреплен за классом.
1 - ОКСИДОРЕДУКТАЗЫ. 2 - ТРАНСФЕРАЗЫ. 3 - ГИДРОЛАЗЫ. 4 - ЛИАЗЫ. 5 - ИЗОМЕРАЗЫ. 6 - ЛИГАЗЫ.
 Каждый класс делится на подклассы. Они уточняют действие ферментов и указывают на химическую природу группы, которую атакует фермент. Подклассы делятся на подподклассы, которые ещё более конкретизируют действие ферментов, указывают на связь в молекуле субстрата, которая подвергается действию фермента. Подподкласс может указывать на химическую природу акцептора.
Каждый класс делится на подклассы. Они уточняют действие ферментов и указывают на химическую природу группы, которую атакует фермент. Подклассы делятся на подподклассы, которые ещё более конкретизируют действие ферментов, указывают на связь в молекуле субстрата, которая подвергается действию фермента. Подподкласс может указывать на химическую природу акцептора.
Оксидоредуктазы.
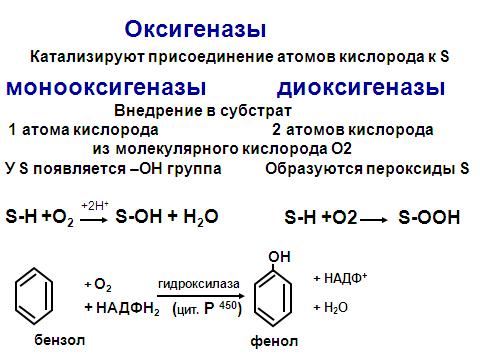
Ферменты этого класса участвуют в ОВР (окислительно-восстановительные реакции), т.е. в реакциях транспорта электронов и протонов. Это наиболее многочисленный класс ферментов: насчитывается более 400 оксиредуктаз. Выделяют 22 подкласса. Подклассы оксидоредуктаз в основном выделяются по типу донора (их можно посмотреть на сайте в лекции «Номенклатура и классификация ферментов»J) Основные подклассы: • дегидрогеназы; • оксидазы; • оксигеназы (гидороксилазы).
Подподклассы оксидоредуктаз в основном выделяют по типу акцептора. Коферментами этого класса являются НАД, НАДФ, ФАД, ФМН, убихинон, гем, глутатион, липоевая кислота, витамин С.
Международная классификация оксидоредуктаз очень громоздкая, поэтому на практике пользуются рабочей классификацией, согласно которой выделяют следующие подклассы оксидоредуктаз:

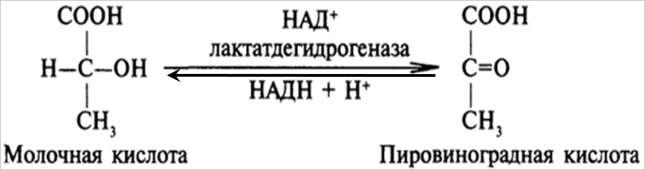 Дегидрогеназы – катализируют дегидрирование субстрата с использованием в качестве акцептора водорода любых молекул, кроме кислорода. Среди них флавинзависимые и никотиамидзависимые ферменты.
Дегидрогеназы – катализируют дегидрирование субстрата с использованием в качестве акцептора водорода любых молекул, кроме кислорода. Среди них флавинзависимые и никотиамидзависимые ферменты.

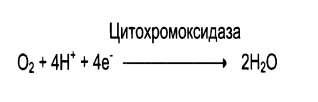
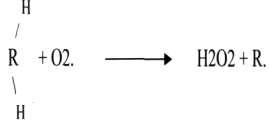 Оксидазы – катализируют окисление субстрата с молекулярным кислородом в качествеакцептора электронов без включения кислорода в молекулу субстрата. Примеры: цитохромоксидаза, ксантиоксидаза, аминооксидазы.
Оксидазы – катализируют окисление субстрата с молекулярным кислородом в качествеакцептора электронов без включения кислорода в молекулу субстрата. Примеры: цитохромоксидаза, ксантиоксидаза, аминооксидазы.
 В реакции всегда образуется пероксид водорода или вода.
В реакции всегда образуется пероксид водорода или вода.
Пероксидазы – катализируют реакции с пероксидом водорода в качестве акцептора электронов. Это группа ферментов, которые отнимают электроны от окисляемого субстрата и транспортируют его на пероксид.

Каталаза катализирует разложение Н2О2 до Н2О и молекулярного О2. 
Редуктазы – катализируют реакции, связанные с транспортом протонов и электронов от кофермента на субстрат. Чаще донором протонов является НАДФ2. Синтез ВЖК, холестерина.

|
|
|





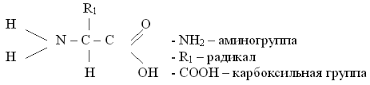















 Кроме водородных связей в стабилизации вторичной структуры ДНК участвуют гидрофобные взаимодействия возникающие за счет гидрофобных азотистых оснований, обращенных внутрь спирали. Гидрофобные взаимодействия вносят основной вклад в стабилизацию двойной спирали, больший, чем водородные связи между цепями. Рибозофосфатные связи располагаются по периферии, образуя ковалентный остов спирали.
Кроме водородных связей в стабилизации вторичной структуры ДНК участвуют гидрофобные взаимодействия возникающие за счет гидрофобных азотистых оснований, обращенных внутрь спирали. Гидрофобные взаимодействия вносят основной вклад в стабилизацию двойной спирали, больший, чем водородные связи между цепями. Рибозофосфатные связи располагаются по периферии, образуя ковалентный остов спирали.
 D-глюкуроновая кислота
D-глюкуроновая кислота



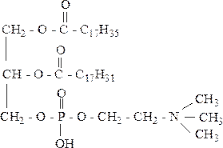

 Пример абсолютной субстратной специфичности: Каталитическая специфичность:
Пример абсолютной субстратной специфичности: Каталитическая специфичность:

 10. Коферменты, классификация, функции в ферментативных реакциях, примеры реакций.
10. Коферменты, классификация, функции в ферментативных реакциях, примеры реакций.







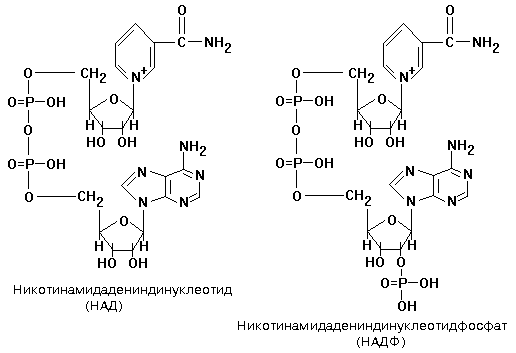







 Каждый класс делится на подклассы. Они уточняют действие ферментов и указывают на химическую природу группы, которую атакует фермент. Подклассы делятся на подподклассы, которые ещё более конкретизируют действие ферментов, указывают на связь в молекуле субстрата, которая подвергается действию фермента. Подподкласс может указывать на химическую природу акцептора.
Каждый класс делится на подклассы. Они уточняют действие ферментов и указывают на химическую природу группы, которую атакует фермент. Подклассы делятся на подподклассы, которые ещё более конкретизируют действие ферментов, указывают на связь в молекуле субстрата, которая подвергается действию фермента. Подподкласс может указывать на химическую природу акцептора.
 Дегидрогеназы – катализируют дегидрирование субстрата с использованием в качестве акцептора водорода любых молекул, кроме кислорода. Среди них флавинзависимые и никотиамидзависимые ферменты.
Дегидрогеназы – катализируют дегидрирование субстрата с использованием в качестве акцептора водорода любых молекул, кроме кислорода. Среди них флавинзависимые и никотиамидзависимые ферменты.
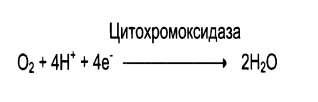
 Оксидазы – катализируют окисление субстрата с молекулярным кислородом в качествеакцептора электронов без включения кислорода в молекулу субстрата. Примеры: цитохромоксидаза, ксантиоксидаза, аминооксидазы.
Оксидазы – катализируют окисление субстрата с молекулярным кислородом в качествеакцептора электронов без включения кислорода в молекулу субстрата. Примеры: цитохромоксидаза, ксантиоксидаза, аминооксидазы. В реакции всегда образуется пероксид водорода или вода.
В реакции всегда образуется пероксид водорода или вода.




