Ферменты – это биологические катализаторы белковой природы, ускоряющие химические реакции.
Рибозимы - биокатализаторы, по химической природе РНК. Катализируют разрыв фосфодиэфирных связей нуклеиновых кислот, имеют не все структуры белков.
Ферменты – глобулярные, во всех имеется активный центр, связывающий субстраты и их превращение.
Активный центр
Общие черты ферментов и небиологических катализаторов:
• Повышают скорость реакции; • В реакциях не расходуются; • Для обратимых процессов и прямая, и обратная реакция катализируется одним и тем же ферментом.
Отличительные признаки ферментов:
| Сложные (белковая и небелковая части – холоферменты)
|
1.) Ферменты обладают более высокой эффективностью действия (повышают скорость реакции в большее число раз, чем неорганические катализаторы). 2.) Ферменты чувствительны к температуре (термолабильны). 3.) Ферменты чувствительны к значениям рН среды. 4.) Ферменты, в отличие от неорганических катализаторов, обладают высокой специфичностью действия. 5.) Ферменты - это катализаторы с регулируемой активностью.
Ферменты
| Простые (из аминокислот (АК))
|
Свойства ферментов: • Высокая каталитическая активность; • Специфичность действия; • Термолабильность; • Чувствительность к изменению рН среды; • Регулируемая активность.
Специфичность действия
| • абсолютная; • групповая; • стереоспецифичность.
|
| • обеспечивается каталитическим участком; • происходит выбор пути превращения субстрата.
|
 Пример абсолютной субстратной специфичности: Каталитическая специфичность:
Пример абсолютной субстратной специфичности: Каталитическая специфичность:
| (посмотрите ещё один пример в своих тетрадях с лекциямиJ)
|
| Групповая специфичность – действие нескольких субстратов одного класса.
|
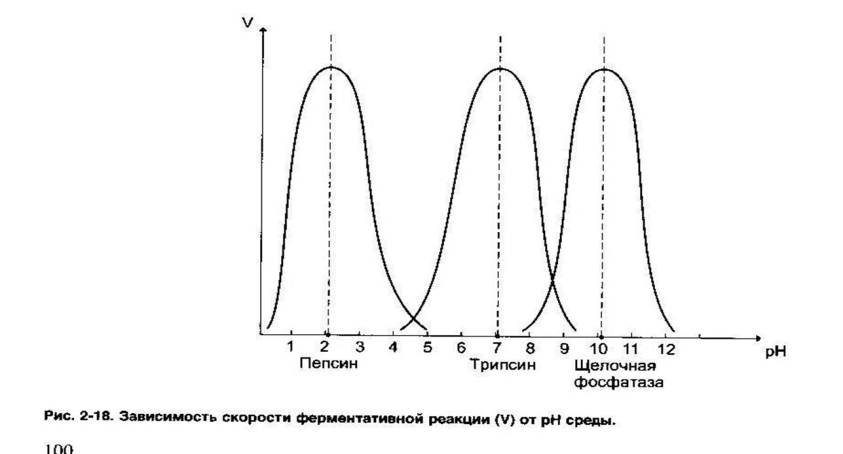
| Зависимость скорости реакции от рН среды:
|
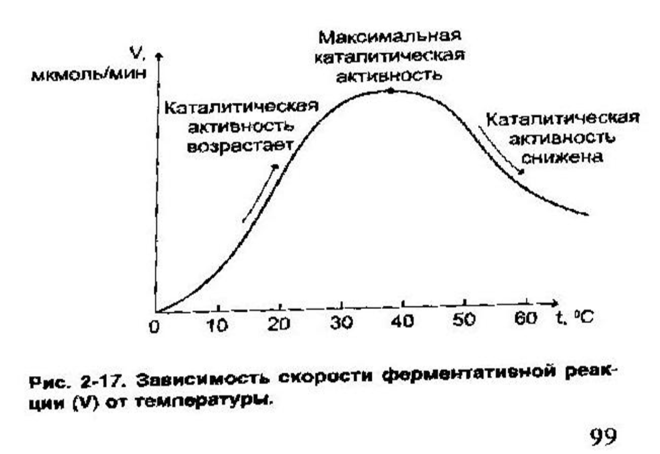
Термолабильность: 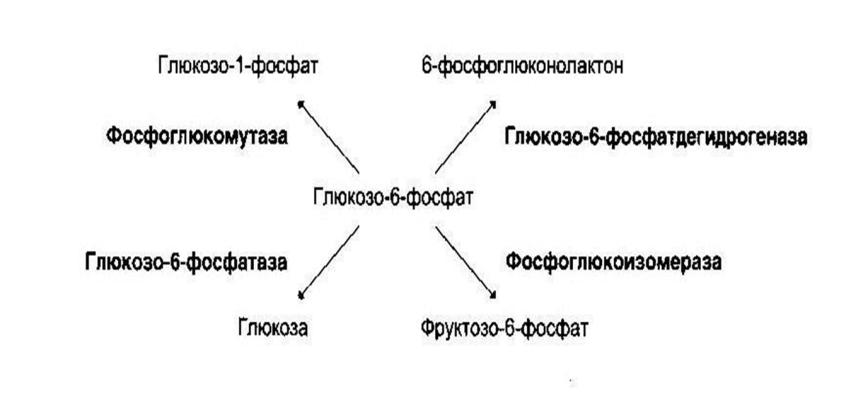
 10. Коферменты, классификация, функции в ферментативных реакциях, примеры реакций.
10. Коферменты, классификация, функции в ферментативных реакциях, примеры реакций.
Коферменты, или коэнзимы — малые молекулы небелковой природы, специфически соединяющиеся с соответствующими белками, называемыми апоферментами, и играющие роль активного центра или простетической группы молекулы фермента.
Коферменты
| 1.) Нуклеотиды; 2.) Производные порфирина; 3.) Глутатион.
|
| 1.) Тиаминовые; 2.) Флавиновые; 3.) Пантотеновые; 4.) Никотинамидные; 5.) Пиридоксиновые.
|
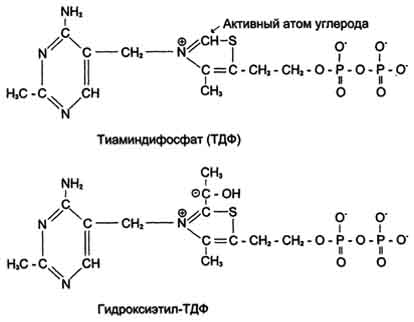
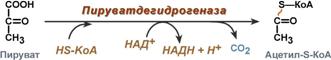
Тиаминовые коферменты: • Производные витамина B1 (тиамина); • Участвуют в реакциях декарбоксилирования кетокислот (входят в состав пируватдегидрогеназного и α-кетоглутаратдегидрогеназного комплексов); • Являются коферментами транскетолаз (неокислительная стадия пентозофосфатного пути распада глюкозы); • Основной представитель тиаминдифосфат (ТДФ).

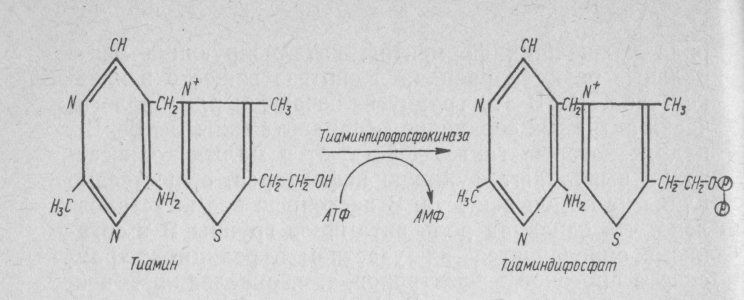
Флавиновые коферменты: •Производные витамина B2 (рибофлавина); • ФМН – флавинмононуклеотид; • ФАД – флавинадениндинуклеотид; • Могут быть в окисленной и восстановленной формах; • Коферменты дегидрогеназ.
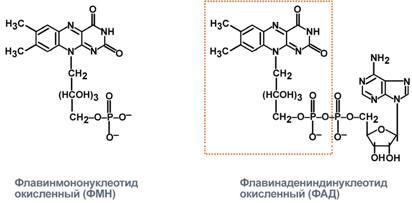
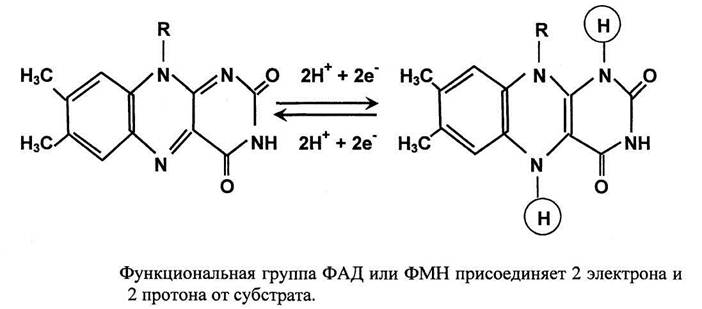


Никотинамидные коферменты: • Производные витамина РР (никотинамид); • НАД (никотинамидадениндинуклеотид); • НАДФ (никотинамидадениндинуклеотидфосфат); • Коферменты могут быть в окисленной и восстановленной формах; • НАД и НАДФ связаны с ферментами дегидрогеназами, которые участвуют в окислительно-восстановительных реакциях.
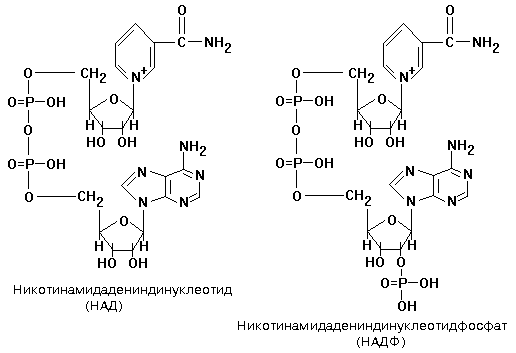
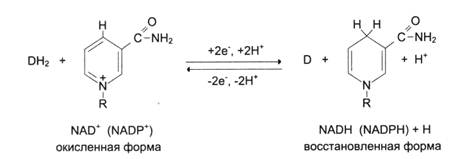
Пантотеновые коферменты: • Производные витамина B5 (пантотеновая кислота); • Основной представитель – кофермент А; Участвует: • В переносе кислотных остатков; • Синтезе холестерола и кетоновых тел; • Активации жирных кислот; • Обезвреживании ксенобиотиков.
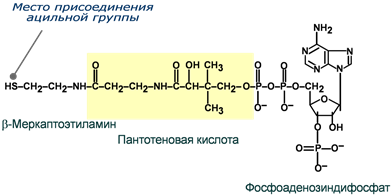
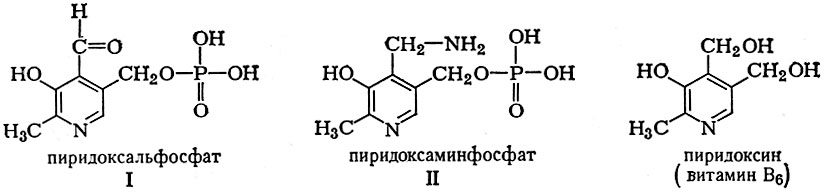
Пиридоксиновые коферменты: • Производные витамина В6 (пиридоксин); • Кофермент – пиридоксальфосфат; Участвует в: • Реакциях переаминирования (трансаминирование). Связан с ферментами аминотрансферазами; • Реакциях декарбоксилирования аминокислот.
11. Классификация и номенклатура ферментов. Характеристика ферментов первого и второго классов, примеры реакций.
Номенклатура ферментов.
Существует несколько способов назвать фермент.
1. Тривиальная номенклатура. У многих ферментов есть название, которое сложилось исторически. Такое название можно легко запомнить, если вы знаете происхождение слова и характерную особенность фермента, связанную с этим словом. Оно не отражает ни название субстрата, ни тип катализируемой реакции. Пример: пепсин (от греч. pepsine - пищеварение), цитохромы – от лат. citos- клетка, croma-цвет).
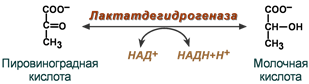
2. Рабочая номенклатура. Удобно пользоваться рабочим названием фермента, которое составляется путем прибавления к корню слова (латинского, греческого или химического названия субстрата, на который действует фермент), или к названию процесса, катализируемого данным ферментом окончания -аза. Вещество, имеющее это окончание, принимают за фермент. Ферменты, действующие на крахмал (amylum), сахарозу, мочевину (urea), пептиды получили соответственно названия: амилаза, сахараза, уреаза, пептидаза; ферменты, катализирующие процессы гидролиза называют гидролазами, процессы окисления - оксидазами, перенос групп - трнсферазами и т.д. Название S + тип превращения + окончание «аза». Пример: лактатдегидрогеназа. Рабочим названием фермента пользуются в повседневной практике.
3. Систематическая номенклатура. Более полная характеристика фермента отражена в его систематическом названии. Название S: донор или акцептор (второй S) – класс фермента Но на практике пользоваться таким названием не удобно, поэтому в тех случаях, когда фермент имеет длинное или труднопроизносимое систематическое название, можно пользоваться его тривиальным или рабочим названием. Например, рабочее название фермента АТФ: гексоза-6-фосфотрансфераза - гексокиназа.
4. Шифр. Кроме того, каждому ферменту присвоен четырехзначный классификационный номер, включающий класс, подкласс, подподкласс и порядковый номер в подподклассе, согласно положению фермента в Международной классификации. Например, алкогольдегидрогеназа имеет номер 1.1.1.1. – это оксидоредуктаза, действует на ОН-группу донора с НАД в качестве акцептора, имеет первый порядковый номер в своем подподклассе.
Классификация ферментов.
Схема номенклатуры и классификации ферментов была впервые разработана в 1955 году, когда Международный конгресс биохимиков в Брюсселе учредил Комиссию по ферментам (Enzyme Commission). Первая версия номенклатуры появилась в 1961 году на заседании международной комиссии в Москве и включала около 900 ферментов, версия 1995 года содержит более 2000 ферментов. Согласно рекомендациям Международной комиссии по ферментам, было выделено 6 классов. В основе деления на классы - тип катализируемой реакции. Номер закреплен за классом.
1 - ОКСИДОРЕДУКТАЗЫ. 2 - ТРАНСФЕРАЗЫ. 3 - ГИДРОЛАЗЫ. 4 - ЛИАЗЫ. 5 - ИЗОМЕРАЗЫ. 6 - ЛИГАЗЫ.
 Каждый класс делится на подклассы. Они уточняют действие ферментов и указывают на химическую природу группы, которую атакует фермент. Подклассы делятся на подподклассы, которые ещё более конкретизируют действие ферментов, указывают на связь в молекуле субстрата, которая подвергается действию фермента. Подподкласс может указывать на химическую природу акцептора.
Каждый класс делится на подклассы. Они уточняют действие ферментов и указывают на химическую природу группы, которую атакует фермент. Подклассы делятся на подподклассы, которые ещё более конкретизируют действие ферментов, указывают на связь в молекуле субстрата, которая подвергается действию фермента. Подподкласс может указывать на химическую природу акцептора.
Оксидоредуктазы.
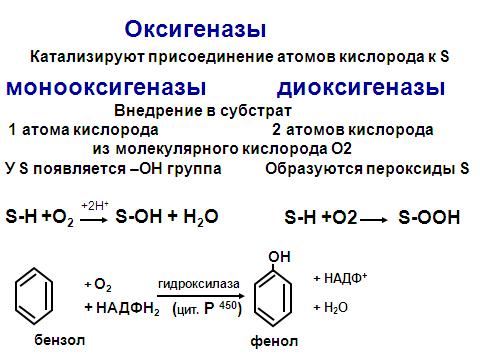
Ферменты этого класса участвуют в ОВР (окислительно-восстановительные реакции), т.е. в реакциях транспорта электронов и протонов. Это наиболее многочисленный класс ферментов: насчитывается более 400 оксиредуктаз. Выделяют 22 подкласса. Подклассы оксидоредуктаз в основном выделяются по типу донора (их можно посмотреть на сайте в лекции «Номенклатура и классификация ферментов»J) Основные подклассы: • дегидрогеназы; • оксидазы; • оксигеназы (гидороксилазы).
Подподклассы оксидоредуктаз в основном выделяют по типу акцептора. Коферментами этого класса являются НАД, НАДФ, ФАД, ФМН, убихинон, гем, глутатион, липоевая кислота, витамин С.
Международная классификация оксидоредуктаз очень громоздкая, поэтому на практике пользуются рабочей классификацией, согласно которой выделяют следующие подклассы оксидоредуктаз:

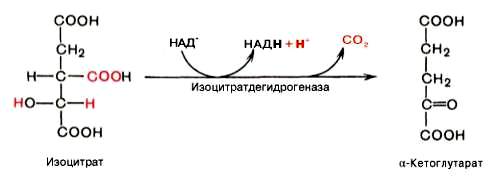
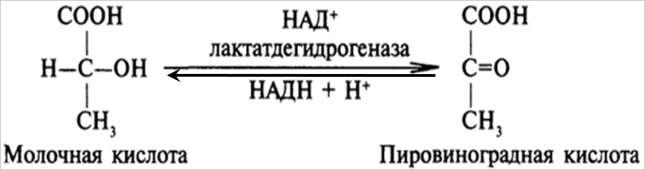 Дегидрогеназы – катализируют дегидрирование субстрата с использованием в качестве акцептора водорода любых молекул, кроме кислорода. Среди них флавинзависимые и никотиамидзависимые ферменты.
Дегидрогеназы – катализируют дегидрирование субстрата с использованием в качестве акцептора водорода любых молекул, кроме кислорода. Среди них флавинзависимые и никотиамидзависимые ферменты.

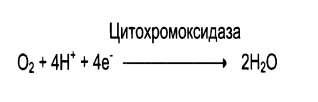
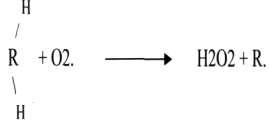 Оксидазы – катализируют окисление субстрата с молекулярным кислородом в качествеакцептора электронов без включения кислорода в молекулу субстрата. Примеры: цитохромоксидаза, ксантиоксидаза, аминооксидазы.
Оксидазы – катализируют окисление субстрата с молекулярным кислородом в качествеакцептора электронов без включения кислорода в молекулу субстрата. Примеры: цитохромоксидаза, ксантиоксидаза, аминооксидазы.
 В реакции всегда образуется пероксид водорода или вода.
В реакции всегда образуется пероксид водорода или вода.
Пероксидазы – катализируют реакции с пероксидом водорода в качестве акцептора электронов. Это группа ферментов, которые отнимают электроны от окисляемого субстрата и транспортируют его на пероксид.

Каталаза катализирует разложение Н2О2 до Н2О и молекулярного О2. 
Редуктазы – катализируют реакции, связанные с транспортом протонов и электронов от кофермента на субстрат. Чаще донором протонов является НАДФ2. Синтез ВЖК, холестерина.

Трансферазы.
Ферменты этого класса участвуют в транспорте атомных групп от одного субстрата к другому, т.е. всегда 2 и более субстратов. Субстрат, от которого группа отнимается, является донором, а субстрат, который её принимает, является акцептором. В зависимости от переносимых групп, трансферазы делятся на несколько подклассов.
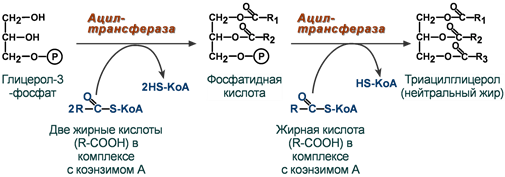
Основные подклассы: - аминотрансферазы; - метилтрансферазы; - фосфотрансферазы (киназы); - ацилтрансферазы; - гликозилтрансферазы.
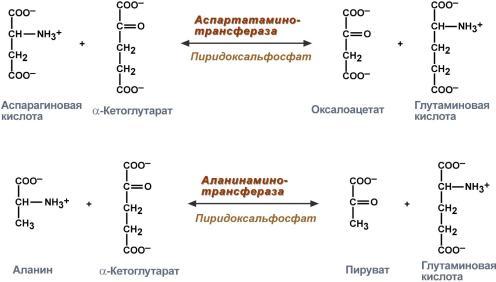
 Аминотрансферазы (аминогруппы). Они участвуют в реакциях переаминирования. АСТ – аспарагиновая аминотрансфераза; АЛТ – аланиновая аминотрансфераза. Реакция трансаминирования:
Аминотрансферазы (аминогруппы). Они участвуют в реакциях переаминирования. АСТ – аспарагиновая аминотрансфераза; АЛТ – аланиновая аминотрансфераза. Реакция трансаминирования:
Метилтрансферазы (- СН3 группы)
Фосфотрансферазы (фосфатные группировки). К ним относят
киназы (перенос фосфата с участием АТФ или АДФ). Киназы участвуют в
фосфорилировании белков - один из механизмов регуляции активности. Участвуют в
субстратном фосфорилировании – синтезе АТФ за счет энергии макроэргических связей субстрата.
Схема реакции для фосфотрансфераз: S + АТФ S-О
2РН
2 + АДФ
Ацилтрансферазы (кислотные остатки). Коферменты ТГФК, ПФ, АДФ, АТФ, ГДФ, ФАФС.
Гликозилтрансферазы (остатки моносахаридов).
12. Классификация и номенклатура ферментов. Характеристика ферментов третьего и четвертого классов, примеры реакций.
Классификацию и номенклатуру ферментов смотрите в 11 вопросеJ
Гидролазы.
Ферменты этого класса участвуют в реакциях разрыва связей в молекулах субстратов с присоединением элементов молекулы воды. При этом элементы воды присоединяются к свободным единичным валентностям, образовавшимся после разрыва связей. Таким образом, сложные органические соединения распадаются на простые - каталитические реакции гидролиза. Гидролазы, как правило, простые белки. В зависимости от разрушаемых связей, различают следующие подклассы гидролаз: - эстеразы; - гликозидазы; - пептидазы; - фосфатазы; - амидазы; - нуклеазы.
 Эстеразы действуют на сложноэфирные связи. К ним относятся липазы, фосфолипазы, холестеразы.
Эстеразы действуют на сложноэфирные связи. К ним относятся липазы, фосфолипазы, холестеразы.
 Гликозидазы - действует на гликозидную связь, находящуюся в сложных углеводах. К ним относятся амилаза, сахараза, мальтаза, гликозидазы, лактаза.
Гликозидазы - действует на гликозидную связь, находящуюся в сложных углеводах. К ним относятся амилаза, сахараза, мальтаза, гликозидазы, лактаза.
 Пептидазы (протеиназы) участвуют в разрыве пептидных связей в белках. К ним относятся пепсин, химотрипсин, аминопептидаза, карбоксипептидаза и т.д.
Пептидазы (протеиназы) участвуют в разрыве пептидных связей в белках. К ним относятся пепсин, химотрипсин, аминопептидаза, карбоксипептидаза и т.д.
По локализации разрываемой связи в субстрате пептидазы: эндопептидазы – гидролиз пептидных связей внутри молекулы; экзопептидазы – отщепление от полипептидной цепи концевых аминокислот; дипептидазы – гидролиз дипептидов.
В зависимости от механизма действия эндопептидазы делятся на 4 подкласса: • Сериновые протеиназы (трипсин, химотрипсин) – сер, гис; • Тиоловые протеиназы (папаин, катепсин В) – цис; • Кислые протеиназы (пепсин, катепсин D) – глу, асп (опт рН ниже 5); • Металлопротеиназы (коллагеназа) – Са2+, Zn2+.
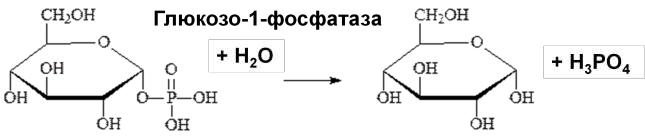 Фосфатазы - гидролиз фосфоэфирной связи (отщепление фосфорной кислоты).
Фосфатазы - гидролиз фосфоэфирной связи (отщепление фосфорной кислоты).
Амидазы – катализируют гидролиз амидов кислот (уреаза, аспарагиназа, глутаминаза).

Нуклеазы – гидролизуют фосфодиэфирные связи в нуклеиновых кислотах.
Лиазы (синтазы).
- разрыв ковалентной связи в молекуле субстрата негидролитическим путем, ускоряют отщепление негидролитическим путём групп: СООН, NH2, SH; - присоединение воды по двойной связи (гидратация) и отщепление воды с образованием двойной связи (дегидратация); - синтез веществ за счет энергии макроэргических связей субстрата.
Если реакция сопровождается синтезом вещества, связана с использованием энергии, но источником ее не являются нуклеозидтрифосфаты. Источник – энергия макроэргических связей субстрата.
Подкласс определяется типом расщепляемой связи: • 4.1. расщепляют связь C-C;• 4.2. расщепляют связь C-O;• 4.3. расщепляют связь C-N;• 4.4. расщепляют связь C- S;• 4.5. расщепляют связь C-Cl.
| глицеральдегид-3-фосфат
фосфат
|

Могут быть простыми и сложными белками.
Коферменты: ПФ, ТПФ, нуклеотиды. К лиазам относится
альдолаза, разрывающая связь С-С негидролитическим путем.
Разрыв связи С-С:
| диоксиацетон-3-фосфат
-3-фосфат
|
 Декарбоксилазы участвуют в реакциях декарбоксилирования. Реакция декарбоксилирования:
Декарбоксилазы участвуют в реакциях декарбоксилирования. Реакция декарбоксилирования:
Ферменты, участвующие в реакциях гидратации и дегидратации.
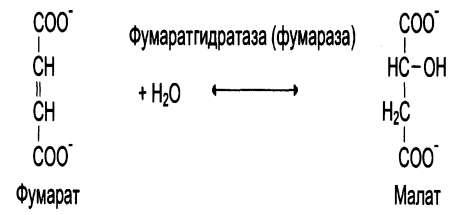 Реакция гидратации (дегидратации):
Реакция гидратации (дегидратации):
13. Классификация и номенклатура ферментов. Характеристика ферментов пятого и шестого классов, примеры реакций.
Классификацию и номенклатуру ферментов смотрите в 11 вопросеJ
Изомеразы.
Ферменты этого класса участвуют в изомерических превращениях. Внутримолекулярные перестройки без изменения молекулярной формулы вещества. При этом один структурный изомер может превращаться в другой, за счёт внутри молекулярной перегруппировки атомов. Выделяют: • «истинные изомеразы» (например, триозофосфатизомераза); • мутазы (фосфоглюкомутаза и др.); • эпимеразы.


 Действие мутазы: Действие эпимеразы:
Действие мутазы: Действие эпимеразы:
Лигазы (синтетазы).
• участвуют в реакциях соединения двух и более простых веществ с образованием нового вещества. Эти реакции требуют затрат энергии, сопряжены с гидролизом нуклеозидтрифосфата.
Главная их особенность — сопряженность синтеза с распадом веществ, способных поставлять энергию для осуществления биосинтетического процесса. Одним из таких природных соединений является АТФ. При отрыве от ее молекулы в присутствии лигаз одного или двух концевых остатков фосфорной кислоты выделяется большое количество энергии, используемой для активирования реагирующих веществ и ускорения синтеза органических соединений из активированных субстратов. Кроме АТФ источником энергии для лигазных реакций могут быть другие нуклеозидтрифосфаты. Коферментами могут быть нуклеозидтрифосфаты, HSkoA, биотин. Подкласс определяется типом синтезируемой связи С-С, C-N, C-O, C-S.
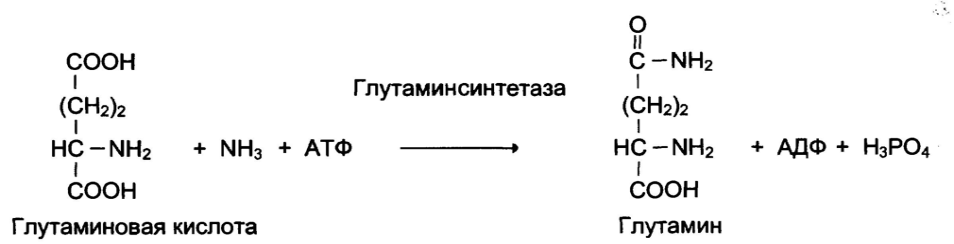





 Пример абсолютной субстратной специфичности: Каталитическая специфичность:
Пример абсолютной субстратной специфичности: Каталитическая специфичность:

 10. Коферменты, классификация, функции в ферментативных реакциях, примеры реакций.
10. Коферменты, классификация, функции в ферментативных реакциях, примеры реакций.







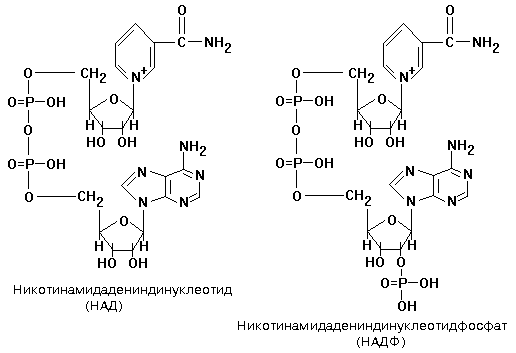







 Каждый класс делится на подклассы. Они уточняют действие ферментов и указывают на химическую природу группы, которую атакует фермент. Подклассы делятся на подподклассы, которые ещё более конкретизируют действие ферментов, указывают на связь в молекуле субстрата, которая подвергается действию фермента. Подподкласс может указывать на химическую природу акцептора.
Каждый класс делится на подклассы. Они уточняют действие ферментов и указывают на химическую природу группы, которую атакует фермент. Подклассы делятся на подподклассы, которые ещё более конкретизируют действие ферментов, указывают на связь в молекуле субстрата, которая подвергается действию фермента. Подподкласс может указывать на химическую природу акцептора.
 Дегидрогеназы – катализируют дегидрирование субстрата с использованием в качестве акцептора водорода любых молекул, кроме кислорода. Среди них флавинзависимые и никотиамидзависимые ферменты.
Дегидрогеназы – катализируют дегидрирование субстрата с использованием в качестве акцептора водорода любых молекул, кроме кислорода. Среди них флавинзависимые и никотиамидзависимые ферменты.
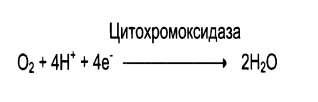
 Оксидазы – катализируют окисление субстрата с молекулярным кислородом в качествеакцептора электронов без включения кислорода в молекулу субстрата. Примеры: цитохромоксидаза, ксантиоксидаза, аминооксидазы.
Оксидазы – катализируют окисление субстрата с молекулярным кислородом в качествеакцептора электронов без включения кислорода в молекулу субстрата. Примеры: цитохромоксидаза, ксантиоксидаза, аминооксидазы. В реакции всегда образуется пероксид водорода или вода.
В реакции всегда образуется пероксид водорода или вода.


 Аминотрансферазы (аминогруппы). Они участвуют в реакциях переаминирования. АСТ – аспарагиновая аминотрансфераза; АЛТ – аланиновая аминотрансфераза. Реакция трансаминирования:
Аминотрансферазы (аминогруппы). Они участвуют в реакциях переаминирования. АСТ – аспарагиновая аминотрансфераза; АЛТ – аланиновая аминотрансфераза. Реакция трансаминирования: Эстеразы действуют на сложноэфирные связи. К ним относятся липазы, фосфолипазы, холестеразы.
Эстеразы действуют на сложноэфирные связи. К ним относятся липазы, фосфолипазы, холестеразы. Гликозидазы - действует на гликозидную связь, находящуюся в сложных углеводах. К ним относятся амилаза, сахараза, мальтаза, гликозидазы, лактаза.
Гликозидазы - действует на гликозидную связь, находящуюся в сложных углеводах. К ним относятся амилаза, сахараза, мальтаза, гликозидазы, лактаза. Пептидазы (протеиназы) участвуют в разрыве пептидных связей в белках. К ним относятся пепсин, химотрипсин, аминопептидаза, карбоксипептидаза и т.д.
Пептидазы (протеиназы) участвуют в разрыве пептидных связей в белках. К ним относятся пепсин, химотрипсин, аминопептидаза, карбоксипептидаза и т.д. Фосфатазы - гидролиз фосфоэфирной связи (отщепление фосфорной кислоты).
Фосфатазы - гидролиз фосфоэфирной связи (отщепление фосфорной кислоты).
 Могут быть простыми и сложными белками. Коферменты: ПФ, ТПФ, нуклеотиды. К лиазам относится альдолаза, разрывающая связь С-С негидролитическим путем. Разрыв связи С-С:
Могут быть простыми и сложными белками. Коферменты: ПФ, ТПФ, нуклеотиды. К лиазам относится альдолаза, разрывающая связь С-С негидролитическим путем. Разрыв связи С-С:
 Декарбоксилазы участвуют в реакциях декарбоксилирования. Реакция декарбоксилирования:
Декарбоксилазы участвуют в реакциях декарбоксилирования. Реакция декарбоксилирования: Реакция гидратации (дегидратации):
Реакция гидратации (дегидратации):

 Действие мутазы: Действие эпимеразы:
Действие мутазы: Действие эпимеразы:



