ВИРУСОЛОГИЯ
Учебное пособие
Волгоград
Волгоградский ГАУ
УДК 619: 616.9
ББК 48.43
У–91
Рецензенты:
кандидат ветеринарных наук, доцент кафедры «Анатомия и физиология животных» ФГБОУ ВО Волгоградский ГАУ М.М. Ковалёв;
кандидат ветеринарных наук, главный государственный ветеринарный инспектор, старший консультант инспекторского отдела комитета ветеринарии Волгоградской области Ю.А. Горькавский
Фирсов, Григорий Михайлович
У–91 Учебное пособие по дисциплине «Вирусология» / Г.М. Фирсов – Волгоград: ФГБОУ ВО Волгоградский ГАУ, 2016. – 108 с.
Учебное пособие предназначено в помощь бакалаврам факультета биотехнологий и ветеринарной медицины по направлению подготовки 36.03.01 «Ветеринарно-санитарная экспертиза».
Приведены методики проведения занятий и методические указания по изучаемым темам. Даны рекомендации по выполнению лабораторных работ по дисциплине: «Вирусология», приведены методы индикации вирусов в патологическом материале и их идентификации, выделения и титрования вирусов, включая правила работы с вирусами и культурами клеток, а также задания и контрольные вопросы.
Рекомендовано методической комиссией факультета биотехнологий и ветеринарной медицины (протокол № ____ от ___________ г.).
УДК 619: 616.9
ББК 48.43
© ФГБОУ ВО Волгоградский государственный аграрный университет, 2016
© Фирсов Г.М. 2016
ВВЕДЕНИЕ
Цель курса «Вирусология» - овладение теоретическими основами вирусологии и приобретение знаний и навыков профилактики и диагностики вирусных болезней животных.
Задачи курса «Вирусология» изучение особенностей биологии вирусов и взаимодействия их с заражаемым организмом; усвоение основных принципов диагностики вирусных болезней животных; овладение современными вирусологическими методами лабораторной диагностики.
Область профессиональной деятельности выпускника
Область профессиональной деятельности бакалавров включает:
проведение Ветеринарно-санитарной экспертизы, ветеринарно-санитарного
контроля в перерабатывающей промышленности, государственных
лабораториях Ветеринарно-санитарной экспертизы рынков, на транспорте,
таможне, в пограничных ветеринарных пунктах, в лабораториях
Ветеринарно-санитарной экспертизы научно-исследовательских институтов, вузов; проведение Ветеринарно-санитарных мероприятий (плановых и профилактических дезинфекций на перерабатывающих предприятиях, дератизаций, дезинсекций, дезинфекций) на перерабатывающих предприятиях; проведение ветеринарно-санитарного контроля сырья и продуктов животного происхождения в соответствии с ветеринарным законодательством, с требованиями санитарных и ветеринарных норм, ХАССП, GMP, охрана окружающей среды, осуществление биологической безопасности сырья и продуктов животного происхождения
ТЕМА 1. ПРАВИЛА РАБОТЫ С ВИРУССОДЕРЖАЩИМИ МАТЕРИАЛАМИ. УСТРОЙСТВО ВИРУСОЛОГИЧЕСКОЙ ЛАБОРАТОРИИ
Цель занятия
Ознакомиться с вирусологической лабораторией кафедры, оборудованием. Изучить правила и технику безопасности при работе с вируссодержащим материалом.
Оборудование и материалы
Таблицы - схемы устройства вирусологической лаборатории, настольный бокс, люминесцентный и инвертированный микроскопы, центрифуги, холодильники, магнитные мешалки, термостаты, спиртовки, стеклянная посуда (груши, пробирки, флаконы, матрасы, чашки Петри, пипетки), аппараты Такачи, основные реактивы и питательные среды, журнал регистрации студентов, получавших инструктаж по технике безопасности, документация лаборатории и основные утвержденные инструкции по правилам работы в ветеринарных учреждениях, мультимедийное оборудование, презентации MS Office Power Point по теме занятия.
Методика проведения занятия и методические указания по теме
Объяснение преподавателя
Цели и задачи вирусологических лабораторий, оборудование, режим работы вирусологических лабораторий, предупреждения лабораторных заражений, методы хранения и уничтожения вирусов в лабораториях, консервирование, документация в вирусологических лабораториях, техника безопасности при работе студентов с вируссодержащим материалом, с лабораторными животными.
Инструктаж и роспись в журнале по технике безопасности.
Сотрудники вирусологической лаборатории и студенты обязаны соблюдать правила работы, предупреждающие загрязнения вируссодержащего материала посторонней микрофлорой, обеспечить личную безопасность и не допустить рассеивания вирусов во внешней среде.
ТРЕБОВАНИЯ К РАБОЧИМ ПОМЕЩЕНИЯМ И ОБЕСПЕЧЕНИЕ УСЛОВИЙ РАБОТЫ
Современные требования к лабораторным диагностическим комплексам и отдельным составляющим (полы, стены, потолки, системы отопления, вентиляции, водоснабжения и канализации) изложены в правилах лабораторной практики GLP.
Вирусологические отделы лабораторий и научно-исследовательских ветеринарных станций призваны осуществлять лабораторную диагностику вирусных инфекций, контролировать заболеваемость животных, вызываемую вирусами в межэпизоотический период, а также учитывать состояние и напряженность специфического постинфекционного и поствакцинального противовирусного иммунитета, участвовать в организации и проведении профилактических мероприятий в борьбе с вирусными и хламидийными заболеваниями животных в обслуживаемом регионе.
Структура вирусологической лаборатории определяется задачами и особенностями ее деятельности. Размещать лабораторию желательно в двухэтажном здании или в изолированном отсеке. Боксы предпочтительнее располагать с северной, теневой стороны здания, чтобы избежать попадания в них прямых солнечных лучей, или следует застеклить окна боксов молочным или матовым стеклом. Полы в коридорах и комнатах для сотрудников могут быть паркетными, покрытыми лаком; в остальных – из плотного, влагонепроницаемого, устойчивого к дезинфектантам материала. Деревянные полы покрывают пластиком. Стены и потолки лаборатории должны быть также устойчивыми к дезинфектантам, легко подвергаться мойке. В боксах всю площадь целесообразно отделывать кафельной плиткой. Двери боксов должны быть раздвижными. Это позволяет сэкономить площадь и избежать колебания воздуха. В плоскости двери устраивают окошко с небольшой площадкой Целесообразно иметь боксы следующего назначения: для получения и культивирования клеток – 1–2 бокса; для заражения культуры клеток – 1–2, для заражения куриных эмбрионов – 1–2 бокса; для заражения подопытных животных – 1 бокс; для вскрытия подопытных животных – 1 бокс; для склада стерильного стекла – 1 помещение.
Основные диагностические работы должны проводиться в настольных или стационарных ламинарных боксах (разного класса) с системой защиты оператора, предупреждения контаминации исследуемого материала, защиты окружающей среды от вредных и опасных выбросов.
Помещения несколько больших размеров (примерно 4х4 м) выделяют для серологических исследований, уничтожения инфекционного материала, приготовления и стерилизации лабораторной посуды и других материалов, приготовления питательных сред и растворов, а также для сотрудников.
Лаборатория (отдел) вирусологии должна быть обеспечена холодной и горячей водой, желательны подача пара и газа, наличие централизованного вакуум-провода и подачи воздуха под давлением.
Каждый бокс комплектуют соответствующей мебелью и оборудованием. Примерная схема размещения оборудования и приборов представлена на рисунке 1. Наиболее важен стол, размер которого зависит от выполняемых на нем работ. В связи с тем, что многие работы приходится выполнять вдвоем, стол рекомендуется располагать параллельно стене, чтобы два работника сидели друг против друга, или ставить его к стене в виде буквы Т, что позволяет более экономно использовать площадь стола. Шкафчики для стеклянной посуды и мелкого инвентаря можно устроить под столом или повесить на стену. Покрытие лабораторного стола должно быть устойчивым к действию дезинфицирующих веществ. Лабораторные стулья лучше всего металлические, так как они легко очищаются и дезинфицируются. Над рабочим местом устанавливают бактерицидные лампы (БУВ-30). У входа в бокс кладут резиновый губчатый коврик, пропитанный дезраствором. В предбокснике находятся стерильные халаты, колпаки, косынки, маски и тапочки, перчатки, которые надевают перед работой в боксе, и, в зависимости от назначения бокса, соответствующее оборудование (термостат, холодильник, водяная баня, центрифуга и пр.).
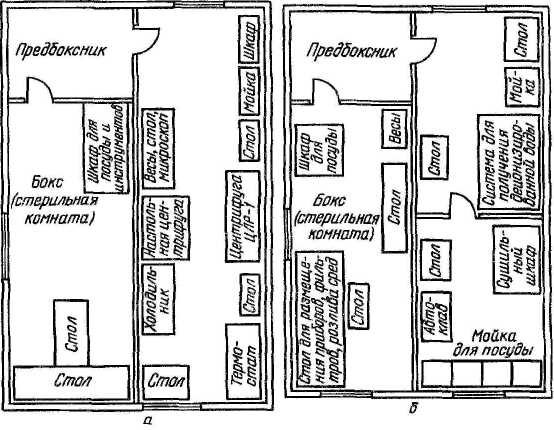
Рисунок 1 - Схема размещения оборудования: а – для работы с культурами клеток, б – для изготовления сред и растворов для культур клеток

Рисунок 2 - Микробиологический защитный бокс I класса:1 – вытяжной вентилятор; 2 - высокоэффективный воздушный фильтр; 3 - смотровая стеклянная панель; 4- открытый проем для рук работающего; 5 - штуцера для подводок воды, воздуха

Рисунок 3 - Бокс с ламинарной подачей стерильного воздуха:1 – газовая горелка, 2 – матрас, 3 – резиновая груша
Ограничить численность бактерий можно с помощью бактерицидных лампБУВ-15 и БУВ-30. Значительного снижения количества бактерий в воздухе боксов и предбоксников, на поверхности столов и другого оборудования можно достигнуть обработкой аэрозолем перекиси водорода и некоторых других веществ. Уборку помещений проводят влажным способом: полы, стены, мебель протирают марлей, увлажненной дезраствором.
Для вирусологической лаборатории любого типа обязательной частью оборудования должен быть настольный бокс, содержащий бактерицидную лампу, еще лучше – ламинарный шкаф с подачей стерильного воздуха (рис. 2, 3).
При работе в вирусологической лаборатории необходимо строго соблюдать методы и правила асептики и антисептики!
Асептика – система мероприятий и приемов работы, предупреждающих попадание микроорганизмов и вирусов из окружающей среды в организм человека, а также в исследуемый материал. Она предусматривает использование стерильных инструментов и материалов, обработку рук сотрудников, соблюдение особых санитарно-гигиенических правил и приемов работы.
Антисептика – комплекс мероприятий, направленных на уничтожение микроорганизмов и вирусов, способных вызвать инфекционный процесс при попадании на поврежденные или интактные участки кожи и слизистых оболочек. В качестве антисептиков используют различные химические вещества: 70%-ный этиловый спирт, 5%-ный спиртовой раствор йода, 0,5–3%-ный раствор хлорамина, 0,1%-ный раствор перманганата калия, 0,5–1%-ный раствор формалина, 1-2%-ные спиртовые растворы метиленового синего или бриллиантового зеленого.
Дезинфекция – обеззараживание объектов окружающей среды путем уничтожения патогенных для человека и животных микроорганизмов и вирусов физическими способами и с помощью химических веществ: растворами хлорной извести (0,1–-10%-ным), формалина, хлорамина (0,5-5%-ным), фенола (3–5%-ным), лизола (3–5%-ным), едкой щелочи (2–3%-ным) и др. Выбор дезинфицирующего вещества и его концентрации зависит от материала, подлежащего дезинфекции.
В лабораториях для дезинфекции боксов чаще всего применяют пары формалина (30–35 мл 40%-ного раствора формальдегида на 1 м3 помещения), ß-пропиолактон (1,1 л на 100 м3 помещения) или испаряют карболовую кислоту (не реже одного раза в неделю) и ежедневно делают влажную уборку с применением растворов хлорамина, гидроксида натрия и др.
Стерилизация – обеспложивание, т. е. полное уничтожение микроорганизмов и вирусов в различных материалах. Стерилизацию проводят физическими (воздействием высокой температуры, путем ультрафиолетового облучения, фильтрацией жидкостей через бактериальные фильтры) и химическими методами.
Физические методы стерилизации:
а) прокаливание в пламени спиртовки или горелки. Данный способ применяют для стерилизации препаровальных игл, петель из аппарата Такачи, пинцетов, горловин культуральных сосудов и т. д.;
б) стерилизация кипячением. Этим методом стерилизуют шприцы, мелкий хирургический инструмент, предметные и покровные стекла и другие предметы. Кипятят не менее 30 мин. Однако данный метод не обеспечивает полной стерилизации, так как некоторые вирусы, например вирус гепатита, и споры бактерий могут остаться при этом жизнеспособными;
в) стерилизация сухим жаром в сушильном шкафу. Метод основан на действии нагретого до 165–180°С воздуха. Сухим жаром стерилизуют стеклянную посуду;
г) стерилизация в автоклаве паром под давлением. Это один из наиболее эффективных методов стерилизации, поэтому он широко применяется;
д) стерилизация в аппарате Коха или автоклаве текучим паром (давление 100–150 кПа (1–1,5 атм.), экспозиция 30 мин). Применяют для стерилизации материалов, не выдерживающих воздействия высокой температуры, например питательных сред с витаминами и углеводами;
е) стерилизация ультрафиолетовыми лучами. Метод основан на бактерицидном действии УФ-лучей с длиной волны 260– 300 мкм. Для стерилизации воздуха в боксах используют лампы БУВ-15, БУВ-30. Обычно облучение проводят 1–2 ч;
ж) фильтрование жидкостей через бактериальные фильтры. Этим методом пользуются для освобождения питательных сред, сыворотки крови, витаминов и т. д. от бактерий, но не от вирусов.
Задания
1. Ознакомиться с вирусологической лабораторией и ее основным оборудованием.
2. Изучить правила работы с вируссодержащим материалом.
Самостоятельная работа студентов
а) подготовка бокса для работы;
б) отработка навыков работы с пипеткой и стерильными инструментами;
в) изучение документации лаборатории.
Подведение итогов занятия
Задание к следующему занятию
Контрольные вопросы
1. Какова роль вирусов в инфекционной патологии животных?
2. Что вы знаете о технике безопасности и правилах работы в вирусологической лаборатории?
3. Какие методы консервации вирусов вы знаете?
4. Какие способы уничтожения вирусов существуют в лабораторной практике?
ТЕМА 2. ПОЛУЧЕНИЕ, ТРАНСПОРТИРОВКА И ПОДГОТОВКА
Цель занятия
Ознакомить студентов с правилами взятия и транспортировки патологического материала для лабораторных исследований. Приготовить вируссодержащую суспензию из органов павших или вынужденно убитых животных. Подготовить смывы, полученные от больных животных, для вирусологического исследования.
Оборудование и материалы
Стерилизаторы со стерильными ножницами и пинцетами; спиртовки; стерильные ватные тампоны; вата; спирт-ректификат; пенициллиновые флаконы с 3–4 мл раствора Хенкса; термос с охлаждающей смесью; лейкопластырь; графитные карандаши; кювета; пенициллиновые флаконы с кусочками паренхиматозных органов; стерильные ступки с пестиками; стерильный песок; пипетки на 5 и 10 мл, стерильные центрифужные пробирки; антибиотики (пенициллин и стрептомицин); МПА; МПБ; раствор Хенкса или Эрла, центрифуга, мультимедийное оборудование, презентации MS Office Power Point по теме занятия.
Объяснение преподавателя
Правила и методы получения, упаковки, порядок транспортировки и хранения вируссодержащего материала, подготовка его к исследованию.
Демонстрация
а) набора посуды и инструментов, необходимых для взятия материала от больных животных и трупов;
б) приемов взятия смывов со слизистой оболочки носа, конъюнктивы, прямой кишки у коров, телят или других животных;
в) этикетирования и транспортировки взятого материала.
МАТЕРИАЛА
В лабораторной диагностике вирусных болезней точность диагноза прежде всего зависит от правильности взятия патологического материала, его транспортировки, качества приготовления и техники исследования вируссодержащего материала, которые имеют свои особенности.
Материал для исследований от заболевших, павших или вынужденно убитых животных следует брать как можно быстрее после появления четких признаков болезни или не позднее 2–3 ч после клинической смерти или убоя. Это связано с тем, что сразу после заболевания или в первые 1–2 дня значительно ослабевает барьерная роль кишечника, что наряду с повышенной проницаемостью кровеносных сосудов способствует диссеминации кишечной флоры. Кроме того, по мере продолжения и даже углубления инфекционного процесса количество вируса может уменьшаться в результате воздействия защитных механизмов организма.
При взятии материала для выделения вируса следует исходить из патогенеза изучаемой инфекции (входные ворота, пути распространения вируса в организме, места его размножения и пути выделения). Так, при респираторных инфекциях для выделения вирусов берут носоглоточные смывы, мазки из носа и глотки, соскобы трахеи и кусочки легкого трупов; при энтеровирусных – кал; при нейротропных – кусочки головного или спинного мозга; при дермотропных инфекциях – свежие поражения кожи и т. п., т. е. отбирают тот материал, в котором предполагается наибольшая концентрация вируса. Материалом для выделения вируса могут служить различные экскреты и секреты, кусочки органов, кровь, лимфа и пр.
Кровь берут из яремной вены, у свиней – из кончика хвоста или уха. Лучше кровь у свиней брать из венозного сплетения глаз. При этом пользуются шприцем «Рекорд» (на 20 мл) и иглой № 12–30, которую вводят по внутреннему углу костной орбиты (скосом иглы к костной орбите) к противоположному уху до упора, затем оттягивают на 1–1,5 см и набирают кровь. Для выделения вируса может быть использована либо цельная дефибринированная, либо «лаковая» кровь (смесь крови с дистиллированной водой в соотношении 1:1), либо отдельные элементы крови (эритроциты, лейкоциты, плазма, сыворотка). Для обнаружения противовирусных антител кровь берут у одного и того же животного дважды с интервалом 2–3 нед (для получения парных сывороток в объеме не менее 5,0 мл каждой).
Смывы с конъюнктивы, со слизистой оболочки носа, с задней стенки глотки, прямой кишки и клоаки у птиц берут стерильными ватными тампонами и погружают их в пенициллиновые флаконы или пробирки, содержащие 3–5 мл соответствующей жидкости. Наиболее часто для этого используют раствор Хенкса или среды для культур клеток (ГЛА, 199, Игла) с антибиотиками (пенициллин и стрептомицин по 500 ЕД и нистатин по 20 ЕД на 1 мл среды) и белковым стабилизатором, например 0,5%-ным раствором желатина или 0,5–1%-ным раствором альбумина бычьей сыворотки. Присутствие стабилизаторов необходимо для предотвращения быстрой инактивации некоторых вирусов (например, парагриппа). При взятии материала из носоглотки можно пользоваться прибором, сконструированным Томасом и Стоком. Он состоит из трубки диаметром 9 мм и длиной 30 см, внутри которой помещается вторая тонкая трубка с нержавеющим стержнем, оканчивающимся нейлоновой щеткой (диаметр 9 мм). Прибор вводят глубоко в носовые ходы (хоаны) или в горло через носовой ход, выдвигая щеточку, а затем, вновь задвигая ее в трубку, перед тем как вынуть прибор из органа. Щеточку тщательно отмывают от слизи и клеток в 2 мл жидкости.
Слюну имеет смысл брать при наличии признаков поражения ротовой полости или слюнных желез. Вытекающую изо рта слюну можно собрать прямо в пробирку. Если ее выделяется мало или она не вытекает, необходимо пропитать слюной стерильный тампон из ваты на палочке, а затем поместить в пробирку с небольшим количеством физиологического раствора и закрыть резиновой пробкой. Для усиления слюноотделения животному можно ввести пилокарпин из расчета 0,02–0,05 г на 1 кг массы.
Мочу собирают при помощи катетера в стерильную посуду.
Фекалии берут из прямой кишки шпателем или палочкой и помещают в стерильную пробирку или пенициллиновый флакон.
Везикулярную жидкость можно собрать шприцем или пастеровской пипеткой в стерильную пробирку.
Стенки афт, корочки с поверхности кожи снимают пинцетом.
Извлечение спинного мозга
Рассекают вдоль позвоночника мышцы спины, специальными костными щипцами или большими остроконечными ножницами пересекают с обеих сторон остистые отростки позвонков, снимают твердую мозговую оболочку, обнаженный спинной мозг вынимают целиком или сегментами вместе с корешками и помещают в стерильную чашку Петри. При извлечении спинного мозга по методу Ошида позвоночник пересекают на уровне шейных и поясничных позвонков и стерильным зондом с ватным тампоном, введенным в спинномозговой канал с поясничного конца, выталкивают спинной мозг в стерильную посуду. У морских свинок, крыс и мышей принцип взятия мозга такой же, как у кроликов. Для вскрытия черепной коробки морских свинок и крыс применяют остроконечные хирургические ножницы, для вскрытия черепа мышей – глазные.
Спинной мозг мелких животных получают также методом выдавливания. Позвоночник вместе с ребрами и мышцами пересекают в шейной части, затем двумя пинцетами, начиная с хвостовой части, попеременно пережимают позвоночник, постепенно передвигаясь к головному концу. Спинной мозг выдавливают из пересеченного шейного конца позвоночника.
Головной и спинной мозг не рекомендуется промывать растворами. При извлечении их необходимо также соблюдать все предосторожности (работа в защитной спецодежде, в резиновых перчатках, защитной маске и очках, быть предельно аккуратным).
Периферические нервы редко используют для выделения вируса. Метод получения нерва обусловливается анатомическим его расположением. Для исследования необходимо брать небольшой отрезок нерва.
Извлечение глаза
Ткани глаза используют для выделения вируса при болезнях, сопровождающихся поражением глаза и конъюнктивы и накоплением или репродукцией вируса в них. Для извлечения глаза вокруг него рассекают кожу и удаляют ее. Ножницами рассекают конъюнктиву и глазные мышцы. Глазное яблоко выводят пинцетом из орбиты наружу, а затем пересекают глазной нерв. Извлеченное глазное яблоко фиксируют пинцетом за культю глазного нерва и струей стерильной питательной среды тщательно и обильно промывают. При необходимости исследования разных тканей глаза (например, роговицы) иссечение их производят в стерильных условиях.
Извлечение внутренних органов
Вскрытие грудной и брюшной полостей производят по общим правилам. Для исследования берут вируссодержащие органы – легкие, печень, почки, лимфоузлы, селезенку, кишечник и др. При наличии макроскопических изменений органов из пораженной части их вырезают кусочки, захватывая и непораженную ткань.
ИССЛЕДОВАНИЯ
Пробу для гистологического исследования также необходимо проводить как можно скорее после гибели животного, до аутолиза и деструкции клеток. Если нет возможности доставить материал в лабораторию в течение нескольких часов, его помещают в консервирующий раствор. С. С Кальтер уточняет условия, обеспечивающие оптимальное сохранение проб.
1) соотношение жидкости и ткани 20:1;
2) толщина пробы не более 0,5 см (длина и ширина не играют особой роли);
3) использование для пересылки проб сосудов с широким горлом.
Ни в коем случае нельзя замораживать ткани или использовать буру при консервации проб, предназначенных для гистопатологического исследования!
Хороший фиксирующий раствор получают при смешивании 50 мл формалина (40 % раствора формальдегида в воде) с 450 мл воды и 3,8 г поваренной соли. При отсутствии измерительных приборов и весов такой раствор можно приготовить, взяв 3 столовые ложки формалина, 0,5 л воды и чайную ложечку поваренной соли.
В качестве материала для гистологических исследований берут кусочки (размером в несколько кубических сантиметров) тех органов, которые имеют видимые отклонения от нормы (по форме, размеру, цвету, консистенции, наличию необычных образований); могут быть поражены и содержать вирус на основании клинической картины болезни и предположительной избирательной локализации.
Задания
1) получение смывов слизистых оболочек дыхательных путей телят, овец или других животных;
2) получение фецес;
3) консервация полученных материалов;
4) этикетирование;
5) приготовление из вируссодержащей ткани суспензии вируса;
6) подготовка смывов, полученных от животных, для вирусологического исследования.
Подведение итогов занятия
Задание к следующему занятию
Контрольные вопросы
1. Каковы общие правила взятия материала от больных животных и трупов?
2. Как консервируют и транспортируют патологический материал?
3. Что вы знаете о подготовке патологического материала к исследованию?
ТЕЛЕЦ-ВКЛЮЧЕНИЙ
Цель занятия
Ознакомить студентов с методами прямого обнаружения вируса в исследуемом материале. Освоить технику приготовления мазка из вируссодержащего материала и методику окраски мазков по Морозову. Ознакомиться с устройством и принципом работы электронного и люминесцентного микроскопов. Изучить приготовление препаратов для просмотра в электронном микроскопе.
Оборудование и материалы
Световые микроскопы, вируссодержащий материал, предметные стекла, спиртовки, фильтровальная бумага, эксикаторы, мостики, промывалки с дистиллированной водой, песочные часы, жидкость Руге, протрава, красящий раствор аммиачного серебра, электронный и люминесцентный микроскопы, схема строения электронного микроскопа, фотографии вирусов под электронным микроскопом, фоторепродукции вирусов в поле люминесцентного микроскопа (РИФ), мультимедийное оборудование, презентации MS Office Power Point и плакаты по теме занятия.
Объяснение преподавателя
Вирусы находящиеся в живых клетках одно- и многоклеточных организмов представлены чаще всего в виде скоплений не связанных между собой молекул (или частей молекул) РНК или ДНК, в которых закодирована генетическая информация о вирусных белках. В результате реализации этой информации в тех же клетках синтезируются и накапливаются молекулы вирусных белков. Внутри клеток все вирусные молекулы (ДНК, РНК, белки) защищены от разрушительного действия внеклеточных факторов (ферментов, кислот, температуры, излучений и др.). Если же вирусы оказываются вне клеток, то быстро разрушаются.
В ИССЛЕДУЕМОМ МАТЕРИАЛЕ
Многие вирусные белки, которые называются структурными, обладают свойством самопроизвольно под действием межмолекулярных сил собираться в комочки, агрегаты (процесс самосборки). В каждый такой агрегат включается обычно по одной молекуле вирусных ДНК или РНК. Иногда в них могут включаться еще и липиды клеточного происхождения.
Образующиеся таким путем частицы называются вирионами. В вирионах молекулы белков так взаимно ориентированы, что на них не могут действовать протеолитические ферменты, а молекулы вирусных ДНК или РНК оказываются недоступными для нуклеаз и защищенными ох действия физических факторов среды. Формирование вирионов каждого отдельного вируса возможно только в клетках определенного типа.
Вирионы можно рассматривать как покоящуюся неактивную форму существования вирусов. Поэтому в форме вирионов вирусы могут определенное время находиться и вне клеток без потери биологической активности.
Крупные вирусы (оспа, эктима), видимые в иммерсионной системе светового микроскопа получили название элементарные тельца.
Внутриклеточные тельца-включения – это обломки скоплений вирусных частиц или продукт реакции клетки на вирусную инфекцию. Их классифицируют по месту локализации в клетке, по гомогенности, по составу нуклеиновой кислоты, по тинкториальным свойствам.
При ряде вирусных инфекций обнаружение телец - включений имеет диагностическое значение. Многие из них настолько типичны, что обнаружение их стало одним из основных экспресс-методов диагностики бешенства, оспы, ринопневмонии лошадей, ринотрахеита крупного рогатого скота.
МЕТОДЫ ОКРАСКИ ВИРИОНОВ
Существует много методов окраски мазков, мазков - отпечатков. Самым распространенным является метод окраски по Морозову. Метод окраски прост, не требует дефицитных реактивов, выполним на занятиях.
Приготовленные мазки сушат на воздухе, помещают в вертикальном положении в дистиллированную воду на 10-15 минут и красят. Для окраски по Морозову готовят три реактива.
1) жидкость Руге;
2) протраву;
3) красящий раствор аммиачного серебра.
Рассматривают препарат в иммерсионной системе. Элементарные тельца на светло - коричневом фоне препарата имеют вид темно - коричневых почти черных мелких зерен, образований.
Тельца-включения, образуемые рядом вирусов, получили специальные названия. Так, цитоплазматические тельца - включения, образуемые в нервных клетках млекопитающих вирусом бешенства, называют тельца Бабеша-Негри, в эпителиальных клетках овец - вирусом оспы овец - тельца Борреля, вирусом оспы кур - тельца Болингера. Как правило, РНК-содержащие вирусы образуют цитоплазматические, а ДНК-содержащие – внутриядерные тельца-включения Небольшая группа вирусов вызывает образование телец-включений обоих типов. Наибольшее практическое значение приобрели тельца Бабеша-Негри в диагностике бешенства. Из кусочков определенных отделов головного мозга (Аммоновых рогов, мозжечка, продолговатого мозга) готовят гистологические срезы. Полученные препараты окрашивают по методу Муромцева, Туревича, Селлерса и др. Каждый метод окраски дает свою характерную картину.
МЕТОДЫ ПОДГОТОВКИ ПРЕПАРАТОВ
Метод негативного контрастирования, метод отпечатков, метод напыления, метод ультратонких срезов.
Материалом для электронно-микроскопических исследований вирусов могут быть смывы со слизистых оболочек, содержимое кишечника, кожные поражения, корочки, кусочки органов и тканей, аллантоисная жидкость куриного эмбриона, вируссодержащая культуральная жидкость культуры клеток. При подготовке препаратов большое значение имеет концентрация вируса в материале и степень его контаминации балластными веществами. В зависимости от этих факторов и выбирают методику подготовки исходного материала.
С помощью электронного микроскопа в отдельных случаях в считанные минуты по морфологии вирусных частиц можно определить таксономическое положение вируса.
Метод иммунофлуоресценции называют еще РИФ, метод меченых антител.

Рисунок 8 - Микроскоп люминесцентный Микромед - 3 ЛЮМ
Принцип РИФ основан на использовании явления флюоресценции, который состоит в испускании света атомами вещества, поглотившими избыточную внешнюю энергию и пришедшими в состояние возбуждения. При этом используют люминесцентную микроскопию (рис. 8).
В диагностических исследованиях методом РИФ в качестве объекта исследования могут быть мазки – отпечатки, срезы органов и тканей, соскобы, гистологические срезы, препараты тканевых культур.
При прямом методе РИФ мазок - отпечаток обрабатывают сывороткой, меченной антителами, гомологичными тому вирусу, наличие которого предполагается. Если в мазке содержится антиген, гомологичный антителам сыворотки, то образуется комплекс антиген + антитело. Препараты отмывают, сушат и исследуют под люминесцентным микроскопом, который устроен так, что на препарат падает пучок сине-фиолетовых лучей, а в глаз наблюдателя попадают только желто-зеленые лучи, которые испускает комплекс антиген + антитело. По этому свечению и судят о наличии в материале антигенов, гомологичных антителам меченой сыворотки.
Непрямой метод состоит в том, что мазок - отпечаток обрабатывают дважды: вначале немеченой антивирусной сывороткой, а затем после отмывания - меченной антивидовой. После второго отмывания препарат высушивают и исследуют под люминесцентным микроскопом. Обнаружение в препарате специфической флюоресценции указывают на наличие в материале антигенов, гомологичных использованной противовирусной сыворотке.
По эффективности непрямой метод имеет преимущества перед прямым методом.
В целом метод флюоресцирующих антител обладает рядом достоинств перед другими методами.
Задания
1. Найти под световым микроскопом в препаратах и зарисовать:
а) цитоплазматические тельца-включения;
б) внутриядерные тельца-включения;
в) вирионы вируса оспы в окраске по Морозову.
2.Ознакомиться с устройством и принципом работы электронного микроскопа.
3.Дешифрировать электронные микрофотографии вирионов разных вирусов (дать их схематический рисунок).
Самостоятельная работа студентов
Студенты знакомятся с устройством светового, люминесцентного и электронного микроскопов (в лаборатории), зарисовывают схему строения электронного микроскопа. Знакомятся с подготовкой препаратов для электронной микроскопии. Просматривают готовый препарат в люминесцентном микроскопе. Зарисовывают схему прямого и непрямого метода РИФ.
Подведение итогов занятия
Задание к следующему занятию
Контрольные вопросы
1.Устройство электронного микроскопа.
2. Методы подготовки препаратов для просмотра в электронном микроскопе.
3. Люминесцентную микроскопию (РИФ) прямой и непрямой методы.
4.Значение электронной и люминесцентной микроскопии в вирусологических исследованиях.
ВИДЫ ЛАБОРАТОРНЫХ ЖИВОТНЫХ
Наиболее широко в вирусологических лабораториях применяют мышей, белых крыс, кроликов, морских свинок, хомяков, цыплят. У молодых мышей экспериментально воспроизводят грипп, альфа- и флавивирусные инфекции, ящур (на новорожденных мышатах) и др. Они восприимчивы ко многим вирусам, их легко разводить и с ними удобно работать. Лучше использовать мышей инбредных линий, так как они почти одинаково реагируют на тот или иной вирус. У крыс также создают инбредные линии, но эти животные более устойчивы к определенным вирусным инфекциям, чем мыши. Онкогенность некоторых вирусов широко изучают на золотистых хомячках. Для вирусологических опытов обычно используют гладкошерстных морских свинок массой 250–300 г.
Ту или иную инфекцию иногда изучают на животных нескольких видов, обладающих разной чувствительностью к данному вирусу, что позволяет дифференцировать вирусы, вызывающие клинически сходные симптомы болезни (например, ящур, везикулярный стоматит, везикулярная экзантема и везикулярная болезнь свиней).
По генетическим качествам лабораторных животных делят на четыре группы:
1) животные смешанного происхождения, полученные от разных животноводов, такие животные гетерогенны;
2) животные, полученные непосредственно из одного источника, однако генетически такие животные вариабельны;
3) инбредные линии животных. Их получают в результате спаривания брата с сестрой или родителей с детьми по крайней мере не менее 20 поколений. При таком методе разведения достигается все возрастающая степень гомозиготности;
4) однородные гибриды F1. Высокая степень гетерозиготности, характерная для каждого гибрида, связана здесь с генетическим однообразием, которое соответствует степени гомозиготности родительских линий. Как правило, однородные гибриды F1 менее изменчивы, чем обе родительские линии. Животные-мутанты имеют о












