Благодаря достигнутым успехам в химиотерапии и лучевой терапии совершенствовались подходы к хирургическому лечению онкологических больных:
1) расширились показания к хирургическому лечению при местно- и локально распространенных опухолевых процессах (увеличилось число расширенных и комбинированных операций);
2) расширились показания к органоеохранным и функционально щадящим оперативным вмешательствам при ранних стадиях злокачественных заболеваний.
Таким образом, настоящий этап современной онкологии характеризуется:
— прогрессом в хирургии; — высоким техническим и дозиметрическим уровнем в лучевой терапии;
— прогрессом химиотерапии; — разработкой методов, направленных на иммунную коррекцию организма;
— использованием новых гормональных препаратов;
— достижениями генетики и молекулярной биологии в понимании природы инициализации и прогрессии злокачественного опухолевого роста.
На сегодняшний день большинство онкологических больных получает комбинированное и комплексное лечение
Комбинированное лечение предполагает использование двух принципиально разных методов лечения: оперативногои и лучевой терапии; оперативного и химиотерапии; лучевой терапии и химиотерапии.
Комплексное лечение представляет комбинацию химиотерапии, гормонотерапии и средств, воздействующих на иммунную систему, с оперативным и(или) лучевым лечением, а также использование всех трех методов лечения (операция + лучевая терапия + химиотерапия). (другое – «многокомпонентная терапия» - при которой могут использоваться вообще все известные методы: ГБО, гипергликемия, гипертермия и тд)
Сочетанное лечение — сочетание двух принципиально идентичных, но разных по механизму действия и применению методов (внутритканевое + наружное облучение); применение двух-трех противоопухолевых препаратов с разным механизмом действия
В онкологии существует термины неоадъювантная и адъювантная химиотерапия.
Концепция неоадъювантной (предоперационной) химиотерапии получила в настоящее время признание среди клиницистов большинства стран при лечении местно- и регионарнораспространенных опухолей. При местно-распространенном опухолевом процессе такое лечение дает возможность значительно уменьшить размеры первичной опухоли и регионарных лимфатических узлов, как бы снизить стадию болезни, достичь операбельности; рано воздействовать на возможно существующие отдаленные метастазы; выявить опухоли не чувствительные к данному режиму химиотерапии и таким образом определить более рациональное послеоперационное адъювантное лечение. Неоадъювантная химиотерапия при операбельном опухолевом процессе используется с целью возможного выполнения органосохранной либо функционально щадящей операции (способствует уменьшению выполняемого объема операции).
Адъювантная (послеоперационная) химиотерапия — комплекс дополнительных лечебных мероприятий, направленных на уничтожение скрытых микрометастазов после хирургического удаления первичной опухоли. Цель адъювантного лечения — улучшение безрецидивной и общей выживаемости
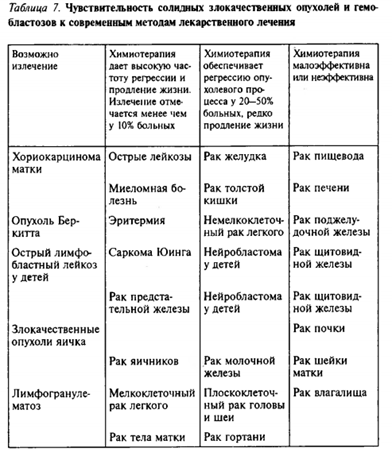
К настоящему времени в онкологии накопилось достаточно информации, на основе которой все злокачественные опухоли условно можно разделить на три группы по отношению к методам лечения: - I группа: высокодифференцированные злокачественные опухоли, для которых характерен относительно медленный рост, преимущественно локальный либо локально-регионарный характер распространения (плоскоклеточный рак шейки матки, высокодифференцированный рак щитовидной железы, плоскоклеточный рак гортани, полости рта и др.). Эффект лечения у этой группы больных может быть достигнут от применения локальных методов лечения: операции, лучевой терапии либо их сочетания на ранних стадиях заболевания. При распространенной стадии опухоли добавляются химиотерапия, гормонотерапия, иммунотерапия.
II группа: недифференцированные или низкодифференцированные опухоли, для которых характерен быстрый рост, раннее распространение по лимфатической и кровеносной системе, высокая приживляемость диссеминированных опухолевых клеток; опухоли чувствительны к химиотерапии и лучевой терапии (мелкоклеточный рак легкого, злокачественные неходжкинские лимфомы, саркома Юинга, недифференцированный рак любой локализации). Основной метод лечения — химиотерапия, оптимальный — химиолучевое лечение. Дополнительные методы лечения — хирургический и гормонотерапия.
III группа: опухоли, обладающие агрессивным, преимущественно инфильтративным характером распространения и выраженной способностью к раннему метастазированию; на определенной стадии характеризуются поэтапным локально-регионарным распространением, хотя способны к диссеминации (плоскоклеточный рак легкого, рак желудка, рак пищевода, рак молочной железы, меланома кожи, некоторые типы сарком мягких тканей и др.). Выбор метода лечения представляет значительные трудности. Основной метод лечения — хирургический, дополнительный — лучевая и химиотерапия.
Чтобы правильно выбрать методы и последовательность лечение необходимо выяснить все те же факторы, которые надо выяснять для выживаемости и реабилитации (выше) !
У онкологических больных выполняются диагностические и лечебные операции.
Лечебные операции делятся на радикальные, условно-радикальные, паллиативные, циторедуктивные, симптоматические; расширенные, комбинированные; экономные, органосберегающие, функционально щадящие; симультанные, реабилитационные, пластические, косметические, восстановительные.
Цель диагностической операции — уточнение диагноза. Основой диагностической операции является морфологический диагноз — биопсия.
Диагностическая операция иногда может переходить в лечебную. Так же и наоборот, при выполнении лечебной операции может обнаружиться выход опухолевого процесса за пределы пораженного органа (прорастание, метастазы). Тогда изменяют план предполагаемой операции; либо увеличивают ее объем, либо отказываются от хирургического лечения.
Типичное радикальное оперативное вмешательство при раке предусматривает:
• обязательное удаление опухоли в пределах здоровых тканей (полное удаление органа, или его резекция единым блоком с регионарными лимфатическими узлами, сосудами и окружающей их жировой клетчаткой, соблюдая принцип анатомической «футлярности» и зональности метастазирования);
• соблюдение линии отстояния резекции органа от опухоли. Так, при экзофитной форме роста злокачественной опухоли достаточно отступить 1—2 см от края опухоли и операцию можно считать радикальной; при инфильтративном характере опухоли нужно отступать не менее 5—6 см от края опухоли, а при мультицентрическом подслизистом росте опухоли подчас проксимальнее 10 см от края опухоли может быть выявлен опухолевый рост. Границы резекции опухоли с захватом здоровых тканей в среднем составляют от 2 до 8 см;
• микроскопическое определение удаления опухоли — в дистальном и проксимальном краях отсечения органа с опухолью не должно быть опухолевых клеток.
«Стандартные операции» в онкологии – это такие операции, которые предусмотрены для различных стадий одной нозологии, и отличаются чаще всего, объемом лимфодиссекции.
Комбинированной операция называется в случае, когда кроме органа, в котором выросла опухоль, удаляется орган, часть органа или ряд органов, куда опухоль прорастает.
Расширенной операцией в онкологии считают такую операцию, при которой по принципиальным соображениям или вынужденно в связи с регионарным распространением опухоли удаляют лимфатические барьеры шире типичных.
Экономные и функционально щадящие операции в онкологии выполняются чаще всего при облигатной предраковой патологии и в начальных стадиях рака (рак in situ, рак шейки матки IA стадии, рак молочной железы I стадии и др.).
Паллиативная операция производится при нерезектабельных опухолях, при наличии противопоказаний к выполнению радикальных оперативных вмешательств. Цель паллиативной операции - обеспечение пациенту максимально комфортных условий для жизни путем ликвидации мучительных симптомов, обусловленных преимущественно местным воздействием опухоли на соседние органы и ткани.
Циторедуктивные операции предусматривают удаление основного компонента опухоли с целью возможности добавления химиотерапии, гормонотерапии, лучевой терапии, средств, к которым остаточная небольшая часть опухоли может быть чувствительна, и, благодаря такому лечению, можно добиться длительной ремиссии заболевания
Следует отметить развитие реабилитационных операций, производимых у онкологических больных, — пластических, косметических, восстановительных.
Абластика представляет собой комплекс мероприятий, направленных на предотвращение попадания в операционную рану опухолевых клеток и гематогенной диссеминации. Принципы абластики:
• бережное обращение хирурга с органами и тканями, пораженными опухолью, аккуратность при мобилизации — не мять, не кусковать опухоль, стремиться в едином блоке удалить клетчатку с лимфатическими узлами, сосудами и органом;
• смена перчаток, инструментов, тщательный гемостаз, электрокоагуляция сосудов;
• промывание полостей антисептиками;
• введение дренажей перед ушиванием раны. Но полной абластики в большинстве случаев при хирургическом лечении достичь невозможно. Поэтому при распространенных стадиях опухолевого процесса после операции важно добавление средств, обладающих противоопухолевым действием.
Но полной абластики достичь почти невозможно, особенно при запущенных стадиях ЗНО.
Поэтому главное понятие оперативной онкологии – Антибластика - предусматривает воздействие до, во время и после операции на опухолевые клетки, способные вызвать рецидив заболевания, и включает комплекс мероприятий, направленных на уничтожение и удаление злокачественных клеток, которые могли бы попасть или попали в операционную рану (принципы = абластике)
Лучевая терапия в онкологии
В настоящее время лучевому лечению подвергается 60—70% онкологических больных, подлежащих антибластомному лечению. Исходя из стратегических задач оказания помощи больным со злокачественными новообразованиями, лучевая терапия может быть использована:
1) как самостоятельный, или основной, метод лечения;
2) в комбинации с хирургическим лечением;
3) в сочетании с химио-, гормонотерапией;
4) в составе мультимодальной терапии
Лучевая терапия как самостоятельный метод.
Лучевая терапия как самостоятельный метод лечения может быть проведена по радикальной программе, использована как паллиативное или симптоматическое средство.
Радикальная лучевая терапия направлена на полное излечение больного от опухоли и регионарных метастазов путем подведения канцерицидной дозы радиации. Применяется в случаях, когда является предпочтительной в косметическом или в функциональном отношении, а результаты одинаковы по сравнению с таковыми при применении других методов лечения онкологических больных (рак кожи, рак губы, опухоли средних отделов гортани, рак шейки матки). Уровни канцерицидных доз для различных опухолей неодинаковы и устанавливаются в зависимости от их гистологического строения, митотической активности и степени дифференцировки клеточных элементов. К опухолевому очагу должна быть подведена доза излучения 60—80 Гр, к зонам субклинического распространения — 40—50 Гр.
Паллиативная лучевая терапия предпринимается для уменьшения размеров опухоли и ее метастазов, стабилизации опухолевого роста и используется в тех случаях, когда невозможна лучевая терапия по радикальной программе. При этом суммарная очаговая доза (СОД), как правило, составляет 40— 50 Гр. Однако в процессе лучевого лечения эти дозы могут быть изменены. В случаях выраженной резорбции опухоли в ответ на лучевое воздействие и заметном улучшении общего состояния больного очаговая поглощенная доза может быть увеличена.
Симптоматическая лучевая терапия применяется для снятия или уменьшения клинических симптомов злокачественного поражения, способных привести к быстрой гибели больного или существенно ухудшающих качество его жизни. Облучение с симптоматической целью проводится по жизненным показаниям при поражении средостения с синдромом верхней полой вены, компрессионном синдроме, обусловленным быстро растущей опухолью головного мозга, острой асфиксии, связанной с быстро растущей опухолью трахеи, первичных и метастатических опухолях, вызывающих сдавление спинного мозга, что влечет за собой нарушение функции жизненно важных органов. Она может применяться для снятия болевого синдрома, остановки кровотечения.
Противовоспалительная и функциональная лучевая терапия применяется для лечения неопухолевых заболеваний с целью ликвидации послеоперационных и раневых осложнений, воспалительных и дегенеративных заболеваний костносуставного аппарата, сопровождающихся болевым синдромом при неэффективности традиционных методов лечения (антибиотикотерапии, гормонального лечения, физиотерапии и др.). Разовая доза излучения при острых воспалительных процессах составляет ОД—0,2 Гр, суммарная — 0,3—0,6 Гр; при хроническом воспалении — 0,3-0,5 Гр и 2,5—3 Гр; при дегенеративных изменениях в суставах — 0,5—0,8 Гр и 3—4 Гр соответственно.
Лучевая терапия как компонент комбинированного лечения.
В комбинации с хирургическим лечением – может быть использована как перед операцией (для уменьшения активности опухоли, уничтожения метостазов, снизить воспаление, либо же перевести опухоль в резектабельную при её обширности), так и после (с целью антибластики, чтобы уничтожить те клетки и метастазы, которые, возможно, остались в организме). Возможна так же интраоперационная лучевая терапия.
В комбинации с химиотерапией – для потенциирования действия обоих методов (то есть химия усиливает лучевую, а лучевая – химию). Так как, во-первых, они оказывают одно и то же действие на клетки, но в разных точках приложения (на разные фазы цикла, на разные структуры клетки) = эффект в 2 раза выше, а во-вторых, некоторые клетки находятся в «спящем» состоянии (фазе G0 митотического цикла), а химиопрепараты способствует выходу их из этой фазы.
Мультимодальная терапия онкологических больных предусматривает использование современных методов хирургического, лучевого и лекарственного лечения, а также сочетание их с радиомодифицирующими воздействиями (гипертермия, гипербарическая оксигенация, электрон-акцепторные соединения, гипоксическая гипоксия и др.).
-Как выбрать объем облучения? (Распределение дозы излучения в облучаемом объеме.): есть 3 объёма облучения, которые вычисляются по порядку и в итоге позволяют получить точное место облучения, учитывая различные факторы. 1. GTV (gross tumor volume) – «валовой, примерный, грязный) объём. Это объем опухоли, который мы получили на всех методах исследования (узи, кт, мрт и тд.)
2. CTV (clinical tumor volume) – объем расширяется, так как мы знаем, что единичные клетки и их комплексы расположены вокруг опухоли, за пределами её основной массы.
3. PTV (planning tumor volume) – учитывает смещение пациента и его органов во время одного сеанса облучения, а также от сеанса к сеансу.
-Как выбрать длительность и частоту? (Распределение дозы излучения во времени): Наибольшее распространение получил режим обычного, или «классического» фракционирования, при котором к опухоли подводится разовая очаговая доза (РОД) 1,8—2 Гр. Облучение проводится один раз в день пять дней в неделю, суммарная очаговая доза (СОД) за неделю составляет 9—10 Гр. Курс лечения продолжается 1,5 месяца до подведения к опухоли канцерицидной дозы.
Разработаны и продолжают изучаться нетрадиционные варианты фракционирования: среднего (РОД —3—4 Гр), крупного (РОД — 5 Гр и более), используемые преимущественно для предоперационного облучения опухолей, отличающихся высокой злокачественностью, а также с целью паллиативного и симптоматического лечения.
Большой интерес представляют курсы лучевой терапии, предусматривающие дополнительное дробление дневной дозы на две (и более) фракции с интервалами между фракциями менее одних суток (мультифракционирование). Различают следующие разновидности мультифракционирования:
1) ускоренное(акселерированное) – когда РОД такая же, как в классике, или даже ниже, количество облучений тоже такое же, но облучения проводятся 2-3 раза в день. Следовательно, СОД будет такая же или чуть ниже, но получена быстрее. Ускоренное фракционирование применяют для облучения быстро пролиферирующих опухолей;
2) гиперфракционирование – когда РОД значительно ниже, (1 Гр), количество облучений тоже 2-3 раза в день, но зато длительность остаётся такой же. Следовательно, СОД возрастает.. Гиперфракционирование применяется для облучения медленно растущих опухолей;
3) комбинированное фракционирование представляет собой варианты мультифракционирования, имеющие признаки как гиперфракционирования, так и ускоренного фракционирования, а иногда сочетающееся с обычным фракционированием дозы.
В зависимости от наличия перерывов в облучении различают: непрерывный курс лучевой терапии, при котором заданная поглощенная доза в мишени накапливается непрерывно; расщепленный курс облучения («сплит»-курс), состоящий из двух (или нескольких) укороченных курсов, разделенных продолжительными (2—4 недели) запланированными интервалами. За время перерыва в облучении здоровые ткани восстанавливают лучевые повреждения. Опухоль уменьшается в размерах, улучшается ее кровоснабжение, ведущее к улучшению оксигенации опухолевых клеток и повышению их радиочувствительности.
Динамическое фракционирование — облучение с планируемым изменением схемы фракционирования и(или) плана облучения больного. При этом подведение крупных фракций с мультифракционированием суточной дозы может сочетаться с классическим фракционированием.
Одномоментное облучение — планируемая суммарная поглощенная доза облучения подводится к опухоли за один сеанс. Такое распределение дозы излучения используется в настоящее время при интраоперационном облучении.
-Почему вообще лучевая терапия эффективна? Почему не убивает здоровые ткани в той же степени, в какой и опухоли? От чего зависят различия в РОД, СОД, времени облучения, количестве курсов? – Закон Бергонье-Трибондо – Чем чаще клетки делятся, и чем ниже степень их дифференцировки – тем чувствительнее они к ионизирующему излучению. Следовательно – опухоль является самой чувствительной к ИИ тканью в организме. И в зависимости от того, из каких клеток состоит опухоль, выбирается РОД, СОД, время облучения, количество курсов, оптимальное для того, чтобы максимально эффективно убить эту опухоль.
Получается, что если опухоль зародилась из ткани, которая изначально чувствительна к ИИ (лимфомы, опухоли яичек и яичников) – опухоль будет вообще хорошо чувствительна. Если из той ткани, которая резистентна к ИИ (рак почек, рак ПЖ, рабдомиосаркомы и все другие опухоли из мышечной ткани) – лучевая терапия поможет мало.
Однако гистологическое строение не определяет чувствительности нормальной и патологической ткани к излучению. Одна и та же ткань в зависимости от условий по-разному реагирует на воздействие излучения. Радиочувствительность опухолей и нормальных тканей не является чем-то постоянным и меняется в зависимости от многих факторов. Благодаря успехам радиобиологии появилась возможность искусственно влиять на радиочувствительность опухолевых и нормальных клеток с помощью применения физических и химических факторов — радиомодифицирующих агентов – физические и химические факторы, способные изменить (усилить или ослабить) радиочувствительность клеток, тканей и организма в целом.
Какие есть радиомодифицирующие методы? – 1. ГБО – так как повышает метаболизм в ткане опухоли – становится еще активнее и чувствительнее к ИИ
2. ЛС – электроноакцепторные соединения (ЭАС) – они повышают чувствительность только опухолевых, гипоксичных клеток, окисляя их свободным электроном. Сюда относится метронидазол, мезонидазол.
3. Малые (сенсебилизирующие) РОД (0,1 Гр) – за 3-5 минут до главного облучения.
4. Гипертермия – нагрев СВЧ или УВЧ полем до 43-45 градусов.
Виды излучений
Для облучения злокачественных опухолей используются корпускулярное (бета-частицы — β, 138 нейтроны — η, протоны — ρ, пи-минус-мезоны) и фотонное (рентгеновское, гамма-) излучения.
В качестве источников излучения могут быть использованы естественные и искусственные радиоактивные вещества, ускорители элементарных частиц. В настоящее время в клинической практике применяются преимущественно искусственные радиоактивные изотопы, получаемые в атомных реакторах, генераторах, на ускорителях.
Вид излучения выбирается в зависимости от той глубины, на которой расположена опухоль. Для кожных опухолей – рентгеновское излучение и быстрые электроны (не заторможенные). Для более глубоких – гамма-излучение. Для совсем глубоких – тормозное излучение быстрых электронов, протонное излучение.
Способы облучения
Все существующие способы облучения делятся на наружные и внутренние. Наружное облучение подразделяют на дистанционное и контактное. Дистанционное облучение осуществляется в двух видах — статическом и подвижном. Статическое облучение может быть однопольное, двупольное встречное (однозонное, многозонное), многопольное (одно- и многозонное) с использованием формирующих устройств (защитных блоков, клиновидных фильтров, решетчатых диафрагм, болюсов, выравнивающих устройств).
Может быть подвижное и неподвижное облучение
Наружное контактное – аппликационное, при необходимости воздействия на неглубоко расположенные и неинфильтрирующие окружающие ткани опухоли. При аппликационной бета-терапии радиоактивное вещество прикладывается непосредственно к коже или слизистой оболочке или находится на расстоянии 0,5 см. Аппликационная гамма-терапия применяется при опухолевых процессах, инфильтрирующих кожу и подлежащие ткани. Глубина инфильтрации не должна быть более 2—3 см. Дистанцирование при этом должно быть от 0,5 до 5 см.
Внутреннее облучение предусматривает введение радиоактивных источников (РИ) в организм и классифицируется как лечение с помощью закрытых РИ (брахитерапия) и открытых РИ (системная терапия). Внутриполостное облучение (источник излучения находится в естественной полости тела больного) и внутритканевое облучение (источник излучения находится в тканях тела больного) осуществляется по методике афтерлоадинг, при которой последовательно вводят эндо- или интростат в полость тела или в ткани, а затем источник излучения в эндо- или в интростат.
Внутреннее облучение с использованием радиоактивного йода 1311 применяется для лечения больных с метастазами рака щитовидной железы, 89Sr (метастрон) используется при множественном метастатическом поражении костей
В настоящее время созданы возможности не только для избирательного воздействия на отдельные опухоли, но и ее клетки путем получения к ним антител, меченных РИ (радиоиммунотерапией). В частности, для лечения злокачественных лимфом получен препарат, представляющий собой меченные 131*йод моноклональные антитела к поверхностному антигену СД20, выявленному в 95% случаев В-клеточной злокачественной неходжкинской лимфомы. Это позволяет использовать лучевую терапию не только как средство локального облучения опухолей, но и как способ общего воздействия при генерализованных формах злокачественных новообразований.
Химиотерапия
Химиотерапия злокачественных опухолей — это применение в клинической практике синтетических и природных лекарственных препаратов, тормозящих пролиферацию или необратимо повреждающих опухолевые клетки.
Но большинство цитостатиков оказывает ингибирующее действие на небольшую группу опухолей, а некоторые препараты имеют исключительно узконаправленное действие только на один вид новообразований.
Классификация химиопрепаратов по происхождению разделяет цитостатики на синтетические и природные.
К синтетическим относятся алкилирующие агенты и антиметаболиты.
К природным причисляют антибиотики, вещества растительного происхождения, ферменты и гормоны.
• Алкилирующие препараты (действуют на опухолевыеклетки в любой фазе клеточного цикла): хлорэтиламины, производные этиленимина, эфиры дисульфоновых кислот, производные нитрозометилмочевины.
• Комплексные соединения платины: цисплатин, оксалиплатин, карбоплатин.
•Антиметаболиты: антагонисты фолатов, фторпиримидины, прямые ингибиторы тимидилат синтетазы, аналоги дезоксицитидина, пуриновые антагонисты.
• Противоопухолевые антибиотики и близкие к ним препараты (действуют в любой фазе клеточного цикла): актиномицины, антрациклины, антрацендионы, флеомицины, группаауреловой кислоты, прочие.
• Препараты растительного происхождения: винкалкалоиды, эпиподофиллотоксины, таксаны.
• Ферментные препараты: производные камптотецина, аспарагиназа.
• Прочие препараты: эстрамустин, митотан, метил-ГАГ,преднимустин, ATRA (общая трансретиноидная кислота).
Лекарственное лечение с использованием одного цитостатика называют монохимиотерапией, применение комбинаций из нескольких противоопухолевых препаратов — комбинированной химиотерапией или полихимиотерапией. По степени выраженности лечебного эффекта полихимиотерапия имеет ряд преимуществ перед монохимиотерапией. В известных схемах полихимиотерапии уже подобраны определенные цитостатики, равнозначные по противоопухолевой активности, но отличные по механизму действия на клеточном и молекулярном уровнях. В связи с токсичностью цитостатиков для нормальных пролиферирующих клеток в схемы комбинированной химиотерапии включают препараты с разной степенью токсичности. Возможно включение других лекарственных средств, не обладающих противоопухолевой активностью, но снимающих побочный эффект
Адъювантная (дополнительная) химиотерапия — это использование противоопухолевых препаратов после радикального хирургического удаления первичного опухолевого очага с целью уничтожения клинически неопределяемых микрометастазов опухоли.
Неоадъювантная химиотерапия — это первоочередное применение лекарственного компонента в периоде до планируемого радикального хирургического лечения.
В зависимости от способа введения цитостатиков в организм различают системную, регионарную и локальную химиотерапии.
Системная химиотерапия рассчитана на общий резорбтивный эффект, который достигается при внутривенном, внутримышечном, подкожном, ректальном введении или приеме внутрь.
При регионарной химиотерапии цитостатик вводят непосредственно в сосуды, питающие пораженный орган. Например, регионарная терапия печени, почки, щитовидной железы осуществляется по этому принципу.
Локальная химиотерапия предполагает прямой контакт цитостатика с новообразованием при нанесении на кожу, введении в серозные полости — мочевой пузырь, плевральную, брюшную полости или интратекальное введение при поражении оболочек спинного мозга.
Доза препарата подбирается строго индивидуально, учитывая массу тела, возраст, нозологию ЗНО, гистологический тип ЗНО, размер ЗНО. Доза должно попадать в терапевтический коридор и быть субмаксимальной в этом коридоре.
Соблюдение принципов проведения интермиттирующего лечения в виде циклов с интервалами, свободными от лечения, также необходимо в связи с периодом восстановления нормальных тканей (костный мозг) от токсического повреждения. Цитогенетические исследования костного мозга в сопоставлении с изменениями в периферической крови — лейкопенией и (или) тромбоцитопенией — показывают, что восстановление наступает к 21-му дню и завершается полностью к 28-му дню. Именно эти сроки (считая от первого дня предыдущего цикла) используются на практике в качестве оптимальных для повторения курсов химиотерапии.