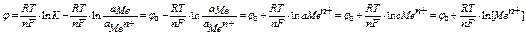электродный потенциал зависит от природы металла, активности катионов металла в растворе и температуры
работа по переносу 1 моля катионов металла из раствора на электрод рассчитывается по формуле
A = n j F,
где n - заряд катиона,
j – эдс элемента,
F – число Фарадея
работа по переносу заряда равна изменению изобарно-изотермического потенциала электрода
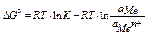 изменение изобарно-изотермического потенциала электрода рассчитывается по формуле
изменение изобарно-изотермического потенциала электрода рассчитывается по формуле
итого
уравнение Нернста для расчёта электродного потенциала
выражение при постоянной температуре – постоянная величина, зависимая от свойств металла
уравнение Нернста принимает вид
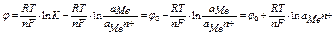 если считать, что активность металла в твердом состоянии равна единице а М =1,
если считать, что активность металла в твердом состоянии равна единице а М =1,
то уравнение Нернста принимает вид
для разбавленных растворов коэффициент активности ионов равен 1,
поэтому активность ионов равна концентрации ионов, и уравнение Нернста принимает вид
где n - заряд катиона,
F - число Фарадея F =96500 Кл/моль,
R – газовая постоянная R =8,31 Дж/моль×К,
T – абсолютная температура в К
анализ уравнения Нернста - электродный потенциал зависит от природы металла (зависит от j0),
от концентрации катионов металла в растворе,
от температуры
376) стандартный электродный потенциал
в уравнении Нернста j0 - стандартный электродный потенциал
стандартный электродный потенциал – потенциал металла на границе раздела металл-раствор соли металла,
когда активность катионов металла равна единице а Ме n+ =1
стандартный электродный потенциал измеряется в стандартных условиях в цепи с электродом сравнения
стандартные условия: 1М р-р соли, Т=25°С или Т=298°К, стандартный водородный электрод сравнения
если металлы расположить в порядке убывания их стандартных потенциалов, образуется ряд стандартных потенциалов
Li K Ca Na Mg Al Zn Fe Ni Sn Pb H Cu Hg Ag Pt Au
в ряду справа налево растут восстановительные св-ва металлов - способность отдавать е- и переходить в р-р
значение ряда стандартных потенциалов в том, что он характеризует хим.свойства металлов:
- взаимодействие металлов с кислотами с вытеснением водорода
- взаимодействие металлов с солями металлов с вытеснение неактивных металлов из растворов их солей
- порядок восстановления ионов при электролизе растворов солей
- скорость коррозии(скорость тем больше, чем больше разность потенциалов соприкасающихся металлов)
условие применения ряда стандартных электродных потенциалов – ОВ реакции в водных растворах:
электрохимический ряд напряжений отражает способность атомов образовывать в р-рах гидратированные ионы,
он зависит от соотношения энергии на разрушение кристаллической решётки,
энергии на ионизацию атома,
энергии на гидратацию иона,
поэтому Li занимает особое место из-за большой энергии гидратации иона Li+
Гальванические элементы
гальванический элемент – источник электрического тока
гальванический элемент состоит из электродов с разными электродными потенциалами
электродные потенциалы зависят от природы металла-концентрации раствора соли-температуры
ПР: элемент Якоби-Даниэля, концентрационный гальванический элемент
характеристика гальванического элемента как источника электрического тока – эдс
эдс гальванического элемента - работа сторонних сил по перемещению единичного положительного заряда
сторонние силы – неэлектрические силы в гальваническом элементе, которые вызывают электродные потенциалы
эдс цепи гальванического элемента рассчитывается по формуле
Е = j1 – j2
если учитывать диффузионный потенциал в гальваническом элементе, то эдс рассчитывается по формуле
Е = j1 – j2 + jD
если учитывать контактный потенциал между контактом медного и цинкового электродов во внешней цепи,
то эдс рассчитывается по формуле
Е = j1 – j2 + jD + j1-2
397)концентрационный гальванический элемент
такой элемент образован электродами из одного металла, погруженных в р-ры своих ионов разной активности
для разбавленных растворов коэффициент активности ионов равен 1,
поэтому активность ионов равна концентрации ионов, и можно считать, что
элемент образован электродами из одного металла, погруженных в р-ры своих солей разной концентрации
ПР: серебряные электроды в растворах соли нитрата серебра разной концентрации
у электрода в растворе более концентрированной соли будет преобладать вход катионов металла в решетку
заряд такого электрода будет (+)
у электрода в растворе менее концентрированной соли будет преобладать выход катионов металла в раствор
заряд такого электрода будет (-)
при замыкании цепи возникнут два потока зарядов
- в проводнике внешней цепи поток е- от (-)электрода к (+)электроду
- в растворе солей поток катионов и анионов в растворах солей и по солевому мостику
потенциалы на электродах и разность потенциалов будут поддерживаться
- процессом выхода катионов металла в раствор – растворением (+)электрода
- процессом входа катионов металла в кристаллическую решетку – осаждением металла на электроде
источник электрической энергии концентрационного элемента – процесс выравнивании концентрации солей





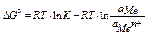 изменение изобарно-изотермического потенциала электрода рассчитывается по формуле
изменение изобарно-изотермического потенциала электрода рассчитывается по формуле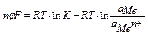
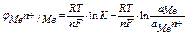
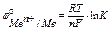
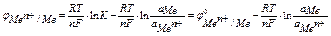
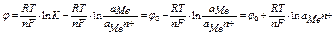 если считать, что активность металла в твердом состоянии равна единице а М =1,
если считать, что активность металла в твердом состоянии равна единице а М =1,