окислительно-восстановительные цепи имеют важное биологическое значение
ПР: цепь дыхательных ферментов в митохондриях, где каждый фермент – элемент редокс-системы
Ионоселективные электроды
ионоселективные или мембранные электроды - электроды, имеющие мембрану, у которой
снаружи исследуемый раствор и внешний вспомогательный электрод,
внутри раствор известной концентрации и внутренней вспомогательный электрод
на внешней и внутренней поверхности мембраны ионы вещества мембраны обменивается с ионами в растворах
обмен ионами происходит избирательно(селективно)
ПР: обмен ионов Na+ K+ Ca2+ Cl-
в результате определенным образом меняется концентрация определенных ионов в растворах,
что изменяет потенциал вспомогательных электродов
ПР:
393)стеклянный электрод
стеклянный электрод – вариант мембранного электрода, избирательного к ионам Na+ и Н+
электрод состоит из стеклянного сосуда, заполненного р-ром электролита, например, раствором 0,1М HCl
в растворе вспомогательный хлорсеребряный электрод AgCl
обычное стекло=сплав соды-известняка-песка ® Na2O*CaO*6SiO2
на внешней поверхности стекло в воде подвергается гидролизу
на внешней поверхности катионы Na+ обмениваются на ионы Н+ внешнего раствора
на внешней поверхности стекла образуется пленка геля поликремниевой кислоты
поликремниевая кислота – слабый электролит
R-O-Si-OH Û R-O-Si-O- + H+
|| ||
O O
кислотные анионы остаются в стекле, катионы H+ образуют в растворе у поверхности стекла слой катионов
двойной электрический слой образует электрическое поле и скачок потенциалов
на внутренней поверхности стекло в воде подвергается гидролизу..
итак, образуются два двойных электрических слоя – наружный и внутренний
если слой стекла тонкий, то можно считать, что у этих двойных слоев слой ионов в стекле общий
поэтому кроме «скачков потенциалов» наружная поверхность-стекло, стекло-внутрення поверхность
можно говорить о «скачке потенциалов» наружная поверхность-внутрення поверхность
слоем ионов внутри стекла можно пренебречь
для тонкой стеклянной мембраны потенциал внешней поверхности рассчитывается по уравнению Нернста
активность ионов внутренней поверхности влияет на потенциал внутреннего электрода сравнения
различают ионоселективные электроды по агрегатному состоянию мембраны
- твердые мембраны
ПР: стеклянный электрод
- жидкие мембраны
ПР: мембраны из хлорбензола, толуола
394)ферментные электроды.есть ферментные ионоселективные электроды, мембраны которых содержат ферменты
ферменты запускают специфические реакции определенных веществ с образованием определенных ионов,
а мембраны обменивают определенные ионы, что изменяет потенциал вспомогательных электродов
ферментные ионоселективные электроды позволяют обнаружить определенные вещества
ПР: мембрана, содержащая уреазу
уреаза катализирует реакцию превращения мочевины в ион аммония
мембрана селективна к ионам аммония
381)классификация электродов
есть классификация электродов по механизму возникновения потенциала
- ионно-металлические
причина «скачка потенциалов» – обмен ионами на границе металл-раствор электролита
ПР: цинковый электрод в растворе соли
- редокс-электроды
причина «скачка потенциалов» – обмен е- на границе металл-раствор электролита в ходе ОВ реакций
ПР: платиновая пластинка в растворе ионов Fe3+ и Fe2+
- мембранные
причина «скачка потенциалов» – обмен ионами на границе мембрана-раствор электролита
ПР: стеклянный электрод
382)электроды I, II рода
ионно-металлические электроды делятся на электроды I рода и электроды II рода
- электроды I рода
потенциал электродов I рода определяется превращением одного вида ионов
обратимы относительно одного вида ионов
ПР: цинковый электрод в растворе соли, водородный электрод
- электроды II рода
потенциал электродов II рода определяется превращением двух видов ионов
обратимы относительно двух видов ионов раствора
ПР: хлорсеребряный электрод
электроды определения
электроды, используемые для определения ионов - электроды определения
например, если потенциал электрода зависит от концентрации ионов Н+, то электрод служит для определения рН
ПР: потенциал водородного электрода
при высокой концентрации ионов Н+ (при рН>7) электрод зарядится (+)
при низкой концентрации ионов Н+ (при рН<7) электрод зарядится (-)
 потенциал водородного электрода рассчитывают по формуле
потенциал водородного электрода рассчитывают по формуле
ПР: стеклянный электрод
стеклянный электрод – вариант ионоселективного электрода - избирательны к ионам Na+ и Н+
электрод состоит из стеклянного сосуда, заполненного р-ром с Н+, например, раствором 0,1М HCl
в растворе вспомогательный хлорсеребряный электрод AgCl
обычное стекло=сплав соды-известняка-песка ® Na2O*CaO*6SiO2
на внешней поверхности стекло в воде подвергается гидролизу
на внешней поверхности катионы Na+ обмениваются на ионы Н+ внешнего раствора
на внешней поверхности стекла образуется пленка геля поликремниевой кислоты
поликремниевая кислота – слабый электролит
R-O-Si-OH Û R-O-Si-O- + H+
|| ||
O O
кислотные анионы остаются в стекле, катионы H+ образуют в растворе у поверхности стекла слой катионов
двойной электрический слой образует электрическое поле и скачок потенциалов
на внутренней поверхности стекло в воде подвергается гидролизу..
итак, образуются два двойных электрических слоя – наружный и внутренний
если слой стекла тонкий, то можно считать, что у этих двойных слоев слой ионов в стекле общий
поэтому кроме «скачков потенциалов» наружная поверхность-стекло, стекло-внутрення поверхность
можно говорить о «скачке потенциалов» наружная поверхность-внутрення поверхность
слоем ионов внутри стекла можно пренебречь
для тонкой стеклянной мембраны потенциал внешней поверхности рассчитывается по уравнению Нернста
активность ионов H+ внешней поверхности влияет на потенциал внешнего электрода сравнения
активность ионов H+ внутренней поверхности влияет на потенциал внутреннего электрода сравнения
активность ионов H+ внешней поверхности зависит от рН исследуемого раствора
в итоге, потенциал внутреннего вспомогательного электрода зависит от рН исследуемого раствора
этот потенциал измеряется в цепи с внешним вспомогательным электродом – электродом сравнения
стеклянным электродом пользуются при рН от 2 до 12
перед работой стеклянные электроды калибруют по растворам с известным рН
399)потенциометрическое титрование, кривая титрования, определение точки эквивалентности.Точка эквивалентности.
потенциометрия – метод измерения электродных потенциалов
для измерения электродных потенциалов из двух разных электродов собирают гальванический элемент
гальванический элемент включают в электрическую цепь и измеряют эдс
в качестве второго электрода используют электрод сравнения
различают прямой метод измерения и косвенный метод измерения
при прямом методе используют окислительно-восстановительные электроды
косвенный метод применяют, если металл электрода реагирует с водой..
при косвенном методе используют ионоселективные электроды
значение потенциометрии:
- потенциометрия применяется для определения рН, концентрации электролитов..
- потенциометрия применяется для потенциометрического титрования
достоинство кондуктометрического титрования – титрование без индикаторов
ПР: титрование мутных или окрашенных растворов
для ациди-алкалиметрии используют стеклянный электрод
для оксидиметрии используют редокс-электрод
 кривая титрования
кривая титрования
Е

V
точка эквивалентности – точка перегиба кривой





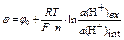
 потенциал водородного электрода рассчитывают по формуле
потенциал водородного электрода рассчитывают по формуле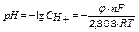
 кривая титрования
кривая титрования


