Рахит (D-дефицитный, классический) — многофакторное заболевание, которое характеризуется нарушениями фосфатно-кальциевого обмена и минерализации костной ткани. В 2016 г. принят Глобальный консенсус по профилактике и лечению рахита алиментарной этиологии, который дает определение рахиту как нарушению дифференцировки хондроцитов, минерализации зон роста и остеоида у детей, вызванное дефицитом витамина D и/или недостаточным поступлением кальция и/или фосфатов. При рахите патологический процесс локализуется главным образом в метафизарных зонах костей, причем костные проявления рахита наиболее выражены у детей первых 2–3 лет жизни. Одним из основных патогенетических факторов рахита является недостаточное образование в коже витамина D, а также поступление с пищей витамина D, кальция, фосфатов и других необходимых для образования костной ткани минеральных элементов, особенно меди, цинка, витаминов группы В и аскорбиновой кислоты. Помимо алиментарного фактора, нарушению развития костной ткани способствуют незрелость и гетерохрония развития (дисфункция) эндокринных желез, различные соматические заболевания, протекающие с мальдигестией и мальабсорбцией, и т.д. Важными звеньями патогенеза рахита являются изменения фосфатно-кальциевого обмена, связанные с нарушением метаболизма в почках, кишечнике, костной ткани. В тяжелых случаях рахита развивается остеопороз, нарушаются процессы ремоделирования кости. Клиническая манифестация рахита, как правило, встречается в весеннее и зимнее время года, особенно у детей, родившихся с октября по апрель, проживающих в регионах с недостаточной инсоляцией, частыми туманами, облачностью или в районах экологического неблагополучия. Предрасполагающими к развитию рахита факторами являются высокие темпы роста ребенка в первые месяцы жизни; наличие белково-энергетической недостаточности, недоношенности, задержки внутриутробного развития, морфофункциональной незрелости; исключительно грудное вскармливание без дотации холекальциферола.
Выделены группы риска по развитию рахита
| Фоновые состояния
| Вследствие патологии
|
| Отягощенная наследственность по нарушениям фосфатнокальциевого обмена.
Недоношенность. Морфофункциональная незрелость Внутриутробная гипотрофия
Многоплодная беременность; повторные роды с малыми промежутками между ними.
Вскармливание неадаптированными смесями
Снижение двигательной активности (тугое пеленание, длительная иммобилизация)
Недостаточная инсоляция Смуглая кожа Заболевания эпидермиса
| Синдром мальабсорбции (целиакия, гастроинтестинальная форма пищевой аллергии, экссудативная энтеропатия и др.) Применение антиконвульсантов у детей с судорожным синдромом
Хроническая патология почек, печени, желчевыводящих путей
Частые респираторные заболевания
|
Клиническая симптоматика и лабораторные показатели в различные периоды рахита
| Степень тяжести
| Клиническая симптоматика
| Биохимические показатели
| Данные R-графии
|
| I. Легкая
| Признаки остеомаляции: податливость краев большого родничка и швов черепа (краниотабес)
| Кальций крови в норме, фосфор крови в норме или слегка снижен, ЩФ крови может быть незначительно повышена
| Обычно отсутствуют, но может определяться остеопения
|
| II. Среднетяжелая
| Признаки остеоидной гиперплазии: деформация черепа (лобные и теменные бугры), грудной клетки (четки), конечностей (браслетки). Мышечная гипотония. Формирование варусной или вальгусной деформации нижних конечностей, когда дети начинают вставать
| Умеренная гипокальциемия, выраженная гипофосфатемия, значительное повышение уровня ЩФ крови
| Расширение и неровность метафизарной щели, бокаловидные деформации эпиметафизарных отделов костей, нечеткость ядер окостенения. Остеопения или остеопороз, грубый трабекулярный рисунок диафизарных отделов. Рахитический метафиз
|
| III. Тяжелая
| Выраженные признаки остеоидной гиперплазии: тяжелые деформации скелета. Мышечная гипотония. Позднее становление статических функций. Полиорганная дисфункция
| Выраженные гипокальциемия и гипофосфатемия; сохраняется значительное повышение активности ЩФ
| Рахитический метафиз; переломы по типу «зеленой веточки»; остеопороз
|
| Примечание. ЩФ — щелочная фосфатаза.
|
Рентгенологическое исследование не должно использоваться рутинно: оно проводится с целью дифференциально-диагностического поиска. В настоящее время, учитывая современные представления о фосфорно-кальциевом гомеостазе и метаболизме витамина D, а также с точки зрения клинической целесообразности и практического опыта, необходимо использовать следующую классификацию рахита у детей раннего возраста
| Степень тяжести
| Период заболевания
| Течение
|
| Рахит легкий I степени
Рахит средней тяжести II степени
Рахит тяжелый III степени
| Разгар
Реконвалесценция
Остаточные явления
| Острое
Подострое
Рецидивирующее
|
Выделение начального периода рахита неоправданно, так как клиническая картина при этом включает неспецифические докостные проявления, которые сегодня должны рассматриваться как синдром вегетовисцеральной дисфункции у детей раннего возраста.
Клиническая картина и диагностика рахита. Для диагноза рахита I степени обязательным является наличие костных изменений: податливость при пальпации костей черепа, краниотабес, утолщения на ребрах в местах перехода хряща в кость — «четки», умеренная гипотония мышц. Выявление только симптомов нарушения вегетативной деятельности (потливость, беспокойство, раздражительность) не является основанием для диагноза, как это было принято ранее. Рахит II степени тяжести характеризуется выраженными проявлениями остеомаляции и остеоидной гиперплазии: лобные и теменные бугры, «четки», деформации грудной клетки с расширением нижней апертуры грудной клетки и втяжением ребер — «гаррисонова борозда»; умеренная, чаще варусная деформация нижних конечностей, а также выраженная гипотония мышц — «лягушачий» живот. Рахит III степени (тяжелый) характеризуется грубыми деформациями черепа (западение переносицы, «олимпийский лоб»), грудной клетки («куриная грудь», «грудь сапожника»), позвоночника (рахитический кифоз); утолщением эпифизов костей предплечья («рахитические браслеты») и фаланг пальцев («нити жемчуга»), нижних конечностей (Х- или О-образные); нарушаются время и порядок прорезывания зубов, возможны переломы костей, выраженная мышечная гипотония, увеличение в объеме живота («лягушачий живот»), задержка в развитии статических функций.Внекостные проявления рахита вследствие дефицита кальция развиваются вместе с костными симптомами: снижение мышечного тонуса, гиперрефлексия, мышечные спазмы, спазмофилия, ларингоспазм, удлинение интервала QT на электрокардиограмме. Внекостными признаками гипофосфатемии являются кардиомиопатия, дыхательная недостаточность, дисфункция эритроцитов, дисфункция лейкоцитов, деминерализация кости, метаболический ацидоз, признаки энцефалопатии. В зависимости от причины развития рахитического процесса выделяют три формы заболевания — кальцийдефицитный, фосфатдефицитный и витамин D-дефицитный рахит. Причинами дефицита кальция и развития кальцийдефицитного состояния является, прежде всего, недостаток кальция в пище, особенно при длительном кормлении детей грудным молоком, нарушении всасывания кальция при синдроме мальабсорбции. Фосфатдефицитный рахит может развиваться не только вследствие недостаточного поступления фосфатов как главной причины метаболической болезни костной ткани у недоношенных, но и при повышенной потребности в фосфатах в условиях быстрого роста, нарушении всасывания в кишечнике, а также у детей, находящихся на полном парентеральном питании. В настоящее время нарушения метаболизма фосфатов в значительной степени связывают с изменением фактора роста фибробластов 23 (FGF23), внеклеточным фосфогликопротеином матрикса и другими метаболитами, известными как фосфатонины. Экзо- или эндогенный дефицит витамина D как модулятор обмена фосфатов и кальция также приводит к развитию рахита. В случае дефицита витамина D возможны вторичные нарушения обмена кальция и фосфатов, которые и определяют характер клинических, биохимических и рентгенологических проявлений. Течение рахита может быть острым, подострым и рецидивирующим. Острое течение отмечается у быстрорастущих детей первого полугодия жизни и характеризуется преобладанием остеомаляции над процессами остеоидной гиперплазии, интенсивным нарастанием симптомов. Подострое течение чаще наблюдается у детей с внутриутробной или постнатальной гипотрофией, у недоношенных детей или младенцев, получивших недостаточную дозу витамина D; отличается более медленным развитием симптомов болезни и преобладанием процессов остеоидной гиперплазии над остеомаляцией. Рецидивирующее течение характеризуется чередованием клинического улучшения и обострения процесса на фоне различных соматических заболеваний, нарушения вскармливания младенцев, дефектов ухода и др. Отсутствие противорецидивной терапии приводит к непрерывному прогрессированию рахита. Диагноз рахита не должен основываться на таких патологических симптомах, как позднее прорезывание зубов, позднее закрытие большого родничка, задержка статикомоторного развития.
Анте- и постнатальная профилактика рахита. Антенатальная профилактика рахита. Женщинам, готовящимся к зачатию, желательно получать витамин D в дозе 600–800 МЕ/сут. Решение о назначении более высоких доз витамина D необходимо принимать на основании определения его концентрации в крови. Гиповитаминоз D подлежит обязательной коррекции. Согласно клиническим рекомендациям Российской ассоциации эндокринологов, для поддержания уровня 25(ОН)D более 30 нг/мл может потребоваться потребление не менее 1500–2000 МЕ витамина D в сутки. Рекомендации по антенатальной профилактике рахита представлены в национальной программе «Недостаточность витамина D у детей и подростков РФ: современные подходы к коррекции» (2017). Основные запасы кальция и витамина D в организме плода формируются в последнем триместре беременности. Наиболее активным становится трансплацентарный транспорт холекальциферола и 25(ОН)D, а скорость отложения кальция составляет около 130 мг/сут. Соответственно, важной задачей профилактики рахита у ребенка является организация рационального питания будущей матери, обеспечивающая достаточное поступление кальция, фосфора, витамина D. Лучшим пищевым источником кальция являются молочные продукты (сыр, молоко, кефир, йогурт, творог). Целесообразно использовать специальные молочные напитки, предназначенные для беременных и кормящих женщин, имеющие сбалансированный состав по основным макро- и микронутриентам и обогащенные витаминами. При их отсутствии можно рекомендовать курсовой прием витаминно-минеральных комплексов. Следует отметить, что возрастающая потребность в кальции при беременности удовлетворяется за счет значительного повышения его абсорбции в кишечнике будущей матери. Исключение составляют ситуации, когда у женщины еще до беременности определялся дефицит кальция. В таких случаях возможно рекомендовать дополнительно 300 мг кальция ежедневно на протяжении всего срока беременности и лактации. Необходимость достаточного обеспечения беременной женщины витамином D определяется тем, что плод полностью зависит от количества холекальциферола и 25(ОН)D, поступающего от матери. При этом только в условиях достаточного количества 25-гидроксихолекальциферола может происходить синтез кальцитриола плацентой и почками плода для удовлетворения его потребностей. Обоснованной является рекомендация беременным женщинам принимать препараты витамина D в дозе 2000 МЕ в течение всей беременности. В ряде исследований показана целесообразность приема поливитаминно-минеральных комплексов в течение преконцептуального периода и беременности. Использование комплексных добавок имело более выраженное отдаленное положительное влияние на когнитивные функции детей по сравнению с добавлением только железа и фолиевой кислоты. Опасения относительно избыточной прибавки в массе тела беременных женщин на фоне приема витаминно-минеральных комплексов не нашли подтверждения. Постнатальную профилактику рахита можно разделить на неспецифическую и специфическую. Неспецифическая профилактика включает в себя правильное формирование режима дня ребенка, достаточное пребывание его на свежем воздухе, ежедневный массаж и гимнастику, широкое пеленание для обеспечения достаточной двигательной активности. Только лишь инсоляция не может обеспечивать адекватную профилактику гиповитаминоза D. Правильное питание ребенка и дотация препаратов холекальциферола наиболее важны для профилактики рахита. В настоящее время продолжительное естественное вскармливание расценивается в качестве одного из основных факторов риска развития рахита у детей в связи с тем, что в женском молоке содержание витамина D недостаточно (не более 50–60 МЕ/л) для того, чтобы обеспечить профилактику заболевания у младенца. Назначение холекальциферола детям, находящимся на грудном вскармливании, является единственно возможным механизмом профилактики рахита. Искусственное вскармливания также требует дотации витамина D. При введении прикорма источником витамина D служат каши промышленного производства, обогащенные витаминно-минеральным комплексом (в том числе кальцием и витамином D). Необходимо своевременное введение в рацион творога и кисломолочных напитков, наиболее богатых легкоусвояемым кальцием, а также яичного желтка, содержащего жирорастворимые витамины (в 10 г яичного желтка содержится в среднем 30 МЕ витамина D). Специфическая профилактика рахита заключается в адекватном обеспечении ребенка витамином D, что необходимо как для обеспечения оптимального фосфорно-кальциевого обмена, так и внекостных эффектов витамина D (иммунные механизмы, профилактика острых и хронических заболеваний). Для профилактики D-гиповитаминоза рекомендуются дозы витамина D в зависимости от возраста, изложенные в национальной программе «Недостаточность витамина D у детей и подростков Российской Федерации: современные подходы к коррекции». Данные современных фундаментальных и клинических исследований демонстрируют, что повсеместно используемые нормы рекомендованного суточного потребления витамина D для детей (400–500 МЕ/сут) существенно занижены. По результатам повозрастного анализа предложена ступенчатая схема назначения витамина D: для детей в возрасте до 4 мес рекомендуется ежедневный прием 500 МЕ/сут (для недоношенных — 800–1000 МЕ/сут), в возрасте от 4 мес до 4 лет — 1000 МЕ/сут, 4–10 лет — 1500 МЕ/сут, 10–16 лет — 2000 МЕ/сут витамина в течение года. При этом достигается эффективная компенсация дефицита витамина D (концентрация 25(OH)D >20 нг/мл), а также, по некоторым данным, снижение риска развития инфекционных и аллергических заболеваний. Показана безопасность рекомендуемого режима приема витамина D. В настоящее время в Российской Федерации для профилактики и лечения рахита используются препараты витамина D
| Препарат
| Действующее вещество
| Форма выпуска и дозы
|
| Аквадетрим
| Холекальциферол (D3)
| Водный раствор, 1 капля — 500 МЕ
|
| Вигантол
| Холекальциферол (D3)
| Масляный раствор, 1 капля — 500 МЕ
|
| Минисан капли (Minisun Drops)
| Холекальциферол (D3)
| Масляный раствор 1 капля — 100 МЕ
|
| Д3-Капелька
| Холекальциферол (D3)
| Водный раствор, 1 капля — 200 МЕ
|
Дети с малым размером большого родничка не имеют противопоказаний к профилактическому назначению витамина D, если сохраняются возрастные темпы роста окружности головы. Профилактика недостаточности витамина D проводится круглогодично, непрерывно, включая летние месяцы. Нарушения метаболизма костной ткани (остеопения/ метаболическая болезнь костей) новорожденных, и особенно недоношенных детей,— проявление незрелости и недостаточной минерализации костной ткани при быстрых темпах роста, что является результатом дисбаланса в обеспеченности фосфатом и кальцием, поэтому такие состояния нельзя называть рахитом недоношенных. С целью профилактики остеопенических состояний у недоношенных детей, получающих грудное молоко, используются обогатители грудного молока (белкововитаминно-минеральные комплексы), а при искусственном — специализированные смеси, содержание кальция и фосфатов в которых адаптировано в соответствии с потребностями детей, родившихся раньше срока. Несмотря на первостепенную роль кальция и фосфатов в профилактике рахита у недоношенных детей, их всасывание из грудного молока, смесей или препаратов зависит от адекватного обеспечения витамином D. Ежедневный прием витамина D для детей, родившихся раньше срока, составляет 800–1000 МЕ, начиная с 2-недельного возраста и до 1 года (Национальная программа по оптимизации обеспеченности витаминами и минеральными веществами детей России, 2017). Поскольку профилактические дозы витамина D в зависимости от гестационного возраста не установлены, для оценки обеспеченности ребенка холекальциферолом показано определение 25(ОН)D в сыворотке крови. Лечение рахита. Для эффективного лечения рахита назначается комплекс мероприятий по нормализации режима дня ребенка с достаточной инсоляцией, обеспечение его полноценным сбалансированным питанием. Лечение рахита препаратами витамина D может быть эффективным только при условии адекватного поступления кальция и фосфатов в организм ребенка с учетом его физиологической потребности. Рекомендации по терапевтическим дозам витамина D в зависимости от тяжести рахита
| Период рахита и степень тяжести
| Суточная доза витамина D
|
| I степень период разгара
| 2000 МЕ/сут — 30 дней
|
| II степень период разгара
| 2500 МЕ/сут — 45 дней
|
| III степень период разгара
| 3000 МЕ/сут — 45 дней
|
| После проведенного курса лечения рахита доза витамина D постепенно снижается до профилактической, которая назначается длительно, непрерывно.
|
Для уточнения доз витамина D при лечении рахита необходимо проведение дополнительных исследований по выявлению гиповитаминоза D. Надежным критерием обеспеченности детского организма витамином D является содержание 25(ОН)D в сыворотке крови: адекватный уровень — более 30 нг/мл; недостаточность — 30–21 нг/мл; дефицит — менее 20 нг/мл; авитаминоз — менее 10 нг/мл. Рекомендации по лечебным дозам витамина D в зависимости от уровня 25(ОН)D в сыворотке крови в соответствии национальной программой «Недостаточность витамина D у детей и подростков Российской Федерации: современные подходы к коррекции» (2017)
| Уровень 25(ОН)D в сыворотке крови
| Лечебная доза
| Лечебная доза для Европейского Севера России
|
| 20–30 нг/мл
| 2000 МЕ/сут — 1 мес
| 2000 МЕ/сут — 1 мес
|
| 10–20 нг/мл
| 3000 МЕ/сут — 1 мес
| 3000 МЕ/сут — 1 мес
|
| Менее 10 нг/мл
| 4000 МЕ/сут — 1 мес
| 4000 МЕ/сут — 1 мес
|
Контроль возможной передозировки холекальциферола следует проводить по уровню кальция в суточной моче (не более 2 мг/кг в сутки). Реакция Сулковича не имеет диагностической ценности, поэтому использовать ее в практике не рекомендуется. Повышение уровня 25(ОН)D до 80–100 нг/мл не означает гипервитаминоза, но такой уровень требует коррекции дозы холекальциферола. Уровень с возможным проявлением токсичности — концентрация 25(ОН)D более 100 нг/мл, абсолютно токсичный уровень — концентрация 25(ОН)D более 200 нг/мл. Положительный терапевтический эффект достигается только при комплексном подходе: при оптимизации вскармливания ребенка, сбалансированном поступлении солей кальция, фосфора и витамин D-терапии, а также при использовании естественных общеоздоровительных мероприятий (массаж, лечебная гимнастика, прогулки, водные процедуры). При отсутствии эффекта от указанных лечебных доз витамина D диагноз должен быть уточнен путем более углубленного обследования в стационаре (включая рентгенографию нижних конечностей), так как речь может идти о наследственно обусловленных формах рахита, называемых рахитоподобными заболеваниями, генетически детерминированными остеопатиями или витамин D-резистентными формами рахита: это наследственный гипофосфатемический витамин D-резистентный рахит, почечный тубулярный ацидоз, болезнь де Тони–Дебре–Фанкони, витамин D-зависимый рахит и др. О резистентных формах рахита педиатр должен помнить: если отягощен семейный анамнез по аналогичным заболеваниям; заболевание прогрессирует клинически с развитием деформаций костной системы (рахит III степени), несмотря на коррекцию питания и применение лечебных доз витамина D по 1500–2000 МЕ в течение 1 мес; заболевание сопровождается отставанием в физическом развитии (прежде всего в росте).Контрольные вопросы:1. Назовите основные причины и предрасполагающие факторы рахита. 2. Опишите основные клинические симптомы рахита в зависимости от степени тяжести заболевания. 3. В чем заключается антенатальная и постнатальная профилактика рахита?
Анемия – патологическое состояние, характеризующееся снижением содержания гемоглобина, часто в сочетании с уменьшением количества эритроцитов в единице объема крови. Выделяют три группы анемий: 1) вследствие кровопотерь (постгеморрагические); 2) в результате снижения активности эритропоэза; 3) при усиленном разрушении эритроцитов (гемолитические). В детском возрасте наиболее часто встречаются анемии, связанные с дефицитами веществ, необходимых для формирования эритроцитов, – в первую очередь железа, реже – витамина В12, фолиевой кислоты, белков, меди, кобальта.
Железодефицитные состояния (ЖДС) включают железодефицитную анемию и предшествующий ей латентный дефицит железа, относятся к наиболее распространенным алиментарно-зависимым состояниям в детском возрасте. По данным экспертов ВОЗ, железодефицитной анемией страдают около 2 млрд людей на земле; 43% детей имеют дефицит железа. Дефицит железа — это состояние, при котором железа недостаточно для поддержания нормальных физиологических функций органов и тканей (кровь, мозг, мышцы). Он достаточно долго, в течение многих недель и месяцев, может существовать и без анемии, не вызывая падения концентрации гемоглобина. Латентный дефицит железа — состояние, предшествующее анемии, при котором имеется скрытый дефицит железа с характерным снижением его запасов в депо и тканях (сидеропения, гипосидероз) при нормальных значениях концентрации Hb. Железодефицитная анемия (ЖДА) — полиэтиологичное заболевание, связанное с дефицитом железа в организме из-за нарушения его поступления, усвоения или повышенных потерь, характеризуемое микроцитозом и гипохромией.
В настоящее время признано, что длительный (свыше 3 мес) дефицит железа с анемией или без нее у детей раннего возраста приводит к задержке моторного и речевого развития, психологическим и поведенческим нарушениям, нарушениям иммунного статуса и формирования когнитивных функций (сосредоточение, внимание, память). По мнению экспертов ВОЗ, основной причиной развития ЖДС и ЖДА у детей грудного и раннего возраста является недостаточное потребление железа вследствие несбалансированного питания. ЖДА может развиться из-за кровотечений различных локализаций или глистных инвазий. Причинами возникновения ЖДС и ЖДА также являются отравления (свинцом и др.), хронические заболевания, синдром мальабсорбции, гемоглобинопатии. Этиология. Причины развития железодефицитных состояний разнообразны и делятся на анте-, интра- и постнатальные. Первоначальные запасы железа у ребенка создаются благодаря его поступлению через плаценту от матери. Этот процесс происходит на протяжении всей беременности, но наиболее интенсивнее отложение материнского железа в депо плода наблюдается с 28–32-й недели гестации. В связи с этим у недоношенных детей запас железа значительно снижен. Кроме недоношенности к недостаточному накоплению железа в организме плода приводят нарушения маточно-плацентарного кровотока и плацентарная недостаточность (тяжелые гестозы, угроза прерывания беременности, заболевания матери), многоплодная беременность, анемия матери. Причинами интранатального дефицита являются кровотечения вследствие травматических акушерских пособий, аномалий развития плаценты или сосудов пуповины, поздняя или преждевременная перевязка пуповины. Постнатальные железодефицитные состояния развиваются при недостаточном поступлении железа с пищей; повышенных потребностях в железе у детей с ускоренными темпами роста; избыточных потерях железа. Недостаточное поступление железа с пищей, как правило, связано с ранним искусственным вскармливанием, нерациональным питанием, преобладанием в рационе мучной, молочной или растительной пищи. Повышенные потребности в железе возникают у недоношенных детей или новорожденных с большой массой тела при рождении, у детей второго полугодия и 2-го года жизни в пре-и пубертатном возрасте. Избыточные потери железа связаны с нарушениями процессов его кишечного всасывания или кровотечениями различной этиологии (инвазии кровососущих глистов, обильные и длительные маточные выделения у девочек в период становления менструального цикла в пубертате и др.). Патогенез. Развитие дефицита железа в организме проходит несколько стадий, среди которых выделяют прелатентный дефицит железа, латентный дефицит и железодефицитную анемию. Прелатентный дефицит характеризуется истощением запасов железа в паренхиматозных органах, мышцах, костном мозге. Уровень гемоглобина остается в пределах нормы. Клинические проявления дефицита железа отсутствуют. Преданемическое состояние выявляют с помощью инструментально лабораторных исследований, не применяющихся в повседневной практике. Латентный дефицит железа – 2-я стадия железодефицитного состояния, при которой снижается содержание сывороточного железа, появляется клиническая симптоматика. Количество гемоглобина остается в пределах нижней границы нормы. Анемия – заключительная стадия дефицита железа. Она развивается, когда исчерпаны основные его запасы в организме. Снижение железа в сыворотке крови и в костном мозге нарушает процесс образования гемоглобина. Синтезируются мелкие, неполноценные эритроциты, содержащие мало гемоглобина. Длительный дефицит железа нарушает образование миоглобина, а также целого ряда тканевых ферментов. При этом ухудшаются процессы доставки к тканям кислорода и удаления из них углекислого газа. Развивается тотальная органная патология, в результате которой нарушается деятельность практически всех органов и систем. Клиническая картина. Клинические проявления железодефицитных состояний зависят от степени и стадии дефицита железа, а также от продолжительности его существования. Латентный дефицит железа проявляется сидеропеническим синдромом, который включает: изменения со стороны эпителия, астеновегетативные нарушения, снижение местного иммунитета. Эпителиальный синдром характеризуется трофическими изменениями кожи, ногтей, волос и слизистых оболочек. У больных появляется бледность кожных покровов и слизистых оболочек. Она особенно выражена на ушных раковинах, ладонях, подошвах, ногтевых ложах. Кожа – сухая и шершавая. В углах рта возникают трещины. Волосы – жесткие, ломкие, сухие, напоминают щетку, обильно выпадают. Истончаются и ломаются ногти. Они принимают ложкообразную форму. Сглаживаются сосочки языка, при тяжелой анемии он становится полированным. Извращается вкус и обоняние – дети охотно 339 поедают мел, глину, уголь, сухие макаронные изделия; развивается пристрастие к резким, часто неприятным запахам – лакам, краскам, бензину. Поражение слизистых оболочек приводит к частым ринитам, стоматитам, кариесу, гастриту, дуодениту. Астеновегетативные нарушения проявляются изменением эмоционального тонуса – ребенок становится плаксивым, раздражительным, капризным. Отмечается апатия, вялость, повышенная утомляемость, при длительном дефиците железа – отставание в психомоторном развитии. У школьников возможны мозговые расстройства – головная боль, головокружение, обмороки. Синдром снижения иммунитета проявляется повышенной заболеваемостью острыми респираторными и кишечными инфекциями, ранним возникновением хронических очагов инфекции. При развитии железодефицитной анемии к сидеропеническому синдрому присоединяются изменения со стороны сердечно-сосудистой системы – тахикардия, приглушенность тонов сердца, систолический шум, гипотония, одышка. Разнообразие клинических проявлений и отсутствие патогномоничных признаков создают определенные сложности в своевременной диагностике ЖДС в педиатрической популяции, особенно у детей раннего возраста, поэтому решающее значение приобретают лабораторные исследования. Нижние пороговые значения гемоглобина для детей различного возраста, согласно рекомендациям ВОЗ
| Возрастная группа
| Концентрация гемоглобина, г/л
|
| 0–14 дней
| <145
|
| 15–28 дней
| <120
|
| 1 мес–5 лет
| <110
|
| 6–11 лет
| <115
|
| 12–14 лет
| <120
|
В зависимости от концентрации Hb выделяют три степени тяжести ЖДА
| Степень тяжести
| Концентрация гемоглобина, г/л
|
| Легкая
| <110
|
| Средняя
| <90
|
| Тяжелая
| <70
|
Критериями диагностики ЖДС, согласно федеральным клиническим рекомендациям по диагностике и лечению железодефицитной анемии (2014), являются следующие показатели:
Для верификации ЖДА, помимо клинических признаков сидеропении, необходимо определение запасов железа в организме. Т.О. минимальный объем исследований, необходимый для диагностики ЖДА включает развернутый клинический анализ крови и определение содержания (ФС) Сывороточный ферритин < 30 нг/мл, (ЖС) Сывороточное железо < 12,5 мколь/л и (ОЖСС) Общая железосвязывающая способность сыворотки >69 мкмоль/л. Сывороточный ферритин на сегодня считается общепризнанным маркером обеспеченности железом: он прямо пропорционален накоплению железа в макрофагах и гепатоцитах, если при этом нет инфекции или воспалительного процесса. Его снижение имеет 100% специфичность для состояния дефицита железа.
Лечение. Терапия железодефицитных состояний должна быть комплексной и предусматривать устранение причины, вызвавшей заболевание, лекарственное восполнение дефицита железа и восстановление его запасов, рациональное питание с достаточным содержанием белков, витаминов, железа и других микроэлементов. В зависимости от содержания железа пищевые продукты делят на богатые железом (в 100 г продуктов – более 5 мг железа): печень, толокно, желток; умеренно богатые (в 100 г продуктов – от 1 до 4–5 мг железа) – куриное мясо, говядина, крупы овсяная, пшеничная, гречневая, яблоки; бедные (в 100 г продуктов – менее 1 мг железа) – морковь, клубника, виноград, молоко.Диета при анемии должна включать продукты, богатые железом, медью, кобальтом, никелем и марганцем: толокно, гречневую и овсяную крупы, свеклу, кабачки, зеленый горошек, капусту, картофель. Из соков предпочтение отдается вишневому, гранатовому, лимонному, свекольному, яблочному (из кислых сортов яблок). В 1-м полугодии жизни рекомендуется более раннее введение тертого яблока, яичного желтка, овощного пюре, каш, во втором – пюре из мяса и печени. Однако при составлении рациона необходимо учитывать, что усвоение железа зависит от формы, в которой оно находится. Железо в составе гема активно всасывается и усваивается. В такой форме оно содержится в говядине, индюшатине, мясе кролика и курицы. Железо в негемовой форме усваивается значительно хуже (печень, рыба, злаковые, бобовые, овощи, фрукты). Всасывание негемового железа усиливают аскорбиновая кислота, продукты из мяса, птицы, рыбы, снижают – чай, кофе, орехи, бобовые. В питании детей, страдающих анемией, следует ограничивать молочные продукты, так как они содержат кальций и фосфор, образующие с железом комплексы, выпадающие в осадок, а также мучные изделия из-за содержания в них фитина, затрудняющего всасывание железа. Детям, находящимся на искусственном вскармливании, можно назначить противоанемический энпит, содержащий повышенное количество белка, железа и обогащенный витаминами. Базисная терапия ЖДА проводится препаратами железа. При латентном дефиците железа, анемии легкой и средней степени тяжести препараты железа назначают внутрь. 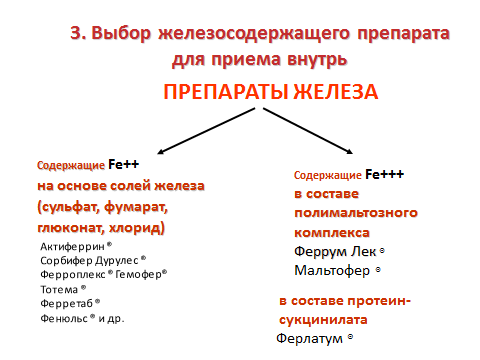
Соли железа Fe++ на основе солей железа (сульфат, фумарат, глюконат, хлорид) диссоциируют в ЖКТ на ионы, которые оказывают прямое повреждающее действие на клетки слизистой ЖКТ, вызывая, тем самым, побочные эффекты (тошноту, рвоту и другие). Ионы двухвалентного железа (из солей железа) всасываются путем пассивного переноса - диффузии в клетки кишечного эпителия и далее в кровь. Там железо переходит из двухвалентного в трехвалентное состояние, при этом появляются свободные радикалы, являющиеся токсичными. При приеме больших доз “пробивается” ферритиновый барьер слизистой, возможно отравление. Для избежания диспептических расстройств, возникающих во время приема препаратов железа, лечение в первые дни необходимо начинать с 1/4–1/3 суточной дозы с последующим ее увеличением в течение 7–10 дней до полной дозы. Препараты железа дают за 1–2 ч до еды, так как некоторые ингредиенты пищи могут образовывать с ними нерастворимые соединения, запивают их водой. С этой целью не следует использовать молоко или кофе, так как они снижают усвоение железа из желудочно-кишечного тракта.
Содержащие Fe+++ в составе полимальтозного комплекса. Структура макромолекулярного полимальтозного комплекса сходна со структурой естественного соединения железа – ферритина. Трехвалентное железо из Феррум Лек всасывается путем активного транспорта, ‘напрямую”. При этом не образуются свободные радикалы. Комплекс железа с полимальтозой (FePC) не диссоциирует на ионы в ЖКТ, этим объясняется отсутствие побочных эффектов со стороны ЖКТ.
В отличие от солей железа FePC можно принимать с едой или непосредственно после приема пищи, при этом не будет отмечаться уменьшения всасывания. Лечебная доза вводится сразу, препараты не взаимодействуют с пищей и лекарствами, возможен прием во время и после еды, можно запивать соками.
Выбор терапевтической дозы пероральных препаратов железа для приема внутрь детям до 3-5 лет:
4-6 мг элементарного железа/кг в сутки. Детям старше 5 лет и подросткам: 50-150 мг элементарного железа/сутки (до 200 мг/сут при тяжелой анемии). Взрослым: 100-300 мг элементарного железа/сутки
Длительность основного курса пероральной ферротерапии – 6-10 недель в зависимости от степени тяжести ЖДА:
- при легкой степени ЖДА -6 недель
- при средней степени ЖДА – 8 недель
- при тяжелой степени ЖДА – 10 недель
После нормализации уровня Нв продолжить прием препарата железа в поддерживающей дозе: ½ возрастной суточной лечебной дозы:
- при легкой степени ЖДА -6-8 недель
- при средней степени ЖДА – 8-10 недель
- при тяжелой степени ЖДА – 10-12 недель
Применение препаратов железа путем парентерального введения осуществляется только по специальным показаниям:
Оральный путь неэффективен из-за нарушенного кишечного всасывания (лактазная недостаточность, целиакия и др.).
Пероральное железо противопоказано из-за воспалительных или язвенных заболеваний ЖКТ.
Необходимость быстро восполнить запасы железа (хирургическое вмешательство, диагностические инвазивные манипуляции).
Социальные причины (невозможность осуществления контроля за приемом оральных ферропрепаратов).
Для парентерального введения используется феррум-лек, феррлецит. Они вводятся глубоко в мышцу через де






