Этот метод является основным в процессах очистки отходящих газов от примесей СО. В настоящее время известны многочисленные каталитические системы окисления СО в СО2, окисляющие СО в избытке водорода, в присутствии оксидов азота и углеводородов.
Металлические катализаторы окисления используют при дожигании примесей углеводородов, Н2 и СО, содержащихся в воздухе производственных помещений и в выхлопных газах автомобилей. Для увеличения удельной поверхности катализатора Pt и Pd наносят на Al2О3, находящийся на поверхности специального огнеупорного керамического носителя. Т оксичность выхлопа снижается до 90%. После нейтрализатора основными компонентами выхлопных газов становятся относительно безопасный диоксид углерода, а также азот и водяной пар.
Среди оксидных катализаторов окисления наиболее активны соединения с низкой энергией связи металл-кислород. Они обычно эффективны в процессах, протекающих при комнатной температуре. Наиболее активные катализаторы глубокого окисления – сложные оксиды типа шпинелей, такие, как хроматы(III) и кобальтаты (III) Fe, Mn, Co, Сr, а также Со3О4 и оксиды типа перовскитов, например, LaCoO3. При окислении СО в замкнутых системах жизнеобеспечения и в каталитических обогревателях применяют смешанный катализатор СоСr2О4 + Со3О4 [27-29].
В работе [4] предложен ряд монометаллических и биметаллических (Co-Cu и Cu-Ni, Co-Ni) катализаторов окисления СО на основе новых синтетических керамических носителей. В качестве носителей для катализаторов в промышленности используются зернистые, гранулированные и волокнистые материалы, металлические сотовые носители с высокой механической прочностью и теплопроводностью. Перспективным носителем считается пористая керамика, преимуществом которой является возможность блочного изготовления, что существенно расширяет спектр технологического применения катализаторов на ее основе [30].
В противогазах для защиты от СО используют гопкалитовые патроны, содержащие катализаторы окисления состава: 50% МnО2, 30% СuО, 15% Со2О3, 5% Ag2O; такой катализатор катализирует реакцию окисления СО до СО2 и активен выше 0°С в отсутствие паров воды [31].
Идет разработка новых катализаторов низкотемпературного окисления СО. Предлагаются каталитические системы на основе наноструктурированного оксида церия. [32]. Показано, что катализаторы состава CeO2Al0,25Si0,75O2-6 характеризуются рабочими параметрами температуры на 10-50 °С ниже многих из известных катализаторов подобных составов.
В совместной работе австралийских и российских ученых получены гибридные катализаторы окисления СО [33]. Показана перспективность гибридных материалов на основе гексагонального нитрида бора и серебряных наночастиц. Аналогичные материалы, в которых нитрид бора служил матрицей-носителем для металлических наночастиц катализатора, их предлагали использовать в том числе и для окисления угарного газа, где раньше в качестве катализатора использовали Au или Pt. Наиболее эффективными с точки зрения катализа оказались материалы с максимальной концентрацией наночастиц серебра, которая составила около 1,4% по массе. Такой гибридный катализатор позволяет окислять угарный газ до углекислого при температуре 194 С. Идет разработка новых каталитических систем на основе наночастиц серебра, в частности, за счет перевода их из полимерной матрицы на нитрид бора. В настоящее время текущие параметры катализаторов позволяют использовать их для систем очистки вредных выбросов на заводах. В будущем за счет снижения температуры конверсии угарного газа подобные материалы, вероятно, можно будет применять и для снижения доли монооксида углерода в автомобильных выхлопах [33].
Фотохимические методы
Фотокатализ
Наиболее точное определение понятия «фотокатализ» основано на определении катализа Г.К. Боресковым и дано в работе В.Н. Пармона [34]. «Фотокатализ - изменение скорости или возбуждение химических реакций под действием света в присутствии веществ фотокатализаторов, которые в результате поглощения ими квантов света способны вызывать химические превращения участников реакции, вступая с последними в промежуточные химические взаимодействия и регенерируя свой химический состав после каждого цикла взаимодействий» [34].
На рисунке 4.6. представлена схема фотокаталитического процесса на поверхности ТiO2. ТiO2 – полупроводник. Согласно современным представлениям, в таких соединениях электроны могут находиться в двух состояниях: свободном и связанном. В свободном состоянии электроны движутся по кристаллической решетке, образованной катионами Тi4+ и анионами кислорода О2-.

Рис.4.6. Схематическое изображение процессов на поверхности частицы полупроводника [35].
В связанном состоянии — в основном электроны связаны с каким-либо ионом кристаллической решетки и участвуют в образовании химической связи. Для перевода электрона из связанного в свободное состояние необходимо затратить энергию не менее 3,2 эВ. Эта энергия может быть доставлена квантами света с длиной волны < 390 нм.
Так при поглощении света в объеме частицы ТiO2 рождаются свободный электрон и электронная вакансия (дырка). Электрон и дырка — достаточно подвижные образования, и, двигаясь в частице полупроводника, часть из них рекомбинирует, а часть выходит на поверхность и захватывается ею. Захваченные поверхностью электрон и дырка являются вполне конкретными химическими частицами. Например, электрон — это, вероятно, Тi3+ на поверхности, а дырка (электронная вакансия) локализуется на решетчатом поверхностном кислороде, образуя О-. Они чрезвычайно реакционноспособны. В терминах окислительно-восстановительных потенциалов реакционная способность электрона и дырки на поверхности ТiO2 характеризуется следующими величинами: потенциал электрона ~ -0,1 В, потенциал дырки~ + 3В относительно нормального водородного электрода. Иными словами, электрон способен реагировать с кислородом, рождая последовательность реакций [35] рисунка 4.5.
Основное отличие фотокатализа от термического катализа состоит в полной или частичной замене термической активации реагентов на фотохимическую. Это обеспечивает возможность проведения реакций при комнатной температуре под действием света с достаточно большой энергией кванта.
Как показывают расчеты, фотокаталитический способ очистки воздуха в ряде случаев действительно является конкурентоспособным. Область его экономически выгодных применений ограничена очисткой воздуха с концентрациями загрязнителей менее 100-1000 ррm. Обработка больших концентраций ведет к линейному росту затрат на эксплуатацию [36,37].
Известны примеры опытно-промышленного применения этого метода для очистки воздуха: на заводе по производству взрывчатых веществ (США), в цехах предприятия микроэлектроники (США), в салонах самолетов фирмы «Боинг», в салонах новых автомобилей (Япония), в жилых городских помещениях и тоннелях (Япония), в больницах для подавления патогенной микрофлоры в воздухе (США), при лечении аллергических заболеваний и астме (США), в фармацевтических производствах (Италия), на международной космической станции МКС (США), на закрытых автомобильных стоянках (Франция), уничтожения СО в кузове автотранспорта (Россия), при уничтожении боевых отравляющих веществ (Россия-НАТО) [35,36].
Комбинация плазмохимического реактора и фильтра с фотокатализатором
Плазмохимический реактор разлагает органические соединения и обеспечивает при минимальных энергетических затратах степень подавления и удаления загрязнителей на 95-96 % их начального содержания. Фотокаталитический фильтр обеспечивает финишную очистку воздуха от остатков загрязнителей и продуктов их неполного разложения за счет окисления их на поверхности катализатора. Наличие в потоке воздуха, выходящем из плазмохимического реактора, остаточного озона обеспечивает авторегенерацию фотокатализатора. Суммарная степень очистки газового потока не ниже 99,99 %. используется при относительно низких концентрациях загрязнителей, делающих нецелесообразным их улавливание с целью последующего использования. Считают [37], что метод может быть применен для очистки отходящих газов при пиролитической переработке мусора.
Фотолитическое озонирование
Метод основан на фотолитическом озонировании воздушного потока, содержащего органические примеси и СО. В газовом потоке устанавливаются специальные газоразрядные ртутные лампы низкого давления, корпус которых выполнен из высококачественного кварцевого стекла. За счет испускаемого излучения с длиной волны 185 нм эффективно генерируется озон. Излучение с длиной волны 254 нм также испускаемое такой лампой активирует озон, который при этом разлагает вплоть до углекислого газа и воды любые органические соединения, содержащиеся в газовом потоке. Константа скорости реакций также как в случае протекания реакций в воде увеличивается от 100 до 100000 раз, что делает практически возможным создавать компактные устройства, встраиваемые в вентиляционные системы. Для удаления из очищаемого воздуха остатков озона используется либо фоторазложение озона волны 254 нм, либо используют катализаторы разложения остаточного озона. Метод нашел практическое применение для дезодорации воздуха в медицинских учреждениях [38].
ЗАКЛЮЧЕНИЕ К ГЛАВЕ 4.
В Главе 4 представлены основные методы очистки отходящих газов от оксидов азота, серы и СО. Реально, при очистке газовых выбросов промышленных предприятий приходится иметь дело одновременно с разными загрязнителями, поэтому используют сочетание различных методов очистки газов, что обычно предусматривается на стадии проектирования производства. В таблице 4.1. приведены примеры сочетания методов газоочистки, которые используются в Европе.
Таблица.4.1.
|
Предприятие
|
Топливо
| Газовые
выбросы, м3/час
|
Методы очистки
|
| AVI Roteb Rotterdam,
Нидерланды
|
Спец.
Отходы
| 475000
Диоксины, фураны, SO2, NOx, HCl, HF
|
Фильтры активированный уголь, СКВ
|
| Landreis Forth, Германия
| Бытовые отходы
| 30000
NOx
| СКВ
|
| Starckwerke Lanshut, Германия
| Сжигание древесины
| 50000
Диоксины, фураны, тяжелые металлы, SO2, NOx, HCl, HF
| Сухая сорбция, СКВ
|
| Spitz, Германия
| Осадок сточных вод
| 4000
Диоксины,фураны, тяжелые металлы, SO2, HCl, HF
| Фильтр с активированным коксом, сухая сорбция
|
Наиболее широкое применение находят адсорбционный метод и СКВ. В таблице 4.1.перечислены также некоторые предприятия, оснащенные оборудованием газоочистки, которое производится фирмой Hugo Petersen (Германия) [25].
Известен гибридный способ TwinSorp, который предполагает комбинацию СНКВ (селективное некаталитическое восстановление) – кондиционированная сухая сорбция – мокрый газоочиститель. Метод TwinSorp позволяет обеспечить соблюдение очень низких предельных значений выброса, например, для NOX, NH3, кислых газов, таких как HCl, соблюдение очень низких предельных значений выброса, например, для NOX, NH3, кислых газов, таких как HCl, SOX, ртути и других тяжелых металлов, а также диоксинов/фуранов способом, не SOX, ртути и других тяжелых металлов, а также диоксинов/фуранов способом, не требующим больших затрат. Известен гибридный способ TwinSorp, который предполагает комбинацию СНКВ (селективное некаталитическое восстановление) – кондиционированная сухая сорбция – мокрый Метод TwinSorp позволяет обеспечить требующим больших затрат.
Присутствующие в отходящих газах диоксины и фураны. особенно токсичны. Методам очистки окружающей среды от этих соединений посвящена следующая глава.
Список литературы к Главе 4
1. Разва А.С.Методы и технологии очистки дымовых газов от оксидов азота. «Природоохранные А.С. Методы и технологии в промышленной теплоэнергетике» Курс лекций. Томск 2010. -127c.
2.Очистка промышленных выбросов и утилизация отходов. Сборник научных трудов. Л., 1985.
3. Леонов В. Т. Теоретические и технологические основы утилизации и переработки оксидов азота из отходящих газов: Дисс. д. т. н.: Москва, 2007.- 161 с.
4. Котлер В.Р. Охрана воздушного бассейна от выбросов энергопредприятий. Селективное некаталитическое восстановление — СНКВ (SNCR).
5. Каталитическая очистка газовых выбросов.
https://studbooks.net/942032/ekologiya/kataliticheskaya_ochistka_gazovyh_vybrosov_oksidov_azota_ugleroda
6. Федорова А. В. Каталитическая очистка газовых выбросов от оксида азота (II). дисс. к.т.н. 2011.
http://www. dissercat.com/content/kataliticheskaya-ochistka-gazovykh-vybrosov-ot-oksida-azota-ii#ixzz2KHyBA8 35
7. Селективное каталитическое восстановление nst.e-apbe.ru/book/1.1.3.1.pdf
8. Селективное каталитическое восстановление.
https://studme.org/162571/ekologiya/selektivnoe_kataliticheskoe_vosstanovlenie_oksidov_azota
9. Катин В.Д. Сокращение выбросов оксидов азота путем интенсификации теплообмена в топках печей и котлов предприятий железнодорожного транспорта // Сб. науч. тр. ПГУПС. – СПб., 1993.
10. Технология EnviNOx® для производства азотной кислоты без выбросов.
https://www.tkisrus.com/assets/pdf/brochures/ru/TKIS-EnviNOx-ru.pdf
11.Рищенко И. М. Контактно-абсорбционный метод очистки выхлопных газов энергетических установок от оксида азота: автореферат дис. К. т. Н.: Харьков, 1993.- 18 с.
12. Лунин В.В., Самойлович В.Г., Ткаченко С.Н., Ткаченко И.С. /Теория и практика получения и применения озона.2016. Изд-во МГУ.416с..
13.Назаров В. А. Каталитическое дожигание оксида углерода (II) озоном: Дисс. канд. техн. наук: Казань, 2004 120 c.
14. Ожогина О. Р. Очистка отходящих газов от оксидов азота амин-содержащими поглотителями: дисс. к. т.н.: Нижний Новгород, 2000.- 118 с.
15. Очистка газов от соединений серы http://oil-filters.ru/gas_sweetening/
16. Производство и технологии.
otherreferats.allbest.ru› ›00146265_0.html.
17. studizba.com›lectures/105…1346…24792-56…so2.htm
18.Каталитические методы очистки газов от диоксида серы. https://studizba.com/lectures/105-jekologija/1346-inzhenernye-metody-zaschity-atmosfery/24792-56-kataliticheskij-metod-ochistki-gazov-ot-so2.html
19.Сернистый газ Очистка.
related:works.tarefer.ru/94/100077/index.html
20.Снижение выбросов окислов серы и азота http://www.sergey-osetrov.narod.ru/Projects/Boiler/REDUCTION_SURGE_SULPHURS_And_NITROGEN.htm
21. Циклические методы очистки газов от диоксида серы. https://chem21.info/page/221140218181144013095053007025170008026079153054/
22. Галевский Г. В., Кулагин Н. М., Минцис М.Я. / Экология и утилизация отходов в производстве алюминия: Учеб. Пособие. – М.: Флинта: Наука, 2005.–272 с.
23. Тарасовский А.В. Совершенствование очистки дымовых газов теплогенерирующих установок систем теплоснабжения. Дисс. к.т.н. 2006. Волгоград. -143 с.
24. Модина М.А. Повышение эффективности установки очистки отработавших газов судовых дизелей и котлов от оксидов серы. Дисс. к.т.н. 2010.Новороссийск. -180 с.
25. Системы газоочистки.
hugo-petersen.de/russisch/download/HP_gas__cleaning_ru.pdf
26. Методы газоочистки.
https://www.shell.com.ru/content/dam/shellnew/local/country/rus-/downloads/pdf/wpc/newmobility/101195_shell_roteb_list_ru.pdf
27. Мapгoлис Л. Я. Окисление углеводородов на гетерогенных катализаторах, М., 1977.
28. Голодец Г. И., Гетерогенно-каталитическое окисление органических веществ, Киев, 1978.
29. Проблемы кинетики и катализа. т.18. /ред. О. В. Крылова и Н. Д. Шибанова, Наука. М.
30. Диденкулова И. И. Синтетические керамические катализаторы окисления СО в СО2: кинетика и механизм. Нижний Новгород. 2008. автореф. Дисс. К,х.н. -25 с.
31. Ткаченко С.Н., Егорова Г.В., Вобликова В.А. и др. Ж.физ.химии 77 (11), 1768-1772.
32. Загайнов И.В., Трусова Е.А., Либерман Е.Ю. Успехи в химии и химической технологии. Т. XXIV. №9. с.67.
33. news.rambler.ru/other/41200873-nanochastitsy-serebra-i-nitrid-bora-izbavyat-vyhlopy-ot-ugarnogo-gaza/.
34. Пармон В.Н. Фотокатализ: Вопросы терминологии./ Ред. К.И. Замараев, В.Н. Пармон. Новосибирск: Наука, 1991.С. 7-17.
35. Савинов Е.Н. Фотокаталитические методы очистки воды и воздуха https://docviewer 938d3b_0c5ee83671714c20b435d63fc08ddb63.pdf
36. Полунин Г.А. Улучшение условий и охрана труда персонала оперативно выездных бригад применением фотокаталитического воздухоочистителя для снижения концентрации оксида углерода в кабинах и кузовах мобильных машин. Дисс. к.т.н. 2016. Челябинск. -140 с.
37. Фотокаталитическая очистка газов.
http://www.solidwaste.ru/i/ent/1057/presentation_13977952305102.pdf
38. Л. Басов, С. Чикишев. Фотолитическое озонирование воздуха. http://www.solidwaste.ru/i/ent/1057/presentation_13977952305102.pdf
ГЛАВА 5. УНИЧТОЖЕНИЕ ДИОКСИНОВ.
ИСТОЧНИКИ ОБРАЗОВАНИЯ И СВОЙСТВА ДИОКСИНОВ.
Термин диоксины обычно используется для обозначения семейства соединений в основу структуры которых входит полихлор-дибензо-пара-диоксины (ПХДД) и полихлор- дибензо-фураны (ПХДФ). Каждое соединение содержит два бензольных кольца, связанных атомами кислорода. В случае ПХДД кольца связаны двумя кислородными мостиками, в случае ПХДФ - кольца связаны С - С связью и кислородным мостиком. На рисунке 1 приведены структурные формулы ПХДД и ПХДФ с указанием положения атомов водорода, которые могут быть замещены на атом Cl или другого галогена [1-3].
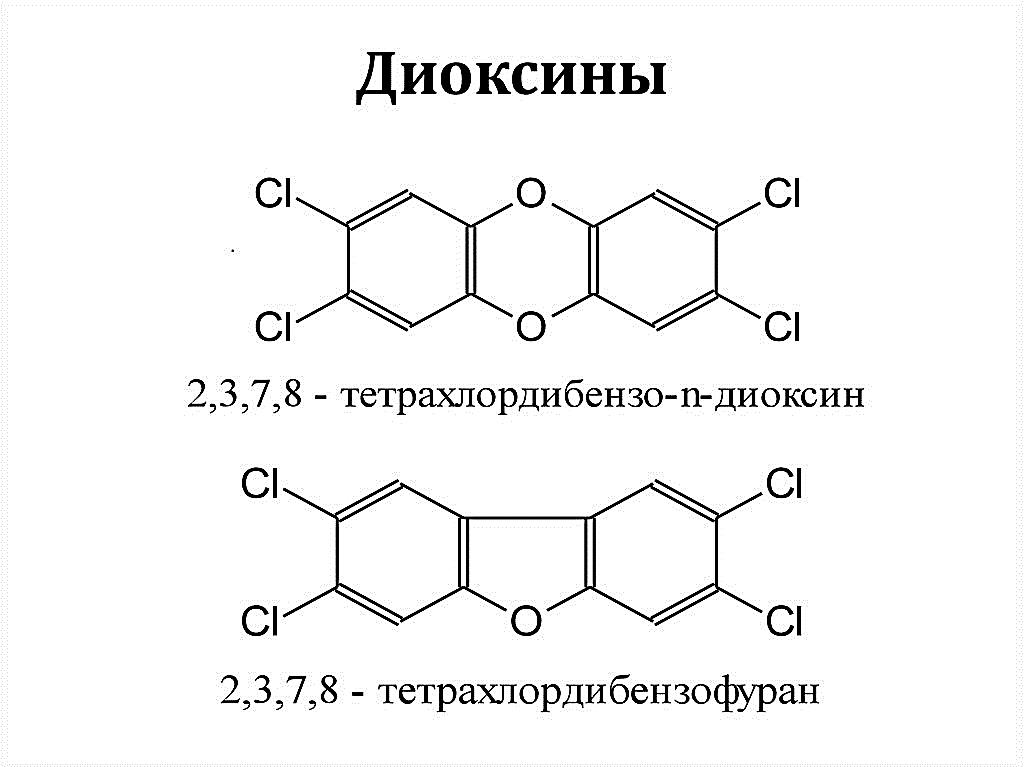
Рис. 5.1. Структура ПХДД и ПХДФ.[1]
Диоксины являются побочными продуктами производства хлорфенолов, их образование также сопровождает процессы сжигания соединений, содержащих С, Н, О и Cl (или Br) атомы. Диоксины и фураны (ПХДД И ПХДФ) образуются в интервале температур 250-450ºС. Есть также данные об образовании таких соединений в интервале от 150 до 240º С. Диоксины и фенолы образуются легче, поэтому в фильтрах для улавливания дыма поддерживается температура не выше 200 º С.
Содержание диоксинов в отходящих газах, сточных водах или твердых остатках очень сильно зависит от выбора технологии и оборудования. В литературе выделяют первичные и вторичные источники диоксинов. Согласно этой классификации, источники диоксинов, которые образуются на выходе в окружающую среду и/или в местах, отличных от места переработки отходов, относятся к категории вторичных источников. Например, антропогенные диоксины, включению которых в газовые выбросы препятствуют системы очистки, могут остаться в составе адсорбентов и, тем не менее, могут включиться в пищевую цепь и повысить их потребление человеком. Среднее время полураспада диоксинов в почве – 10–12 лет, а в организме человека 6–8 лет. Диоксины малорастворимы в воде, не разрушаются кислотами, устойчивы к действию щелочей, прочно связываются с твердыми носителями [1-4].
ТОКСИЧНОСТЬ ДИОКСИНОВ
Из известных 75 диоксинов и 135 фуранов всерьез исследовалась токсичность лишь небольшого числа соединений этого класса. Наиболее интенсивно изучено действие 2,3,7,8 -тетрахлордибензодиоксина (TХБД). Очень малые дозы 2,3,7,8 TCDD вызывают потерю веса, снижение иммунитета, снижение тестостерона, заболевания кожи и печени. [11]. Среднесмертельная доза для человека, полученная расчетным путем, составляет при однократном оральном поступлении 0,05-0,07 ppm. [4,5].
Критерий ПДК для диоксинов совершенно неприемлем. Это следует из того твердо установленного факта, что не существует столь малой дозы диоксинов, которая была бы безопасной. Допустимая суточная доза, установленная в России, составляет 10 пкг/кг веса/день, американская норма - 6 фемтограмм (10-15 г) на килограмм веса в день. (таблица 5.1.)
Таблица 5.1. ПДК или ОБУВ* для полихлорированных дибензо-
п -диоксинов (ПХДД) и дибензофуранов (ПХДФ).
| Объект
| Диоксины ДЭ (ПХДД+ПХДФ)
| Σ ПХБ
| Регламентирующий документ (для диоксинов)
|
| Атмосферный воздух
| 0,5 пг/м3
| 1 мкг/м3
| ГН 2.1.6.014-94
|
| Выбросы в атмосферу
| 0,1 нг/м3
|
| Европейская норма
|
| Питьевая вода, грунтовые и поверхностные воды,
места водозабора
| 20 пг/л
1 пг/л
| 1 мкг/л
| Приказ МЗ СССР № 142-9/105 от 05.05.1991 г.
------
ГН 2.1.5.2280-07
|
| Почва
| 0,33 нг/кг
| 60 нг/кг
| Приказ МЗ СССР от 08.09.86 г. № 697 ДСП
|
* Ориентировочный безопасный уровень воздействия
пг (пикограмм) =10-12 г. нг (нанограмм=10-10 г.)
1мг (миллиграмм) = 1000000000000 фемтограмм 1× 1012 фг.
Эти нормы установлены от бессилия, так как уже имеющееся загрязнение диоксинами в западных странах столь высоко, что эти нормы легко перекрываются [5-6]. В Европейском Союзе в 2012 году норма на концентрацию диоксинов составляет 0,1 нг/м3. Норма содержания диоксинов в осадках 1-2 нг/кг [6,7].
Пути образования диоксинов выявлены еще не до конца. Считают, что в процессе переработки ТБО они образуются при температурах от 700 до 1000 ºС. Количество диоксинов зависит от условий проведения процесса и исходного сырья, и, прежде всего, от присутствия в нем Cl- и Br- содержащих компонентов. Факторами, повышающими образование диоксинов, являются температура выше 150 ºС, щелочная среда реакции, наличие углерода, СО, хлоридов и соединений меди как катализаторов.








