
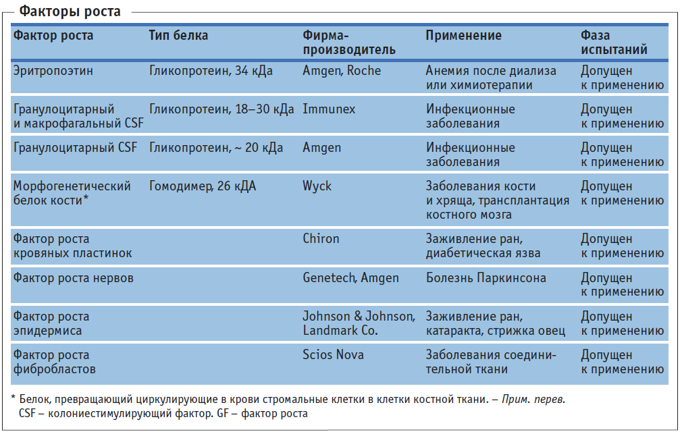
Развитие техники работы с культурами клеток привело к обнаружению большого числа факторов роста (colony stimulating factors, CSF, колониестимулирующие факторы), которые стимулировали рост клеток в результате взаимодействия с рецепторами на клеточной поверхности. Эти факторы представляют собой цитокины – вещества, которые синтезируются клетками в очень малых количествах. Методами генетической инженерии можно получать их в необходимых количествах с целью изучения свойств, природы и механизма взаимодействия, а также возможностей терапевтического применения: особый интерес представляет направленное влияние на рост определенных типов клеток (клеток кожи, нервных клеток, эритроцитов, клеток костей и т.д.). Так, эритропоэтин, фактор роста гранулоцитов (G-CSF) и фактор роста гранулоцитов и макрофагов (GM-CSF) уже успешно применяются в медицине. Эритропоэтин стимулирует образование эритроцитов, G-CSF – нейтрофильных гранулоцитов, а GM-CSF – эозинофильных и нейтрофильных гранулоцитов, моноцитов и макрофагов. Эти факторы назначают пациентам с анемией, которая часто возникает при проведении диализа. В Германии около 40 000 пациентов принимают эритропоэтин и около 100 000 – GM-CSF. Мировой объем рынка эритропоэтина составляет около 10 млрд долл. США, G-CSF и GM-CSF – около 3 млрд долл. США (2004 г.).
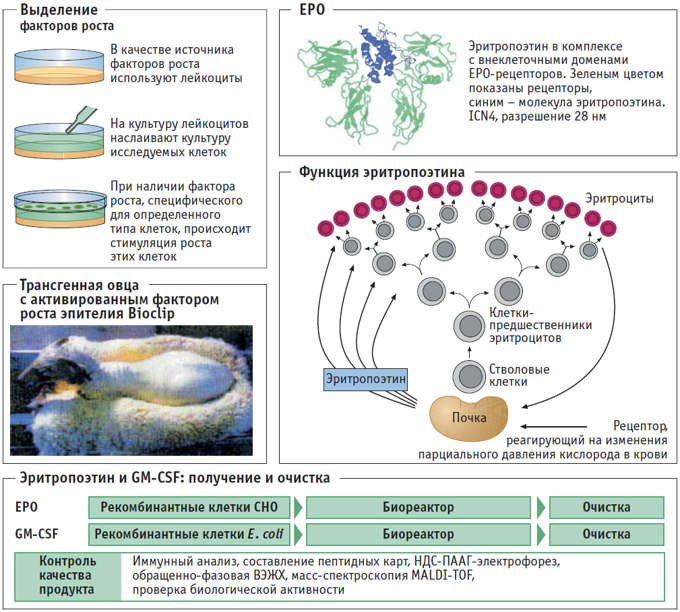
ЭРИТРОПОЭТИН (ЕРО) – фактор роста эритроцитов. Интенсивность биосинтеза эритропоэтина в клетках эндотелия почек и клетках Купфера в печени зависит от парциального давления кислорода в крови. Под действием ЕРО гематопоэтические стволовые клетки костного мозга теряют ядра, и в них начинается синтез гемоглобина: так происходит созревание эритроцитов. Таким образом, ЕРО стимулирует обновление клеток крови, и поэтому он используется при лечении малокровия, развивающегося у пациентов, которым проводят диализ крови (искусственная почка). В последнее время наряду с эритропоэтином при лечении таких пациентов успешно используется комбинированный препарат: факторы роста GM-CSF или G-CSF, факторы роста гранулоцитов, макрофагов и моноцитов. Ген эритропоэтина из клеток костного мозга человека клонирован в 1984 г. Гликопротеин с молекулярной массой 34 кДа представляет собой полипептид из 165 аминокислотных остатков, который гликозилирован по трем атомам азота и одному атому кислорода. На углеводные цепи приходится около
40% молекулярной массы этого гликопротеина и они, по-видимому, имеют важное функциональное значение. По этой причине поиск клеток-хозяев для экспрессии биологически активного эритропоэтина оказался чрезвычайно сложной задачей. Высокий выход функционального гликопротеина был получен в клетках СНО. Кристаллическая структура эритропоэтина, связанного с внеклеточными доменами его рецепторов, представлена в таблице.
ФАКТОРЫ РОСТА. Гликопротеины, входящие в состав большой группы факторов роста, специфически стимулируют размножение и созревание клеток соединительной ткани, а также нервных, костных и других клеток. К настоящему времени гены многих факторов роста клонированы, и некоторые рекомбинантные белки уже применяются в медицине или находятся на стадии клинических испытаний. Препараты, полученные на основе этих белков, используют для лечения невропатий, остеопороза и язвенной болезни. Исследуется возможность применения фактора роста эпителия для заживления ран, в том числе после удаления катаракты. Были получены трансгенные овцы, в которых активность фактора роста эпителия увеличена по сравнению с нормой, в результате рост шерсти у таких овец значительно усилился.
ПОЛУЧЕНИЕ. Эритропоэтин получают в биореакторах объемом до 1000 л с использованием культуры животных клеток, прежде всего – рекомбинантных СНО-клеток (клетки яичника китайского хомяка). Необходимость использования животных клеток для получения эритропоэтина связана с тем, что биологически активный белок должен быть гликозилирован. Процесс ферментации продолжается 30 сут, после чего рекомбинантный белок подвергают четырехстадийной хроматографической очистке. Физиологическое действие других факторов роста не зависит от того, гликозилированы они или нет, поэтому в качестве клеток-хозяев для получения таких рекомбинантных белков используют микроорганизмы. Так, GM-CSF и G-CSF получают в клетках рекомбинантных штаммов E. coli.
ФАКТОР НЕКРОЗА ОПУХОЛЕЙ
Фактор некроза опухолей (ФНО или англ. TNF)– занимает особое место среди цитокинов. Свое название он получил в связи со способностью вызывать геморрагический некроз некоторых опухолей у экспериментальных животных. Позднее было установлено, что ФНО - это целое семейство цитокинов, осуществляющих свои функции через соответствующее семейство клеточных рецепторов. В это семейство входят лимфотоксины α и β, Fas-лиганд, мембранные молекулы CD40 и CD30, Р-75 рецептор нейротрофина, ФНО-связанный апоптоз-индуцирующий лиганд (TRAIL) и др. Продуцентами этой группы цитокинов являются активированные мононуклеарные фагоциты, эндотелиальные клетки, антигенстимулированные Т-клетки (СD4+ и CD8+), активированные ЕК-клетки. Биологические свойства ФНО чрезвычайно разнообразны и зависят от преобладания того или иного цитокина из его семейства. Основными являются: стимуляция продукции IL-1, IL-6 и самого ФНО, стимуляция процессов адгезии, антителообразования В-клетками, индукция колониеобразующих факторов эндотелиальными клетками и фибробластами, ко-стимуляция Т-клеточной активации и ЕК-клеток. Входящие в семейство Fas-лиганд TRAIL индуцируют апоптоз, а лимфотоксины α и β играют важную роль в развитии лимфоидных органов. Выключение генов лимфотоксинов у мышей приводит к подавлению развития лимфатических узлов, пейеровых бляшек, формирования зародышевых центров при иммунном ответе. ФНО- α влияет на процессы кроветворения, подавляя эритро-, миело- и лимфопоэз, однако, на фоне подавленного кроветворения проявляется стимулирующее действие ФНО- α. Введение ФНО может защищать мышей от летальных доз облучения: применение его через 24 ч после облучения снижает гибель мышей до 40% по сравнению с 75% в контроле. Индукция апоптоза и клеточной смерти цитокинами семейства ФНО является фундаментальной для использования их в лечении опухолей. Кроме возможности непосредственно вызывать цитолиз, ФНО также усиливает экспрессию на клеточной поверхности антигенов гистосовместимости II класса опухолеассоциированных антигенов, способствуя тем самым развитию более интенсивного иммунного ответа на опухоль.
В группу факторов некроза опухолей включают TNFα и β (лимфотоксины). Они представляют собой полипептиды с м.м. ~17 кДа. TNFα (или ФНОα) является продуктом моноцитов/макрофагов, эндотелиальных, тучных и миелоидных клеток, ЛАК, клеток нейроглии, в особых случаях – активированных Т-лимфоцитов. Последние являются основными продуцентами TNFβ, который образуется при действии на Т-клетки АГ и митогенов значительно позже, чем TNFα (2-3 сутки после активации). Противоопухолевое действие, связанное с геморрагическим некрозом и давшее название семейству, однако не ограничивает спектр действий данных ЦК.
Существует три основных направления действия TNF (ФНО):
· цитотоксическое, направленное на клетки опухоли либо клетки, пораженные вирусами;
· иммуномодулирующее и противовоспалительное, вызываемое активацией макрофагов, нейтрофилов, эозинофилов и эндотелиальных клеток;
· влияние на метаболизм, способное привести к гипергликемии, резорбции кости и увеличению мышечного гликогенолиза, т.е. кахексии, наблюдаемой при некоторых паразитарных инфекциях.
В результате высвобождения TNF повышается проницаемость капилляров, повреждается эндотелий сосудов, возникает внутрисосудистый тромбоз. Концентрация циркулирующего TNFα обычно очень низка (<5 пг/мл), однако она резко возрастает (максимум за 90 мин.) после введения ЛПС и возвращается к норме в течение 4 ч. Высокие уровни TNFα (>300 пг/мл) обнаруживают во время септического шока. Сохранение высоких уровней указывает на возможность возникновения нежелательных последствий. Было показано, что у ВИЧ-инфицированных лиц в начальный период заболевания значительно увеличиваются концентрации TNFα и IFN-γ. Повышенный уровень TNFα при СПИДе индуцирует репликацию вируса в инфицированных клетках по ауто- или паракринному пути. Кроме того, TNF, осуществляя киллинг клеток, пораженных вирусом, вызывает вирусемию и заражение новых лимфоцитов. Оппортунистические инфекции у ВИЧ-инфицированных лиц приводят к дополнительной продукции TNFα и IL-1, и это тоже вызывает увеличение количества клеток, содержащих вирус иммунодефицита.
На заметку









