Цитокины (англ. Cytokine) – это продуцируемые клетками белково-пептидные факторы, осуществляющие короткодистантную регуляцию межклеточных и межсистемных взаимодействий. Цитокины определяют выживаемость клеток, стимуляцию или ингибирование их роста, дифференцировку, функциональную активацию и апоптоз клеток. Способность регулировать перечисленные функции обусловлена тем, что после взаимодействия цитокинов с комплементарными рецепторами на поверхности клеток, сигнал через элементы внутриклеточной трансдукции передается в ядро, где активируются соответствующие гены. Белки, продукты активированных цитокинами генов, синтезируются клетками и регулируют перечисленные выше процессы.
Цитокины (ЦК) – гормоноподобные молекулы, действие которых на клетку-мишень опосредуется высокоспецифичными высокоаффинными мембранными рецепторами.
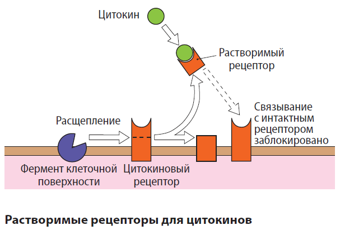 Все рецепторы ЦК представляют собой трансмембранные гликопротеины, у которых внеклеточная часть отвечает за связывание ЦК. Как правило, эти рецепторы состоят более чем из одной субъединицы, причем высокоаффинное связывание является следствием взаимодействия с разными субъединицами, каждая из которых сама способна связывать соответствующий ЦК, но с более низкой аффинностью. Одни субъединицы рецепторов реагируют только с определенным ЦК, в то время как другие способны формировать общие рецепторы для разных ЦК. Наличие общих структур в рецепторах может обусловливать функциональное сходство ряда ЦК. Кроме того, существуют общие групповые рецепторы, способствующие устранению избытка ЦК в очаге поражения. Синтез рецепторов протекает более интенсивно и длительно, чем синтез cоответствующих ЦК, что обусловливает их более полную и быструю элиминацию из сосудистого русла и реализацию биологического эффекта в очаге поражения. Растворимый рецептор, связывающийся с ЦК, – это отщепленный ферментом внеклеточный домен мембранного рецептора. Растворимые рецепторы сохраняют высокую аффинность в отношении своих лигандов и благодаря этому способны нейтрализовать ЦК, препятствуя их доступу к интактным мембранным рецепторам; их можно обнаружить в сыворотке и моче. Растворимые рецепторы могут выполнять функции конкурирующих антагонистов, а также участвовать в транспорте, доставке ЦК в очаг поражения и выведении их из организма. В результате взаимодействия ЦК с рецептором инициируется сигнал, передача которого в клетку обычно происходит либо по пути с участием янус-киназы (JAK)-STAT, либо по пути с участием киназы Ras-MAP.
Все рецепторы ЦК представляют собой трансмембранные гликопротеины, у которых внеклеточная часть отвечает за связывание ЦК. Как правило, эти рецепторы состоят более чем из одной субъединицы, причем высокоаффинное связывание является следствием взаимодействия с разными субъединицами, каждая из которых сама способна связывать соответствующий ЦК, но с более низкой аффинностью. Одни субъединицы рецепторов реагируют только с определенным ЦК, в то время как другие способны формировать общие рецепторы для разных ЦК. Наличие общих структур в рецепторах может обусловливать функциональное сходство ряда ЦК. Кроме того, существуют общие групповые рецепторы, способствующие устранению избытка ЦК в очаге поражения. Синтез рецепторов протекает более интенсивно и длительно, чем синтез cоответствующих ЦК, что обусловливает их более полную и быструю элиминацию из сосудистого русла и реализацию биологического эффекта в очаге поражения. Растворимый рецептор, связывающийся с ЦК, – это отщепленный ферментом внеклеточный домен мембранного рецептора. Растворимые рецепторы сохраняют высокую аффинность в отношении своих лигандов и благодаря этому способны нейтрализовать ЦК, препятствуя их доступу к интактным мембранным рецепторам; их можно обнаружить в сыворотке и моче. Растворимые рецепторы могут выполнять функции конкурирующих антагонистов, а также участвовать в транспорте, доставке ЦК в очаг поражения и выведении их из организма. В результате взаимодействия ЦК с рецептором инициируется сигнал, передача которого в клетку обычно происходит либо по пути с участием янус-киназы (JAK)-STAT, либо по пути с участием киназы Ras-MAP.
В отличие от классических гормонов большинство ЦК является молекулами локального (паракринного) действия. Они продуцируются и утилизируются клетками, находящимися в тесной близости. Возможно и аутокринное действие ЦК, т.е. действие на ту же клетку, которая секретировала данный ЦК. После выделения клетками-продуцентами ЦК имеют короткий период полувыведения из кровотока. Выведение катаболизированных ЦК из организма осуществляется печенью и почками. Несмотря на короткий период жизни ЦК, в сыворотках даже здоровых доноров иногда определяются их низкие уровни. Секреция ЦК – краткосрочный процесс. Кодирующая ЦК мРНК нестабильна, что в сочетании с краткосрочностью транскрипции генов ЦК приводит к непродолжительности их биосинтеза.
К системе цитокинов в настоящее время относят около 300 индивидуальных полипептидных веществ. Среди всех известных к настоящему времени секретируемых клетками регуляторных факторов две группы цитокинов являются наиболее хорошо изученными и, в связи этим, наиболее часто используемыми в диагностических целях. Это факторы роста и цитокины иммунной системы (ИС).
Цитокины иммунной системы характеризуются следующими общими свойствами:
· синтезируются в процессе реализации механизмов естественного или специфического иммунитета;
· проявляют свою активность при очень низких концентрациях (порядка 10-11 М/л);
· служат медиаторами иммунной и воспалительной реакций и обладают аутокринной, паракринной и эндокринной активностью;
· обладают плейотропной (полифункциональной) активностью, т.е. один ЦК оказывает влияние на различные процессы;
· характеризуются последовательностью осуществления эффектов: один ЦК способен индуцировать продукцию другого ЦК или экспрессию его рецепторов;
· наблюдается также синергизм и антагонизм действия различных ЦК.
Классификация ЦК может проводиться по их биохимическим и биологическим свойствам, а также по типам рецепторов. В зависимости от того, какие клетки ИС преимущественно синтезируют тот или иной ЦК, различают интерлейкины (IL), монокины и лимфокины. В настоящее время 37 интерлейкинов имеют цифровые обозначения (IL-1-37), остальные ЦК буквенные: CSF (колониестимулирующие факторы), OSM (онкостатин М), LIF (фактор, ингибирующий лейкозные клетки), TGF (трансформирующие факторы роста), CNTF (цилиарный нейротрофический фактор), TNF (фактор некроза опухолей), интерфероны (IFN) и т.д.
По механизму действия цитокины иммунной системы можно условно подразделить на следующие группы:
1. Провоспалительные ЦК (IL-1, IL-6, IL-12, TNF-α, IFN-α, IFN-β, IFN-γ, хемокины – IL-8, MCP-1, RANTES и др.) продуцируются и действуют на иммунокомпетентные клетки, инициируя воспалительный ответ. Многие авторы отмечают, что высокий уровень этих ЦК является отражением активности и тяжести патологического процесса.
2. Противовоспалительные ЦК (IL-4, IL-10, TGF-β и др.), регулирующие специфические иммунные реакции и ограничивающие развитие воспаления.
3. Регуляторы клеточного и гуморального иммунитета (естественного или специфического), обладающие собственными эффекторными функциями (противовирусными, цитотоксическими).
Таблица 1. Функциональные свойства цитокинов (адаптировано из [45], 2003 г.)
| Функции
| Цитокины
|
| Гемопоэз
| IL-3; IL-4; IL-5; IL-9; IL-11; IL-12; IL-13; IL-14; Г-КСФ (G-CSF) - Гранулоцитарно-колониестимулирующий фактор; ГМ-КСФ (GM-CSF) - Гранулоцитарно-макрофагальный колониестимулирующий фактор; М-КСФ (M-CSF) - Макрофагальный колониестимулирующий фактор.
|
| Регуляция иммунного ответа (созревание, пролиферация и функциональная активность иммунокомпетентных клеток)
| Интерфероны (IFN) I и II типа, IL-1, IL-2, IL-5, IL-6, IL-8, IL-15, IL-18, фактор некроза опухолей ФНО (TNF)
|
| Воспаление
| IL-1, IL-4, IL-5, IL-6, IL-8, IL-11, IL-13, IL-15, IL-16, IL-18
|
| Апоптоз
| IL-3, IL-5, IL-6, IL-7, IL-9, IL-12, ИФН-α (IFN-α) Интерферон-α
|
| Ангиогенез
| ГМ-КСФ; Г-КСФ; ТРФ (TGF-β) - Трансформирующий ростовой фактор бета; IL-1; IL-4; IL-8; IL-13
|
| Нейрогенез
| IL-1, IL-3, IL-6, IL-9, IL-11
|
В этой таблице приведены далеко не все процессы, в которых участвуют цитокины.
Спектры биологических активностей ЦК ИС в значительной степени перекрываются: один и тот же процесс может стимулироваться в клетке более чем одним ЦК. Во многих случаях в действиях ЦК наблюдается синергизм. Антигенная (АГ) стимуляция приводит к секреции ЦК «первого поколения» – IL-1 и -6, TNF-α, которые индуцируют биосинтез центрального регуляторного ЦК: IL-2, а также IL-3-5, INF-γ и др. В свою очередь ЦК «второго поколения» влияют на биосинтез ранних ЦК. Такой принцип действия позволяет не только регулировать иммунный ответ, но и амплифицировать его, вовлекая в реакцию все возрастающее число клеток. IL-2 появляется в цитоплазме Т-клеток через 2 ч после стимуляции; IL-4 через 4 ч, IL-10 через 6 ч, IL-9 через 24 ч. Пик выработки различных лимфокинов варьирует: 12 ч для IL-2, 48 ч для IL-4 и IL-5, 72 ч для IL-9 и INFγ.
Действие ЦК тесно связано с физиологическими и патофизиологическими реакциями организма. При этом происходит модуляция как локальных, так и системных механизмов защиты. Одной из важнейших функций системы ЦК является обеспечение согласованного действия иммунной, эндокринной и нервной системы в ответ на стресс. Усиление продукции определенных ЦК воспаления или факторов, стимулирующих рост лимфоцитов, может лежать в основе некоторых заболеваний. В то же время снижение уровня ряда ЦК также способно провоцировать заболевание. Так, CSF играет ведущую роль в нормальном гемопоэзе, и уменьшение его продукции нарушает механизмы защиты против инфекций.
Поскольку ЦК являются локальными медиаторами, более целесообразно измерять их уровни в соответствующих тканях после экстракции тканевых протеинов или в естественных жидкостях, например, в слезе, смывах из полостей, моче, спинномозговой жидкости и т.д. Уровни ЦК в сыворотке или других биологических жидкостях от- ражают текущее состояние работы иммунной системы, т.е. их синтез клетками in vivo. В норме в крови ЦК ИС не определяются. Выявление ЦК обычно отражает наличие воспаления. Определение уровней продукции ЦК мононуклеарами периферической крови (МПК) in vitro показывает функциональное состояние этих клеток. Спонтанная продукция ЦК МПК в культуре свидетельствует, что они уже активированы in vivo. Индуцированный (различными стимуляторами, митогенами) синтез ЦК отражает потенциальную, резервную способность клеток отвечать на АГ -стимул (в частности, на действие лекарственных препаратов). Сниженная индуцированная продукция ЦК in vitro может служить одним из признаков иммунодефицитного состояния.
При оценке уровней ЦК необходимо помнить, что они являются АГ -неспецифическими факторами. Поэтому специфическая диагностика инфекционных, аутоиммунных и аллергических заболеваний с помощью определения уровня тех или иных ЦК невозможна. Тем не менее, изучение уровней ЦК позволяет получить информацию о функциональной активности различных типов иммунокомпетентных клеток; о тяжести воспалительного процесса, его переходе на систем- ный уровень и прогнозе; о соотношении процессов активации Th1 и 2, что очень важно при дифференциальной диагностике ряда инфекционных и иммунопатологических процессов; о стадии развития ряда аллергических и аутоиммунных заболеваний. Кроме того, определение уровней ЦК используется при применении новых иммуномодулирующих препаратов на основе рекомбинантнных ЦК и их антагонистов для изучения фармакокинетики этих препаратов, а также их споcобности индуцировать синтез других ЦК.
Однако необходимо учитывать то обстоятельство, что биологические эффекты многих ЦК, в частности IL, имеют высокую степень идентичности, которая создает достаточно широкие возможности для компенсации недостаточности или дефицита одних медиаторов другими, а также то, что многие ЦК способны взаимодействовать со структурами одних и тех же рецепторных комплексов. Именно это обстоятельство объясняет нередко отсутствие корреляции между содержанием тех или иных ЦК и клиническими особенностями течения патологического процесса. В равной степени это относится и к возможному отсутствию корреляции между уровнями ЦК и эффективностью терапии. Становится все более очевидным, что ориентация только на уже хорошо известные ЦК может не отражать истинного состояния цитокиновой регуляции, особенно если учесть, что в подавляющем большинстве случаев определение ЦК ограничено лишь несколькими из них.
РЕГУЛЯЦИЯ Т-ХЕЛПЕРОВ
Цитокины субпопуляций CD4 + Т-клеток.
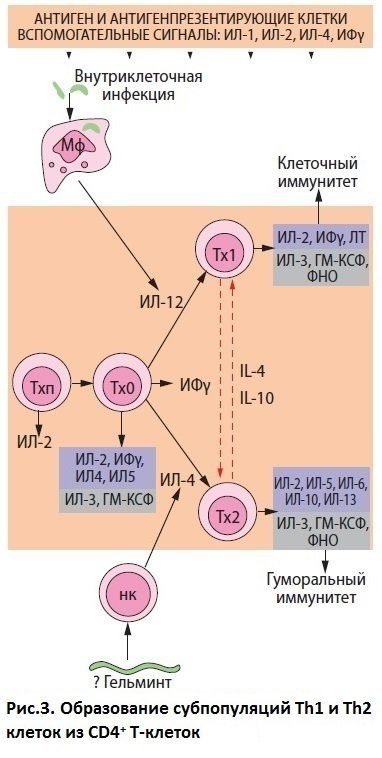 Популяцию Т-хелперов (Th) можно разделить на различные субпопуляции в зависимости от секретируемых ими ЦК. Th0 секретируют IL-2-5, INF-γ, CSF-GM и способны дифференцироваться в Th1 или Th2. Th1 участвуют в процессах клеточного иммунитета, активируют макрофаги, продуцируют IL-2 и -3, INF-γ и CSF-GM. Th2 способствуют синтезу антител (АТ) В-клетками, секретируют IL-4-6, IL-10, IL-13. ЦК, продуцируемые Th1 и Th2, оказывают взаимоингибирующее действие: INF-γ подавляет пролиферацию Th2, а IL-10 – Th1 клеток.
Популяцию Т-хелперов (Th) можно разделить на различные субпопуляции в зависимости от секретируемых ими ЦК. Th0 секретируют IL-2-5, INF-γ, CSF-GM и способны дифференцироваться в Th1 или Th2. Th1 участвуют в процессах клеточного иммунитета, активируют макрофаги, продуцируют IL-2 и -3, INF-γ и CSF-GM. Th2 способствуют синтезу антител (АТ) В-клетками, секретируют IL-4-6, IL-10, IL-13. ЦК, продуцируемые Th1 и Th2, оказывают взаимоингибирующее действие: INF-γ подавляет пролиферацию Th2, а IL-10 – Th1 клеток.
В зависимости от того, с какими клетками взаимодействует АГ на ранней стадии иммунного ответа – с макрофагами, продуцирующими IL-12, или с Т-клетками, секретирующими IL-4, – определяется характер ответа: Th1 или Th2 Нарушение баланса ЦК-продуцирующей активности Th1 и Th2 играет значительную роль в развитии аутоиммунных состояний, хронизации и прогрессировании воспалительных заболеваний. Например, если при инфекциях, вызванных внутриклеточными микроорганизмами и вирусами, произойдет переключение клеточного иммунитета на гуморальный, то будет наблюдаться осложнение течения.
Итак, имеются по крайней мере два типа Т-хелперов (Th): Тh1, которые опосредуют защиту организма от внутриклеточных инфекций и участвуют в аутоиммунных патологиях, и Th2, которые защищают организм от внеклеточных патогенов и инициируют аллергический иммунный ответ. Известно, что Тh1 и Th2 отличаются между собой набором синтезируемых цитокинов (см. рис3). Недавно были получены доказательства, что в составе Тh существуют другие популяции клеток, которые могут быть агонистами или антагонистами Тh1. Так, были открыты Тh17, которые существенно отличаются по фенотипу и физиологии от Тh1 и Тh2.
На раннем этапе Тh17 развиваются под воздействием цитокинов IL-1 и -6, а когда они приобретают способность продуцировать IL-17, появляется IL-23, который является ключевым в поддержке эффекторных функций Тh17 и увеличивает продолжительность их существования. IL-23 активирует продукцию IL-17 Тh17 в отсутствие IFN-γ и IL-4. Тh17 предпочтительно экспрессируют транскрипционный фактор ROR-c, который активирует продукцию IL-17. Сигналы, идущие от активированного Т-клеточного рецептора (TCR), являются критичными в регуляции и контроле продукции IL-17. IL-6, -12 и -23 активируют транскрипционный фактор STAT3. Было показано, что комбинация TGF-β и IL-21 может индуцировать развитие Тh17, однако TGF-β и IL-6 не способны инициировать дифференцировку Тh17, при этом сам по себе TGF-β может супрессировать генерацию Тh17 у человека. IL-1β, -6 и -23 способны управлять секрецией IL-17 короткоживущими CD4+ Т-клетками, изолированными из периферической крови человека, хотя факторы, требующиеся для дифференцировки наивных CD4 в Тh17, пока не известны. Таким образом, IL-1β и IL-6, но не TGF-β, являются основными в дифференцировке IL-17-продуцирующих Th.
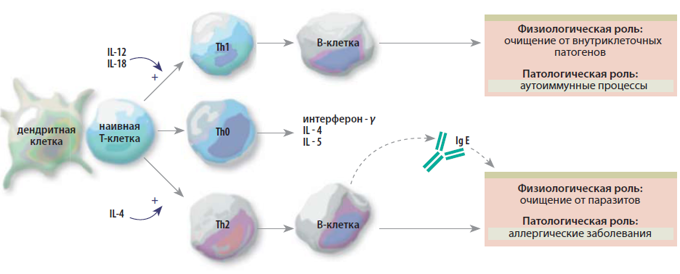
Рис. 4. Субпопуляции Th1-Th2 (по Bieber, 2008). Показано, что направление дифференцировки Th обусловлено типом дендритной клетки и микроокружением. При презентации антигена наивные Т-клетки подвергаются воздействию либо IL-12 и IL-18, либо IL-4, которые поляризуют их в Th1 или Th2, соответственно. Th1 продуцируют IFN-γ, в то время как Th2 синтезируют IL-4, IL-5 и IL 13. Th0 клетки продуцируют цитокины и Th1, и Th2 типа, возможно, в ответ на менее выраженный поляризующий сигнал. Оба типа Th имеют различную физиологическую роль, и предполагается, что баланс между этими популяциями обеспечивает нормальные условия функционирования иммунной системы. Значительное преобладание Th2 приводит к развитию патологических условий, таких как сверхпродукция IgE и аллергические заболевания.
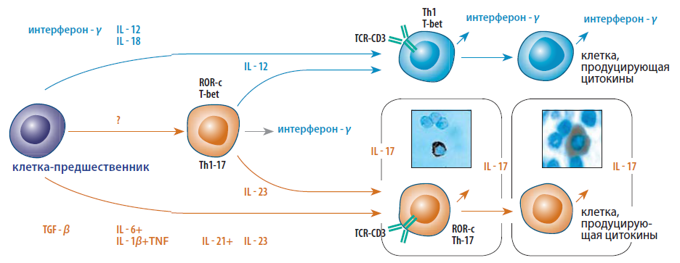
Рис. 5. Дифференцировка Th17 клеток человека (Miossec et al., 2009). Ключевые цитокины для развития Th17 клеток человека: TGF-β, IL-1β, -6, -21, -23. В дополнение к классическим Th1 и Th2, была идентифицирована смешанная подгруппа Th1-Th17, которая экспрессирует T-bet и ROR-c. При воспалении в тканях наблюдаются дифференцированные клетки, продуцирующие цитокины. На микрофотографиях показаны: окрашенная иммуногистохимически цитоплазма (антитела к IL-17 коричневый цвет) CD4+ T-клеток, активированных in vitro в течение 24 ч; и клетка в препарате ревматоидного синовия. Эти клетки утратили Т-клеточный рецептор (TCR) и CD3 комплекс.
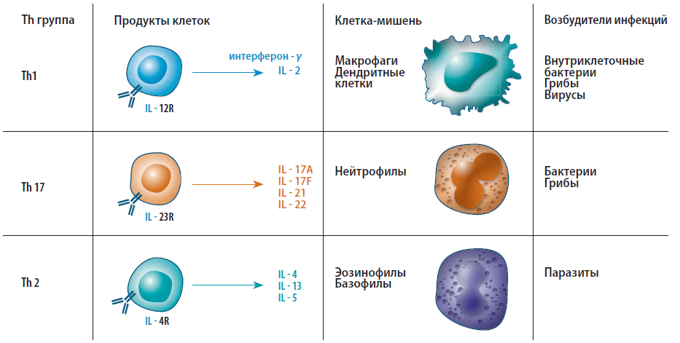
Рис. 6. Типы Th и их эффекторные функции (Miossec et al., 2009).
Показано отличие Тh17 от Тh1 и Th2 в цитокиновом профиле. В ответ на IL-23 Тh17 продуцируют IL-17A, -17F, -22, -26, IFN-γ и хемокин CCL20 (см. рисунок). Тh17 можно отнести к Т-клеткам памяти, т.к. они имеют фенотип CD4+CD45RO+. Они экспрессируют IL-23R и продуцируют IL-17 в количествах больших, чем все другие клетки. Продукция IL-17 происходит независимо от транскрипционных факторов STAT1, t-bet, STAT4 и STAT6.
IL-22 более сильно экспрессируется Тh17, чем Тh1 и Тh2. Тh17 являются основными продуцентами IL-22, а IL-23 и воспаление усиливают эту продукцию. IL-22, IL-17А и IL-17F совместно активируют продукцию антимикробных пептидов β-дефензина 2, S100A7 и S100A8.
Псориатические поражения кожи инфильтрированы Тh17, которые продуцируют IL-17A и IL-22. Было обнаружено, что кератиноциты человека, стимулированные супернатантом Т-клеток, взятых из псориатических повреждений, увеличивают продукцию кателицидина. Это увеличение было опосредовано через сигнал с IL-17R. In vitro IL-17, но не IL-22, усиливал синтез мРНК кателицидина. Можно сказать, что Тh17 являются клетками, участвующими в воспалительных и аутоиммунных процесах, с одной стороны, а с другой – осуществляют защиту организма от внеклеточных бактерий и паразитов.



 Все рецепторы ЦК представляют собой трансмембранные гликопротеины, у которых внеклеточная часть отвечает за связывание ЦК. Как правило, эти рецепторы состоят более чем из одной субъединицы, причем высокоаффинное связывание является следствием взаимодействия с разными субъединицами, каждая из которых сама способна связывать соответствующий ЦК, но с более низкой аффинностью. Одни субъединицы рецепторов реагируют только с определенным ЦК, в то время как другие способны формировать общие рецепторы для разных ЦК. Наличие общих структур в рецепторах может обусловливать функциональное сходство ряда ЦК. Кроме того, существуют общие групповые рецепторы, способствующие устранению избытка ЦК в очаге поражения. Синтез рецепторов протекает более интенсивно и длительно, чем синтез cоответствующих ЦК, что обусловливает их более полную и быструю элиминацию из сосудистого русла и реализацию биологического эффекта в очаге поражения. Растворимый рецептор, связывающийся с ЦК, – это отщепленный ферментом внеклеточный домен мембранного рецептора. Растворимые рецепторы сохраняют высокую аффинность в отношении своих лигандов и благодаря этому способны нейтрализовать ЦК, препятствуя их доступу к интактным мембранным рецепторам; их можно обнаружить в сыворотке и моче. Растворимые рецепторы могут выполнять функции конкурирующих антагонистов, а также участвовать в транспорте, доставке ЦК в очаг поражения и выведении их из организма. В результате взаимодействия ЦК с рецептором инициируется сигнал, передача которого в клетку обычно происходит либо по пути с участием янус-киназы (JAK)-STAT, либо по пути с участием киназы Ras-MAP.
Все рецепторы ЦК представляют собой трансмембранные гликопротеины, у которых внеклеточная часть отвечает за связывание ЦК. Как правило, эти рецепторы состоят более чем из одной субъединицы, причем высокоаффинное связывание является следствием взаимодействия с разными субъединицами, каждая из которых сама способна связывать соответствующий ЦК, но с более низкой аффинностью. Одни субъединицы рецепторов реагируют только с определенным ЦК, в то время как другие способны формировать общие рецепторы для разных ЦК. Наличие общих структур в рецепторах может обусловливать функциональное сходство ряда ЦК. Кроме того, существуют общие групповые рецепторы, способствующие устранению избытка ЦК в очаге поражения. Синтез рецепторов протекает более интенсивно и длительно, чем синтез cоответствующих ЦК, что обусловливает их более полную и быструю элиминацию из сосудистого русла и реализацию биологического эффекта в очаге поражения. Растворимый рецептор, связывающийся с ЦК, – это отщепленный ферментом внеклеточный домен мембранного рецептора. Растворимые рецепторы сохраняют высокую аффинность в отношении своих лигандов и благодаря этому способны нейтрализовать ЦК, препятствуя их доступу к интактным мембранным рецепторам; их можно обнаружить в сыворотке и моче. Растворимые рецепторы могут выполнять функции конкурирующих антагонистов, а также участвовать в транспорте, доставке ЦК в очаг поражения и выведении их из организма. В результате взаимодействия ЦК с рецептором инициируется сигнал, передача которого в клетку обычно происходит либо по пути с участием янус-киназы (JAK)-STAT, либо по пути с участием киназы Ras-MAP. Популяцию Т-хелперов (Th) можно разделить на различные субпопуляции в зависимости от секретируемых ими ЦК. Th0 секретируют IL-2-5, INF-γ, CSF-GM и способны дифференцироваться в Th1 или Th2. Th1 участвуют в процессах клеточного иммунитета, активируют макрофаги, продуцируют IL-2 и -3, INF-γ и CSF-GM. Th2 способствуют синтезу антител (АТ) В-клетками, секретируют IL-4-6, IL-10, IL-13. ЦК, продуцируемые Th1 и Th2, оказывают взаимоингибирующее действие: INF-γ подавляет пролиферацию Th2, а IL-10 – Th1 клеток.
Популяцию Т-хелперов (Th) можно разделить на различные субпопуляции в зависимости от секретируемых ими ЦК. Th0 секретируют IL-2-5, INF-γ, CSF-GM и способны дифференцироваться в Th1 или Th2. Th1 участвуют в процессах клеточного иммунитета, активируют макрофаги, продуцируют IL-2 и -3, INF-γ и CSF-GM. Th2 способствуют синтезу антител (АТ) В-клетками, секретируют IL-4-6, IL-10, IL-13. ЦК, продуцируемые Th1 и Th2, оказывают взаимоингибирующее действие: INF-γ подавляет пролиферацию Th2, а IL-10 – Th1 клеток.




