Общее уравнение теплового баланса химического реактора. Уравнение теплового баланса для химических реакторов, работающих в изотермическом, адиабатическом и промежуточных тепловых режимов. Тепловая устойчивость химических реакторов в случае экзо- и эндо- термических реакций. Реактор с обратимой реакцией.
В уравнении теплового баланса учитываются все тепловые потоки, входящие в реактор и выходящие из него. Такими потоками являются: Qвх – физическая теплота реакционной смеси, входящей в элементарный объём для которого составляется баланс (входной поток); Qвых – физическая теплота реакционной, покидающей элементарный объём (выходной поток); Qр – теплота химической реакции (знак может быть положительным и отрицательным); Qт.о – теплота, расходуемая на теплообмен с окружающей средой (в зависимости от соотношений температур в реакторе и в окружающей среде или в теплообменном устройстве этот поток также может быть направлен и в объём и из него); Qф.пр – теплота фазовых превращений.
Для стационарного режима работы реактора алгебраическая сумма всех тепловых потоков равна нулю: Qвх - Qвых ± Qр ± Qт.о ± Qф.пр = 0 (1)
В нестационарном режиме происходит положительное или отрицательное накопление теплоты в элементарном объёме:
Qвх - Qвых ± Qр ± Qт.о ± Qф.пр = Qнак (2)
Уравнения (1) и (2) являются общими уравнениями теплового баланса химического реактора. Различают несколько видов тепловых режимов химических реакций и соответственно конкретных видов уравнений теплового баланса
I. Изотермический – режим, характеризующийся тем, что температура на входе, внутри и на выходе одинакова. Это возможно, если выделение и поглощение теплоты в результате химической реакции компенсируется теплообменом с окружающей средой. Для стационарного изотермического процесса при постоянстве физических свойств системы можно записать: Qвх=Qвых; | Qр |=| Qт.о |.
Кроме принципиально изотермических реакторов смешения к изотермическому могут приближаться реакторы с весьма малым значением Qр, СА0 или х (степени превращения) при значительной теплопроводности в реакционной смеси. При моделировании реакторов к полностью изотермическим относятся реакторы различного вида, перемешивания жидкостного типа (Ж, Ж-Ж, Ж-Т). Изотермический режим наблюдается на полке пенного и барботажного аппаратов небольшого размера, а также в кипящем слое зернистого материала, и других аппаратах.
Характеристическое уравнение изотермического реактора: tср=tк=const.
II. Адиабатический режим характеризуется полным отсутствием теплообмена с окружающей средой. В этом случае вся теплота химической реакции расходуется на нагрев или охлаждение реакционной смеси. Для стационарного процесса |Qвх-Qвых|=|Qр|. Изменение температуры в адиабатическом реакторе ∆t прямо пропорционально степени превращения х, концентрации основного реагента СА0, тепловому эффекту реакции Qр. Изменение температуры положительно для экзотермических и отрицательно для эндотермических реакций. Уравнение теплового баланса для реакции А→В будет: G c tk ± GQpCA0x=G c tk (2), отсюда получим характеристическое уравнение: ± GQpCA0x=с (tk – tн) (2’).
Изменение температуры на любом участке по оси потока в реакторе идеального вытеснения пропорционально степени превращения: ∆t= tk – tн=±λх, где λ-коэффициент адиабатического изменения температуры: λ=(Qp * CD)/c, где
CD – концентрация продукта. Уравнение теплового баланса для элементарного участка реактора будет: ±QpCAdxA=cdt (3). Для реактора полного смешения уравнение теплового баланса такое же как (2’).
III. Промежуточный (политропный или автотермический) режим характеризуется тем, что частично теплота реакции расходуется на изменение теплосодержания (нагрев или охлаждение) реакционной смеси, а частично на теплообмен с окружающей средой. Этот режим наиболее часто встречается в ТХП. Этот режим описывается полным уравнением теплового баланса. При неизменной весовой теплоёмкости и установившемся режиме тепло, выделившееся (поглощенное) в результате реакции при степени превращения хА будет унесено продуктами реакции и передано через стенку реактора: ±GQpCA0xА=G c (tk – tн) ± kтF∆tср (4),отсюда может быть найдено: 1)изменение температуры (tk – tн), степень превращения (хА), поверхность теплопередачи (F). Это уравнение (4) получено для реактора смешения и для реактора вытеснения, в котором температура одинакова по всей длине, то есть температура теплоносителя или охлаждающего агента, находящихся в рубашке, постоянна по всей длине реактора; температура реагентов одинакова в любой точке поперечного сечения реактора. Так как температура в реакторе изменяется по его длине, тепловой баланс составляется для элементарного участка длины реактора (∆Н): GQpCA0xА=G c dt± kтF’(t-tокр)dH; где t – температура в рассматриваемом элементе реактора; tокр – температура в рубашке.
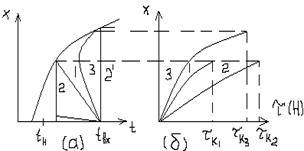
Сравнение характеристик изотермических, адиабатических и политермических процессов приведено на рисунках.

| 
|
| -Зависимость степени превращения (х) от температуры (а) и времени (б) для экзотермического процесса.
| -Зависимость степени превращения (х) от температуры (а) и времени (б) для эндотермического процесса.
|
| 1-адиабатический реактор вытеснения; 2,2’-изотермический реактор смешения; 3-политермический реактор вытеснения; tн-температура на входе в реактор (начала реакции).
|
Устойчивость работы реактора – одно из требований, которые предъявляются к ним. Согласно А. М. Ляпунову “Система называется устойчивой, если после наложения какого-либо возмущения она возвращается в прежнее состояние при снятии этого возмущения”.
Наиболее важной является температурная (тепловая) устойчивость химических реакций и реакторов. При экзо- и эндо- термических реакциях происходит авторегулировка температуры технологического процесса за счёт влияния концентрации реагентов химического процесса. В некоторых случаях при  – образной форме зависимости количества выделяемого тепла от температуры в реакторе полного слияния при обратимой экзотермической реакции.
– образной форме зависимости количества выделяемого тепла от температуры в реакторе полного слияния при обратимой экзотермической реакции.

| При температуре tв достигается стационарное устойчивое состояние при саморегуляции, но оно отвечает более низкой степени превращения (судя по тепловыделению – оно меньше) чем при температуре tа (точка А), соответствует оптимальной температуре процесса, но термически неустойчивому состоянию. Поэтому в данном случае регулирование температуры tа путём регулирования теплоотвода имеет решающее значение.
|
Устойчивость технологического режима реактора можно определить по его чувствительности при изменении того или иного параметра и называется параметрической чувствительностью: П=dy/dx, где у – входная величина – параметр (температура, расход реагентов, концентрация), х – выходная величина – параметр, характеризующий результат процесса (степень превращения, температура, время реакции).
Лекция 16.







 – образной форме зависимости количества выделяемого тепла от температуры в реакторе полного слияния при обратимой экзотермической реакции.
– образной форме зависимости количества выделяемого тепла от температуры в реакторе полного слияния при обратимой экзотермической реакции.



