Теоретическая часть
Раствором называется термодинамически устойчивая гомогенная система переменного состава, состоящая из двух или более компонентов. Компонентом называется химически однородная часть системы, способная существовать вне ее. Компонент, который сохраняет свое агрегатное состояние, принимается за растворитель. Если оба компонента сохраняют свое агрегатное состояние, то за растворитель принимается компонент, которого больше. Согласно Д.И. Менделееву, образование раствора протекает в три стадии:
1. Дробление растворяемого вещества до отдельных молекул. Эта стадия требует энергетических затрат и ее тепловой эффект (ΔH1) положителен.
2. Сольватация. Процесс взаимодействия молекул растворяемого вещества с молекулами растворителя. Если растворитель вода, то этот процесс называется гидратация. На этой стадии энергия выделяется и ее тепловой эффект (ΔH2) отрицателен.
3. Диффузия сольватированных (гидратированных) молекул растворяемого вещества в толщу растворителя. На этой стадии тепловой эффект отсутствует. Таким образом, тепловой эффект растворения складывается из двух величин (ΔH1 и ΔH2) и может быть как положительным, так и отрицательным в зависимости от соотношения первых двух стадий растворения т.е.:
ΔHраств. = ΔH1 + ΔH2.
Мерой растворимости вещества служит величина, называемая растворимость и обозначаемая S. Растворимость (S) – количество грамм вещества способного раствориться в 100 граммах растворителя. Растворимость меняется с изменением температуры. Если ΔHраств>0, то с повышением температуры растворимость растет. Если ΔHраств<0, то с повышением температуры растворимость уменьшается.
Растворы делятся на:
1. разбавленные – растворенного вещества в растворе меньше чем его растворимость;
2. насыщенные – количество растворенного вещества совпадает с его растворимостью;
3. пересыщенные – растворенного вещества в растворе больше чем его растворимость.
Вещество считается хорошо растворимым, если S≥1; малорастворимым, если 0,01≤S<1; трудно растворимым, если 0,0001≤S<0,01; нерастворимым, если S≤0,0001.
Концентрацией раствора называется количество растворенного вещества, содержащегося в определенном объеме или массе раствора или растворителя.
Способы выражения концентрации растворов:
1. Массовая доля показывает отношение массы растворенного вещества к массе раствора. Если массовая доля выражена в процентах, то на практике ее называют процентной концентрацией. Она показывает, сколько грамм растворенного вещества содержится в 100 граммах раствора и обозначается - W%.
2. Моляльная концентрация или моляльность показывает, сколько молей растворенного вещества приходится на килограмм растворителя. Чаще всего ее обозначают m (М/кг или М/1000 г).
3. Молярная концентрация или молярность показывает, сколько молей растворенного вещества содержится в 1-ом литре раствора. Ее обозначают СМ (моль/л или М).
4. Нормальная концентрация или нормальность показывает, сколько моль эквивалентов растворенного вещества содержится в литре раствора. Ее обозначают СN (моль/л, N или н.).
5. Мольная доля показывает долю молекул данного сорта от общего количества молекул раствора. Ее обозначают xi. Индекс 1 всегда относится к растворителю. Сумма всех мольных долей раствора равна 1, т.е.:
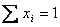 .
.
Закон эквивалентов для растворов имеет вид:
V1∙C1=V2∙C2,
где: V1, V2-объемы 1-го и 2-го растворов, соответственно, С1, С2-нормальные концентрации 1-го и 2-го раствора, соответственно.
Все растворы обладают некоторыми свойствами, которые зависят только от соотношения числа частиц компонентов раствора и не зависят от их природы. Общие свойства раствора – это свойства идеального раствора.
Идеальным называется раствор, образованный компонентами, имеющими одинаковые размеры частиц и одинаковую энергию межмолекулярного взаимодействия.
Основными законами, описывающими свойства растворов, являются: закон Генри, законы Рауля (1-й, 2-ой, 3-ий), осмотический закон Вант-Гоффа. Эти законы выполняются только для разбавленных растворов.
Все растворы независимо от агрегатного состояния обладают способностью к диффузии. Диффузией называется свойство вещества равномерно распределяться по всему предоставленному ему объему. Скорость диффузии (скорость выравнивания концентрации по объему) в газах велика, в твердых телах при обычных температурах диффузия длится годы. В растворах диффузия протекает за десятки часов, для небольших, порядка литра, объемов раствора.
Процесс односторонней диффузии растворителя через полупроницаемую мембрану называется осмосом.
При односторонней диффузии растворителя в раствор, объем последнего начинает увеличиваться, что влечет за собой увеличение гидростатического давления, которое препятствует диффузии растворителя. При некотором давлении наступает равновесие: сколько молекул растворителя проникло в раствор, столько же выталкивается из него увеличившимся давлением.
Равновесное давление раствора, препятствующее диффузии растворителя через полупроницаемую мембрану, называется осмотическим давлением.
Все растворимые в воде вещества принято условно делить на электролиты – при взаимодействии с растворителем распадаются на ионы и неэлектролиты – на ионы не распадаются. К электролитам относится большинство неорганических кислот, оснований и солей. К неэлектролитам многие органические соединения. Распад электролитов на ионы при растворении называют электролитической диссоциацией.
Электролитическая диссоциация зависит от растворителя.
Электролиты могут распадаться на ионы полностью или частично. Количественно этот процесс характеризует степень диссоциации (α), которая определяется как отношение числа молекул, распавшихся на ионы (N′), к общему числу растворенных молекул (N): α = N′/N.
Все водные растворы электролитов по степени диссоциации можно разбить на три группы:
1. Сильные электролиты, степень диссоциации которых α>0,3 (α>30%). К ним относятся все растворимые соли, кроме солей Hg, все щелочи, и ряд кислот, например: H2SO4, HNO3, HCl, HBr, HI, HClO3, HClO4, HMnO4, H2CrO4, H2Cr2O7.
2. Электролиты средней силы, степень диссоциации которых 0,03<α≤0,3 (3%<α≤30%). К ним можно отнести H2SO3, H3PO4, HF.
3. Слабые электролиты, степень диссоциации которых α≤0,03 (α≤3%). К ним относятся все нерастворимые основания, все органические электролиты, например уксусная кислота (СН3СООН), NH4OH, H2CO3, HClO, HCN, H2S.
Диссоциация сильных электролитов в водных растворах протекает до конца. Остальные электролиты диссоциируют обратимо и, следовательно, к их процессу диссоциации может быть применен закон действия масс. Например, для процесса диссоциации уксусной кислоты:
CH3COOH ⇌ CH3COO- + H+
константа равновесия равна:
 взять формулы из старой методички, равновесные концентрации!
взять формулы из старой методички, равновесные концентрации!
В случае диссоциации константу равновесия называют константа диссоциации (Кд).
Константа диссоциации зависит от природы растворителя и электролита, а также от температуры, и не зависит от концентрации раствора.
Закон разбавления Оствальда:
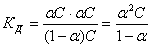
Для слабых электролитов α«1 и (1-α) ≈ 1, тогда Кд ≈ С.α2
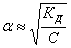
Для более сложных электролитов, например, Н3РО4 процесс диссоциации протекает по стадиям (ступенчато).
Сильные электролиты в растворе диссоциируют до конца, что приводит к высокой концентрации ионов в растворе. Свойства таких растворов существенно зависят от степени взаимодействия входящих в их состав ионов как друг с другом, так и с полярными молекулами растворителя. Таким образом, увеличение концентрации приводит к возрастанию близкодействующих сил химической связи. Законы идеальных растворов для растворов электролитов оказываются неприменимыми.
Чтобы можно было пользоваться законами для идеальных растворов в случае растворов электролитов, Льюис в 1907 г. ввел представление об эффективной концентрации, которую он назвал активностью. Активность (а) связана с концентрацией соотношением:
a = f.C,
где f – коэффициент активности, С – концентрация.
Коэффициент активности учитывает все виды взаимодействия частиц в растворе, приводящие к отклонению его свойств от свойств идеального раствора. Так как коэффициент активности учитывает также степень диссоциации электролита, то их применяют и при описании свойств растворов слабых электролитов.
Коэффициенты активности вычисляют по экспериментальным данным. Коэффициенты активности зависят от природы растворителя и растворенного вещества, от концентрации раствора и температуры.
В разбавленных растворах коэффициенты активности зависят в основном от заряда иона и концентрации и мало зависят от природы электролита. Эта закономерность известна в теории растворов как правило ионной силы. Согласно этому правилу ионы одинаковой зарядности при одной и той же ионной силе имеют одинаковые коэффициенты активности.
Ионной силой раствора называется полусумма произведений концентраций всех ионов раствора на квадрат их заряда:
I = 1/2∑CiZi2,
где: I – ионная сила, Ci – концентрация иона, Zi – заряд иона.
Правило ионной силы позволяет рассчитать коэффициенты активности отдельных ионов в разбавленных растворах. Коэффициенты активности ионов уменьшаются с увеличением ионной силы раствора и заряда иона.
При составлении уравнений реакций в растворах в ионной форме нужно придерживаться следующих правил:
1. Все сильные электролиты пишутся диссоциированном виде.
2. При наличии в растворе электролитов разной силы, более сильный пишется в диссоциированном виде, более слабый – в молекулярной (недиссоциированной) форме.
3. Все малорастворимые и нерастворимые вещества пишутся в молекулярной (недиссоциированной) форме.
Реакции в растворах идут до конца, если в результате реакции образуется более слабый электролит, осадок, газообразное вещество, комплексное соединение.
Амфотерными называются электролиты, дающие при диссоциации в воде в зависимости от условий ионы водорода (Н+) или гидроксид ионы (ОН-).
Примерами амфотерных электролитов могут служить как растворимые в воде (аминокислоты), так и нерастворимые (гидроксиды некоторых элементов).
Амфотерные гидроксиды в кислой среде выступают в качестве оснований, а в щелочной – кислот.
Экспериментальная часть





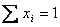 .
. взять формулы из старой методички, равновесные концентрации!
взять формулы из старой методички, равновесные концентрации!