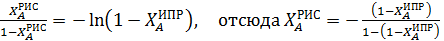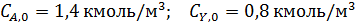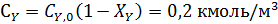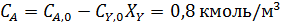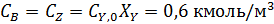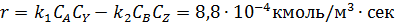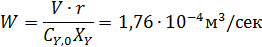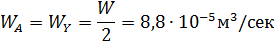4.1. Методика кинетического исследования
Проведение кинетического анализа химического процесса связано с исследованием его кинетики, установлением количественной связи между скоростью реакции и концентрациями (парциальными давлениями) реагирующих веществ в зависимости от внешних факторов (температуры, давления, фазового состояния реакционной системы, катализатора, среды и др.), механизма и кинетики элементарных реакций с участием лабильных промежуточных частиц (возбужденных молекул, радикалов, ионов и др.).
Конечной целью кинетического исследования является составление кинетической модели процесса, которая представляет собой систему кинетических уравнений, описывающих изменение состояния реакционной системы при определенных термодинамических и кинетических параметрах (например, Р, V, Т, К, k, Е, коэффициенты адсорбции, Сi, Рi и др.). Полученные сведения о кинетической модели служат основой при разработке оптимального режима химико-технологического процесса.
Кинетическое исследование может включать следующие основные этапы:
1. Критический анализ литературных источников по изучаемому или аналогичному химическому процессу с целью получения обоснованных сведений о продуктах реакций, возможных элементарных реакциях и их термодинамических и кинетических характеристиках, поведении катализаторов, влиянии продуктов и среды на отдельные реакции и химический процесс в целом и т. д.
2. Обоснование экспериментального исследования, включая такие аспекты, как выбор реакционного устройства, методики проведения опытов и анализа лабильных и стабильных продуктов.
3. Проведение эксперимента.
4. Формулировка кинетической схемы механизма химического процесса и составление на ее основе кинетических уравнений - кинетической модели.
5. Обработка экспериментальных данных по полученным кинетическим уравнениям.
Полученные сведения о кинетической модели химического процесса служат основой при разработке оптимального режима химико-технологического процесса, а в научном плане - в установлении механизма реакций.
Кинетическому исследованию процесса всегда предшествует предварительный этап, о котором говорилось на прошлой лекции. Обобщаются также литературные данные о механизме и кинетике изучаемых реакций.
Следующий, очень ответственный этап состоит в разработке экспериментальной установки и методики исследования, обеспечивающих достаточную точность и воспроизводимость опытов. Сюда входят выбор и проверка работы реакционного аппарата, регулирующих и измерительных приборов, способов анализа реакционной массы и т. д. Воспроизводимость, кроме того, зависит от качества и стабильности свойств применяемых реагентов, растворителей и катализаторов. Поэтому их качество и способы очистки надо обязательно охарактеризовать и поддерживать постоянными во время опытов. Полезно иметь какой-то базовый опыт и периодически повторять его, чтобы убедиться в воспроизводимости получаемых данных.
Само кинетическое исследование основано на том, что экспериментально определяемые результаты (Сi, ηi) зависят от дифференциальных уравнений скорости реакций и от параметров процесса. Чтобы найти кинетические уравнения, необходимо варьировать все параметры, которые могут влиять на скорость: начальные концентрации (парциальные давления) всех реагентов (а нередко и продуктов реакции, которые могут ее автокатализировать или тормозить), концентрацию катализатора, температуру, а также временные характеристики процесса (длительность реакции или так называемое условное время контакта). Обычно наиболее сложной задачей является нахождение концентрационной формы уравнений скорости (3.2). Она упрощается, если каждый опыт проводится в изотермических условиях, когда параметры химической реакции постоянны. С этой же целью типична постановка в первую очередь большой серии опытов при одной, предварительно подобранной температуре, но с варьированием всех остальных параметров. Найдя по этим данным кинетические уравнения и проведя уже меньшее число опытов при двух-четырех других температурах, находят зависимость параметров реакции от температуры по уравнениям типа уравнений Аррениуса.
4.2. Классификация идеальных реакторов
Поиск кинетических уравнений упрощается при изучении процесса в реакционных аппаратах, обеспечивающих наиболее простую связь между результатами процесса и варьируемыми параметрами. К таким аппаратам относятся реактора с идеальным режимом (структурой) потока реакционной смеси:
- реактор идеального или полного смешения (периодический и непрерывный);
- реактор идеального вытеснения (непрерывный).
Для краткости их называют идеальный периодический реактор, идеальный реактор смешения и идеальный реактор вытеснения.
Кинетические уравнения в дифференциальной форме служат основой для расчета размеров реакторов, необходимых для получения данного количества продукта.
Исходным соотношением, используемым для расчета размеров реакторов, является материальный баланс, составляемый по одному из компонентов реакционной смеси.
Для элементарного объема реактора материальный баланс можно записать в следующем виде:
| Количество вещества, поступающего в элементарный объем в единицу времени
|
=
| Количество вещества, выходящего из элементарного объема в единицу времени
|
+
| Количество вещества, израсходованного в результате химической реакции, притекающей в элементарном объеме
|
+
| Количество вещества, накопленного в элементарном объеме
|
В зависимости от типа реактора уравнение упрощается и окончательные выражения, полученные после интегрирования, служат основными характеристическими уравнениями для данного типа реактора.
4.3. Идеальный периодический реактор
Отличительной особенностью идеального периодического реактора (ИПР) является отсутствие градиента концентрации по объему (dC/dV=0), что достижимо при высокой скорости перемешивания, ведущей и к постоянству температуры (dT/dV=0). Дополнительным условием идеальности состоит в том, что все исходные компоненты смеси загружаются одновременно и моментально.
Уравнение материального баланса по основному реагенту А для некоторого момента времени имеет вид:
|
+
| Количество реагента А, израсходованного в результате химической реакции
|
=
|
‒
| Количество реагента А, накапливаемого в единице объема
| |
| Отсюда находим
| |
| Количество реагента А, израсходованного в единицу времени в результате реакции, моль
|
=
|
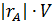
| 
|
| Количество реагента А, накапливаемого в единицу времени, моль
|
=
| 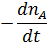
|
=
| 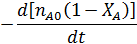
|
=
| 
| |
| | | | | | | | | | | | |
Получаем 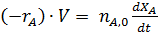
После разделения переменных и интегрирования находим

Данное уравнение позволяет определить время, необходимое для достижения заданной степени конверсии реагента А и является основным в расчете периодических реакторов. Скорость реакции и объем находятся в подынтегральном выражении, т.к. в общем случае они могут рассматриваться как переменные.
Если объем реакционной смеси остается неизменным, то
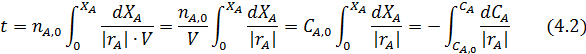
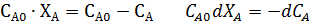
Если объем изменяется пропорционально превращению исходных компонентов, то уравнение приобретает вид:
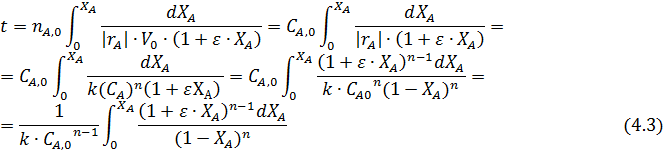
ИПР в основном применяют для жидкофазных реакций. Их выполняют в виде аппаратов с мешалкой и теплообменом за счет рубашки и внутренних змеевиков (рис. 4.1, а), пустотелых аппаратов с перемешиванием жидкости за счет ее циркуляции через выносной теплообменник (рис. 4.1, б) или реакционных колонн с перемешиванием за счет барботирования газа-реагента и внутренним либо выносным теплообменом (рис. 4.1, в). Вначале в аппарат загружают только один из реагентов и, если требуется, растворитель и катализатор. Второй реагент подают постепенно или даже непрерывно.
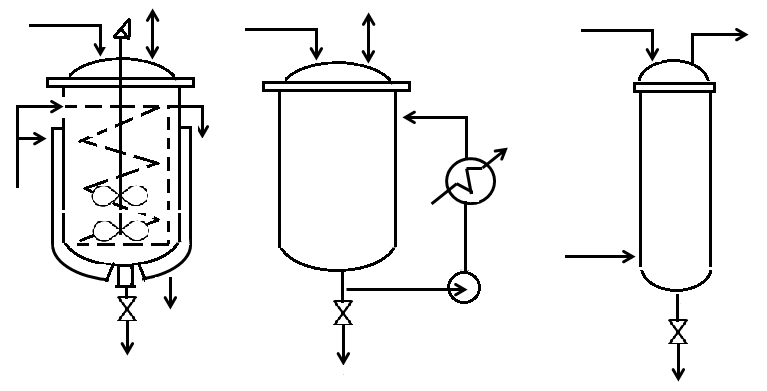
а б в
Рис.4.1. Типы аппаратов близкие к ИПР: а – аппарат с мешалкой и внутренним теплообменом; б - аппарат с циркуляционным перемешиванием и внешним теплообменом; в - колонна с перемешиванием барботирующим газом
Периодические условия используют преимущественно для кинетического исследования жидкофазных реакций. Реактором, как правило, служит колба или автоклав с мешалкой, помещаемые в термостат, с помощью которого поддерживается нужная температура. Аппарат снабжен устройствами для загрузки компонентов смеси (воронками), термометром и, если нужно, обратным холодильником и пробоотборником.
После начала реакции в точно фиксированное по секундомеру время отбирают пробы реакционной массы и анализируют состав реакционной массы.
| Периодические условия изучения кинетики наименее трудоемки ‒ за один опыт получают ряд экспериментальных точек при разном времени реакции. Результаты сводят в таблицу экспериментов, где сопоставляются варьируемые параметры и найденные текущие концентрации веществ. Нередко их изображают также графически в виде кинетических кривых в координатах Сi-t (рис.4.2).
|
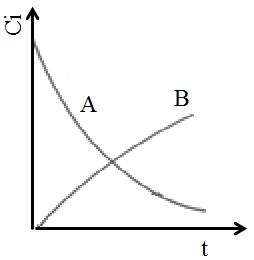 Рис. 4.2. Концентрационные кривые в ИПР Рис. 4.2. Концентрационные кривые в ИПР
|
4.4. Реакторы непрерывного действия
Для нахождения соотношения между скоростью загрузки реагентов F А,0 в проточный реактор и объемом реактора V используют понятиями условного времени пребывания и условной объемной скорости, которые определяются следующим образом:
| Условное время пребывания
|
τ
|
=
| 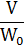
|
=
| Отношение объема реактора к объему исходных веществ, поступающих в него в единицу времени, измеренному при определенных условиях
|
Время
|
|
|
|
|
|
|
|
|
| Условная объемная скорость
| u
| =
| 
| =
| Величина обратная условному времени пребывания
| Время-1
|
Условная объемная скорость, которая составляет 5 час-1, означает, что при данных условиях объем вещества, поступающего в реактор за 1 час, равен его пятикратному объему.
Условное время пребывания, например, 2 мин., означает, что объем вещества, поступающий в реактор каждые две минуты, численно равен его объему.
Применяя данные понятия можно произвольно выбирать температуру, давление или агрегатное состояние вещества, при котором определяется объем веществ, загружаемых в реакторы. При этом значения условных времени пребывания и объемной скорости будут зависеть от выбранных условий измерения. Если указанные условия соответствуют фактическому состоянию исходных реагентов на входе в реактор, то

Если W0 =W, то V/ W0, т.е. отношение объема реактора к объему поступающих в реактор в единицу времени исходных веществ, измеренному при определенных условиях и имеющему размерность времени, равно истинному времени контакта (t): τ = t.
Обратная величина левой части уравнения F А,0 / V представляет собой удельную нагрузку реактора по реагенту А (число молей в единицу времени на единицу реакционного объема).
4.4.1. Реакторы идеального вытеснения
В реакторе идеального вытеснения (РИВ) каждый элемент реакционной массы движется вдоль оси потока с одинаковой линейной скоростью. Этим исключается торможение потока насадкой или стенками и диффузионные явления, из которых особенно существенно обратное или продольное перемещение. При стационарном режиме работы, т.е. при постоянных во времени скорости и составе поступающих компонентов, каждый элемент реакционной массы пребывает в реакторе вытеснения одинаковое время, а концентрация реагентов и температура постоянны в каждом поперечном сечении.
В РИВ состав меняется по длине аппарата, поэтому материальный баланс необходимо составлять для элементарного объема dV (рис. 4.3).
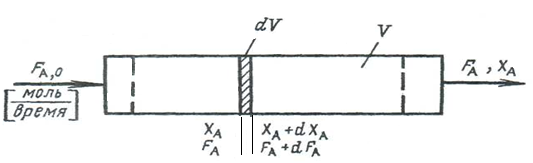
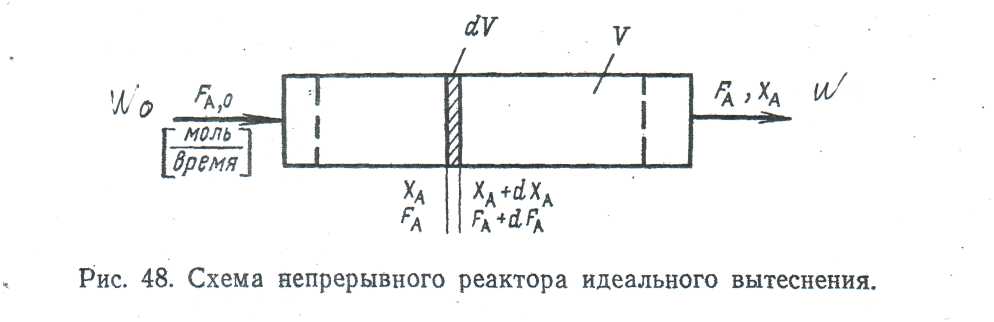

Рис. 4.3. Схема непрерывного реактора идеального вытеснения
Материальный баланс по веществу А выражается соотношением:
| Количество вещества, поступающего в элементарный объем в единицу времени, FА, кмоль/час
|
=
| Количество вещества, выходящего из элементарного объема в единицу времени, FА +dFА, кмоль/час
|
+
| Количество вещества А, исчезающее в результате химической реакции, притекающей в элементарном объеме, 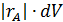
|
Отсюда следует 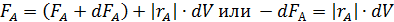
Учитывая, что
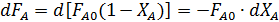
Находим выражение материального баланса по веществу А для элементарного объема реактора:
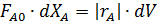
Разделяя переменные и интегрируя, получаем:

При постоянстве объеме реакционной смеси объемный поток W 0, приведенный к температуре и давлению реактора, также постоянен, т.е. W0 =W = const и можно записать F А0 =С А0 · W0 и dF А =dС А ·W0.
Это позволяет получить концентрационную форму уравнения:

Для необратимой реакции n-ого порядка

В случае изменения объема смеси реагирующих веществ в ходе реакции
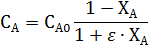
Отсюда
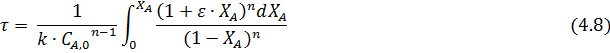
Реакторы вытеснения широко используются в технологии органического синтеза и нефтепереработки. Такой тип реакторов используется в процессах гидрирования, дегидрирования, окисления, пиролиза и т.д. Простейший реактор вытеснения – змеевиковый (рис. 4.2, а). В многотоннажных процесса широко используют реакторы со сплошным неподвижным слоем катализатора (рис. 4.2, б). Например, такие реакторы применяют в процессах гидрокрекинга, риформинга, изомеризации парафинов, прямой гидратации этилена, дегидрирования углеводородов в олефины. Для проведения эндотермических и экзотермических реакций используют трубчатые реакторы (рис. 4.2, в). Если реакция проходит в присутствии катализатора, то катализатор может находиться как в трубках (трубчатый реактор), так и в межтрубном пространстве (кожухотрубный реактор).
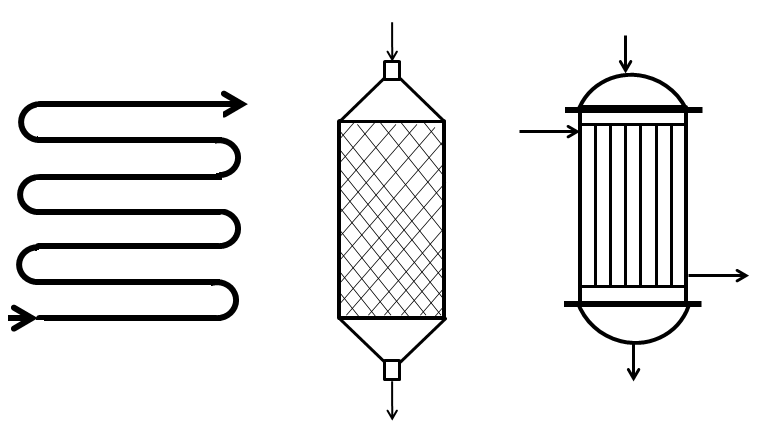
а б в
Рис. 4.2. Типы реакторов, близкие к моделям идеального вытеснения: а - змеевиковый; б – аппарат с насадкой; в – трубчатый.
РИВ применяют для кинетического исследования газофазных реакций, в том числе гетерогенно-каталитических. Реактор изготавливают в виде трубки (которую можно заполнять катализатором) или змеевика. Газообразные вещества подают в аппарат из баллонов или газометров, точно регулируя и изменяя скорость их потока. Жидкие вещества вводят при помощи микронасосов. Прежде чем подать в реактор все компоненты смешивают и предварительно подогревают до температуры реакции. Для обеспечения постоянной температуры реактор помещая в термостат или баню с псевдоожиженным слоем песка, а также при помощи электрообогрева. Для реакций с большим выделением или поглощением тепла целесообразно применять трубки малого диаметра, разбавлять гетерогенный катализатор инертной насадкой и т. д.
Перед началом каждого опыта через реактор надо пропустить 3—5 объемов смеси заданного состава, чтобы в аппарате установился стационарный режим. После этого накапливают пробу продуктов и анализируют ее тем или иным методом, начиная следующий опыт при других параметрах процесса. Следовательно, каждый опыт дает только одну экспериментальную точку, обусловливая большую длительность и трудоемкость исследования по сравнению с периодическими условиями. При этом варьируют те же параметры, но вместо времени изменяют условное время контакта (V/FA,0 или mk/FA,0)
| Экспериментальные данные сводят в таблицы; если нужно, представляют их в виде кинетических кривых в координатах Сi-V/FA,0 или mk/FA,0 (рис. 4.4). Эти же таблицы и графики могут содержать и вычисленные из опытов данные о селективности сложных реакций.
|  Рис. 4.4. Концентрационные кривые в РИВ Рис. 4.4. Концентрационные кривые в РИВ
|
4.4.2. Непрерывный реактор идеального смешения
Условием идеальности реактора идеального смешения (РИС) является отсутствие градиента концентрации и температуры (dC/dV=0, dТ/dV=0).
| При стационарном режиме концентрация и температура постоянны также во времени.
В таком аппарате концентрация реагента А в исходной смеси СА,0 моментально падает из-за разбавления в большом объеме реакционной массы до некоторой величины СА, равной его концентрации в смеси, выходящей из реактора (рис. 4.5).
| 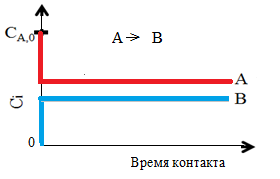 Рис. 4.5. Концентрационные прямые в РИС Рис. 4.5. Концентрационные прямые в РИС
|
Учитывая особенности РИС, уравнение материального баланса по реагенту А имеет следующий вид:
| Количество вещества А, поступающего в реактор в единицу времени
|
=
| Количество вещества А, выходящего из реактора в единицу времени
|
+
| Скорость расходования вещества А в результате химической реакции, притекающей в реакторе
|
|
Количество вещества А, поступающего в реактор в единицу времени, моль
|
=
|
F А.0
|
| Количество вещества А, выходящего из реактора в единицу времени моль
| =
|
F А = F А.0(1-Х А)
|
| Скорость расходования вещества в результате химической реакции, притекающей в реакторе
|
=
|
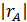 V V
| 
|
| | | | | | | | |
Подставляя эти соотношения в выражение для материального баланса, получим:
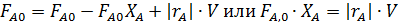
Отсюда

или

Если W0 =W, тогде τ = t истинное время реакции.
Таким образом, для реактора идеального смешения уравнение материального баланса не содержит дифференциальных выражений.
Реакторы полного смешения имеют преимущества при проведении очень быстрых и сильно экзотермических реакций. В этом случае при значительной концентрации реагентов на входе в аппарат вытеснения выделяется слишком много тепла, и возможен перегрев смеси или даже взрыв. В отличие от этого в реакторе смешения происходит моментальное разбавление реагентов в большом объеме реакционной смеси, и весь процесс идет при низкой их концентрации в безопасных условиях. Нередко режим смешения оказывается благоприятным для выведения смеси за пределы взрывоопасных концентраций, а также для проведения гетерофазных процессов, когда перемешивание ускоряет процессы массопередачи.
В реакторах периодического действия и идеального вытеснения концентрации изменяются во времени или по объему, и конечный результат находят после интегрирования (интегральные реакторы). В отличие от этого, в аппарате полного смешения градиент концентраций отсутствует (безградиентные условия процесса), а конечный результат находят, решая алгебраическое уравнение, что значительно упрощает расчет.
Безградиентные условия применяют для кинетического изучения главным образом газофазных (в том числе гетерогенно- каталитических) реакций. Реактор может быть устроен по типу, изображенному на рис. 4.6, а. Он должен иметь хорошо действующую мешалку, на которой может находиться и помещенный в металлическую сетку гетерогенный катализатор. Наибольшее применение нашли так называемые проточно-циркуляционные установки (рис. 4.6, б), в которых осуществляется циркуляция реакционной смеси через реакционное пространство (катализатор). При высокой степени циркуляции такие установки близки к реактору полного смешения. Остальное оснащение безградиентных установок и последовательность проведения опытов — такие же, как для реакций в потоке. Очень важно, что температурный режим в них регулируется проще и точнее, а результаты исследования газофазных гетерогенно- каталитических реакций в безградиентных условиях считаются самыми достоверными.
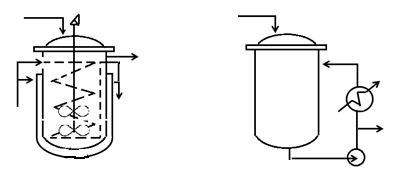
а б
Рис. 4.5. Типы аппаратов, близкие к моделям полного смешения: а – аппарат с мешалкой и внутренним теплообменом; б – проточно-циркуляционный реактор с выносным теплообменником
Пример 1. Жидкофазная необратимая реакция первого порядка протекает без изменения плотности реагирующих веществ в ИПР. Продукты реакции в исходной смеси отсутствуют. За 120 с в целевой продукт превращается 20% исходного вещества.
Определить степень конверсии за 360 с в РИВ и РИС.
Решение.
Для ИПР и РИВ в случае реакции, протекающей без изменения плотности реакционной смеси, характеристическое уравнение имеет один и тот же вид (4.2 и 4.6). Решая его для необратимой реакции первого порядка, получим следующее равнение 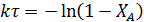
Так как известно, что при τ1=120 с степень конверсии ХА,1= 0,2, то для τ2=360 с степень конверсии можно найти из соотношения:
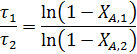
откуда 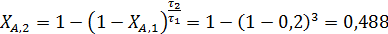
Таким образом, степень превращения в ИПР и РИВ будет одинаковым.
Характеристическое уравнение для РИС (4.10) для реакции первого порядка будет иметь вид 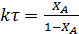 .
.
Поскольку левые части характеристических уравнений 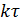 для ИПР равны, то приравняв правые части уравнений можно определить степень конверсии, достигаемую в РИС при τ1 и τ2:
для ИПР равны, то приравняв правые части уравнений можно определить степень конверсии, достигаемую в РИС при τ1 и τ2:
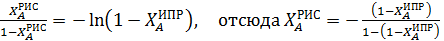
Подставляя в полученное уравнение значения степеней конверсий, достигнутых в ИПР при τ1 и τ2, получим степени конверсии в РИС ХА,1= 0,182 и ХА,2= 0,401. Как видно из полученных результатов, за одно и то же время в РИС достигается меньшая степень конверсии по сравнению с ИПР и РИВ.
Пример 2. Обратимая реакция А+Y↔В +Z протекает в жидкой фазе в РИС, объем которого V = 0,12 м3. = 0,05 м3·кмоль-1·сек-1.
В реактор непрерывно с одинаковой объемной скоростью поступают два потока жидкости, в одном из которых содержится 2,8 кмоль/м3 реагента А, а в другом – 1,6 кмоль/м3 реагента Y.
Определить с какой скоростью необходимо подавать каждый раствор, чтобы за это время прореагировало 75 % реагента Y.
Решение
Из-за разбавления концентрации реагентов на входе в реактор уменьшаются в два раза. 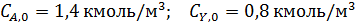
Из уравнений материального баланса находим:
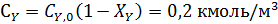
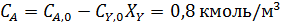
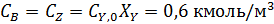
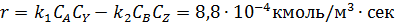
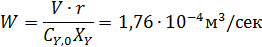
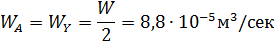
Вопросы для самопроверки
1. Обоснуйте порядок кинетических исследований.
2. Выведите характеристическое уравнение для ИПР.
3. Выведите характеристическое уравнение для РИВ.
4. Выведите характеристическое уравнение для РИС.
5. Расскажите, в каких случаях в непрерывных реакторах истинное время реакции равно условному времени контакта.
6. Что означает условная объемная скорость?
7. Приведите примеры технологических реакторов близких по структуре к ИПР, РИВ и РИС.





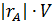

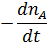
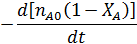

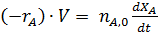

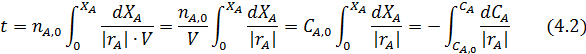
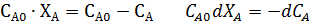
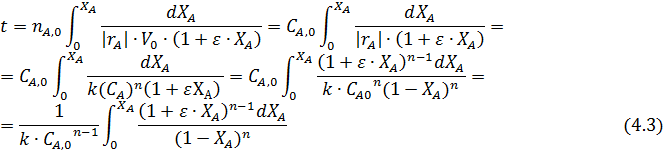

 Рис. 4.2. Концентрационные кривые в ИПР
Рис. 4.2. Концентрационные кривые в ИПР
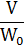




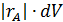
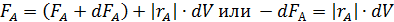
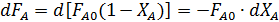
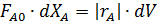



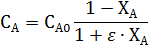
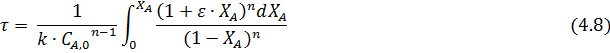

 Рис. 4.4. Концентрационные кривые в РИВ
Рис. 4.4. Концентрационные кривые в РИВ
 Рис. 4.5. Концентрационные прямые в РИС
Рис. 4.5. Концентрационные прямые в РИС
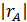 V
V
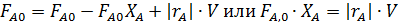



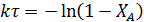
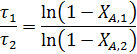
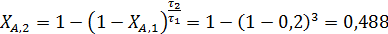
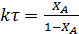 .
.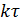 для ИПР равны, то приравняв правые части уравнений можно определить степень конверсии, достигаемую в РИС при τ1 и τ2:
для ИПР равны, то приравняв правые части уравнений можно определить степень конверсии, достигаемую в РИС при τ1 и τ2: