Химическая термодинамика даёт информацию о состоянии системы только в условиях равновесия. Между тем для решения многих задач химической технологии необходимо знать закономерности, определяющие протекание процесса в пространстве и времени. Они выявляются при его экспериментальном исследовании, которому всегда предшествует обобщение литературных данных о получении данного продукта или о подлежащем изучению процессе. При технологической направленности исследования на основании этого выбирают метод синтеза, основанный на сопоставлении себестоимости и доступности сырья, выхода и селективности по целевому продукту и т. д.
Далее обычно следует этап исследования, состоящий в поиске одного или нескольких вариантов проведения процесса, наиболее благоприятных для его интенсивности и селективности. На этом этапе выбирают способ проведения реакции (в газовой или жидкой фазе), растворители или разбавители, вторые реагенты (если возможно их варьирование), инициаторы, гомогенные или гетерогенные катализаторы и т. д. Обычно на этом же этапе приближенно оценивают область изменения параметров (концентрация, давление, температура), при которой получаются удовлетворительные результаты процесса, идентифицируют все образующиеся продукты, а также ставят балансовые опыты, задачей которых является подведение материального баланса реакции, что оформляется в виде таблиц.
Затем наступает следующий этап исследования, при котором варьируют параметры процесса и определяют их влияние на его результаты (выход и селективность). В технологическом исследовании иногда ограничиваются сведением данных в таблицы или представлением графиков зависимостей без их количественной обработки, т. е. без поиска математических уравнений, описывающих эти зависимости. Однако отсутствие этих уравнений не дает возможности поиска оптимальных условий процесса, моделирования и расчета реакторов, вследствие чего становится все более необходимым количественное описание исследуемого процесса.
При одном из методов зависимость результата процесса (функция отклика y) от его параметров xi представляют в виде уравнения регрессии:
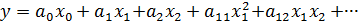
Этот метод имеет определенную ценность, особенно для описания зависимостей типа состав ‒ свойство, но менее пригоден для выявления пространственно‒временных закономерностей. Его недостатки состоят в отсутствии физического смысла как у самого уравнения, так и у его коэффициентов (аi) и опасности экстраполирования уравнения за пределы варьирования параметров. Кроме того, полученное описание процесса применимо только для той установки, в которой проводился эксперимент, или для ее достаточно точной модели.
Другой кинетический метод исследования лишен отмеченных недостатков, имеет строгое научное обоснование и является универсальным для количественного изучения разнообразных процессов, особенно химических реакций. Он имеет важное значение в двух аспектах: теоретическом (для обоснования механизмов реакций и решения вопросов реакционной способности) и практическом (для расчета химических реакторов, для моделирования и оптимизации протекающих в них процессов).
3.1. Скорость простых элементарных химических реакций
Скорость химической реакции является важнейшей количественной характеристикой динамики химического процесса. Под скоростью гомогенной гомофазной реакции по i ‒му веществу понимают изменение количества i ‒ого вещества (в молях, кмолях) в результате химической реакции в единицу времени в единице реакционного объема:

При постоянстве реакционного объемам его можно ввести под знак дифференциала и получить концентрационное выражение скорости превращения вещества:

В гетерогенно каталитических реакциях активную поверхность, на которой протекает реакции, определить, как правило, трудно. Поэтому скорость гетерогенно-каталитических превращений i ‒ого вещества обычно относят к массе катализатора mК:

При проведении химической реакции в потоке при стационарных условиях скорость реакции по i ‒му веществу определяют как производную мольного потока i -ого вещества (Fi) по реакционному объему (для гомофазных реакций) или к массе катализатора (для гетерогенно-каталитических реакций) при химических превращениях:

Для простой элементарной реакции
νАА + νYY→ νВВ + νZZ
скорость можно выражать по любому веществу, но ее численные значения будут неодинаковы из-за различий в стехиометрических коэффициентах.
Единственное, или инвариантное значение скорости реакции можно получить разделив равенство dnА /νА = dni /νi = dn на Vd τ:

Тогда скорость превращения по любому веществу равна:

Данное выражение применимо к элементарным реакциям.
Рассмотрим, например, реакцию: А + 2Y→ 3В
Если скорость рассчитать по реагенту А, то уравнение скорости будет равно: 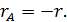
При расчете по реагенту Y уравнение скорости имеет вид:  .
.
Если рассмотреть скорость образования продукта В, то уравнение скорости имеет вид: 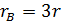
Следовательно, 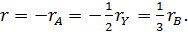
Если при сложных реакциях i ‒е вещество образуется и расходуется по нескольким простым элементарным реакциям, то скорость по i ‒му веществу связана со скоростью простых элементарных реакций, в которых участвует i ‒е вещество уравнением:

где rj – скорость реакции по i ‒му веществу в j –ой реакции, ν i,j – стехиометрический коэффициент i ‒ого вещества в j -ой реакции.
Пример 1. Циклогексан вступает в следующие реакции:
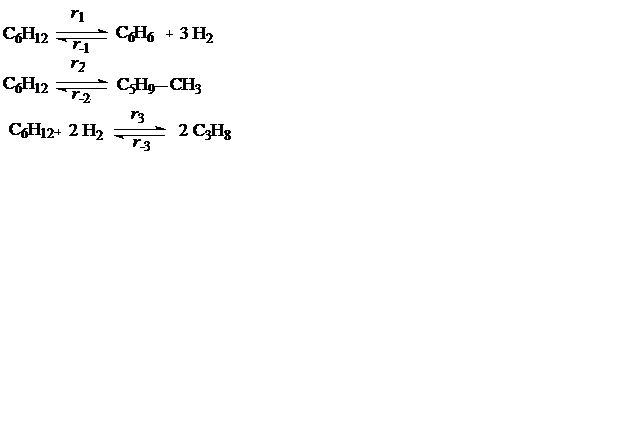
Выразить через набор ri скорости превращения циклогексана, бензола и водорода.
Решение.
Пользуясь уравнением (3.6) находят скорости реакций по компонентам:
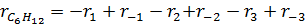
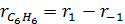
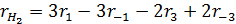
Переменными, определяющими скорость реакций, являются состав, температура и давление в системе. Таким образом, для скорости расходования компонента А, можно написать: 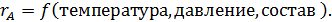
Уравнения, описывающие зависимость скорости реакции от концентраций реагирующих веществ, называется кинетическим уравнением.
При постоянном давлении и температуре реакции кинетическое уравнение можно записать как произведение концентраций реагирующих веществ в соответствующих степенях. В уравнениях скорости реакции используют действующие концентрации веществ, которые изображают с помощью квадратных скобок, например, [А].
Например, для химической реакции A + Y → B кинетическое уравнение имеет вид:
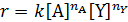 (3.7)
(3.7)
Коэффициент пропорциональности k в уравнении(3.7) называют константой скорости реакции. Она численно равна скорости реакции при концентрации всех веществ, равной единице.
Константа скорости реакции меняется с температурой по уравнению Аррениуса:
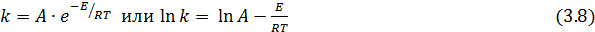
где А – предэкспотенциальный множитель, Е – истинная энергия активации.
Величину ni называют порядком реакции по i- му веществу, сумму порядков по всем реагирующим веществам ‒ общим порядком реакции.
Для простых элементарных реакций порядок реакции по i -му веществу совпадает со стехиометрическими коэффициентами, а общий порядок реакции, равный сумме стехиометрических коэффициентов, ‒ с молекулярностью. Для неэлементарных реакций порядок реакции и молекулярность могут отличаться. Причем порядок неэлементарной реакции может приобретать не только положительные цельночисленные значения, но и дробные и отрицательные.
Кинетические уравнения элементарных реакций имеют следующий вид:
| - мономолекулярные А→В + Z
| 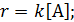
|
| - бимолекулярные 2А→В + Z
| 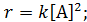
|
| или А + Y→В + Z
| 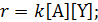
|
| - n ‒ого порядка
| 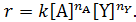
|
В уравнении скорости реакции можно применять любые величины, эквивалентные концентрации компонентов, например, парциальные давления. При этом, какую бы величину не использовали, порядок остается неизменным, но меняется размерность константы k. Размерность константы скорости реакций k зависит от порядка реакции (табл. 3.1).
Таблица 3.1. Размерность константы скорости реакции
| Порядок реакции
| Размерность константы скорости реакции
|
| Гомогенные жидкофазные реакции
|
| Нулевой порядок
| 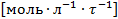
|
| первый порядок
| 
|
| второй порядок
| 
|
| любой порядок
| 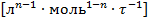
|
| Жидкофазные гетерогенно-каталитические реакции
|
| любой порядок
| 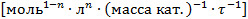
|
| Гомогенные газофазные реакции
|
| любой порядок
| 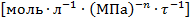
|
| Газофазные гетерогенно-каталитические реакции
|
| любой порядок
| 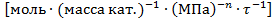
|
3.2. Влияние среды на скорость элементарных реакций
Для жидкофазных реакций в растворе на скорость реакции оказывает существенное влияние среда (электролиты, полярные и неполярные растворители). Все явления, наблюдаемые при взаимодействии растворителя и растворенного вещества, объединяют термином сольватация. Различают электростатическую (неспецифическую) и специфическую сольватацию.
Электростатическая сольватация обусловлена силами кулоновского притяжения типа ион ‒ диполь или диполь ‒ диполь. Специфическая сольватация (образование водородных связей, π‒ комплексов и других донорно-акцепторных комплексов) в ряде случаев оказывается более сильное влияние на скорость и направление реакции, чем неспецифическая (электростатическая) сольватация. В этом случае растворитель проявляет специфическое химическое сродство к одному или ко всем участниками реакции.
В зависимости от механизма взаимодействия между растворителем и растворенным веществом растворители можно разделить на три группы: протонные, полярный апротонные и аполярные апротонные.
Протонные растворители содержат атомы водорода, связанные с электроотрицательными атомами (-О-Н, -N-H), и способны образовывать водородные связи. Для них характерна высокая диэлектрическая проницаемость и сильная поляризация. К протонным растворителям относятся вода, аммиак, спирты, карбоновые кислоты и первичные амины.
Полярные апротонные растворителе не образуют водородных связей. Для низ характерны высокая диэлектрическая проницаемость, высокая полярность и заметный дипольный момент. К полярным апротонным растворителям относятся ацетон, ацетонитрил, N,N-диметилацетамид, N,N-диметилформамид, диметилсульфоксид, нитробензол, пропиленкарбонат и др.
Аполярные апротонные растворители слабо взаимодействуют с растворенным веществом. Для них характерны низкая диэлектрическая проницаемость и слабый дипольный момент. К аполярным апротонным растворителям относятся алифатические и ароматические углеводороды, их галогенозамещенные производные, третичные амины и дисульфид углерода.
В общем случае способность растворителя к сольватации реагирующих частиц может привести как к ускорению, так и к замедлению реакции. Не прибегая к теории переходного состояния, трудно оценить влияние растворителей на скорость химической реакции, поэтому вспомним основные положения этой теории.
Теория активных соударений была сформулирована С. Аррениусом в 1889 г. Он предположил, что реагировать между собой могут только те молекулы, которые находятся в активной форме, образующейся из обычных молекул. Такие молекулы были названы активными, а энергия, необходимая для перевода обычных молекул в активное состояние, энергией активации.
На основе теории активного соударения Аррениуса в 30-х годах двадцатого века Э.Вигнером, М.Поляни, Г.Эйрингом, М.Эвансом была разработана теория активированного (переходного) комплекса. В основу теории было положено представление о столкновении молекул как непременном условии реакции, но при этом рассматривается механизм столкновения молекул.
В самом деле, в ходе химической реакции разрушаются одни и возникают другие молекулы, происходит изменение химических связей, т.е. перераспределение электронной плотности. Если бы старые связи в ходе реакции сразу полностью разрушались, то на это потребовалось бы большое количество энергии, и реакция протекала крайне медленно. Как показали исследования, в ходе реакции система проходит через переходное состояние, через образование активированного комплекса. Например, ход реакции 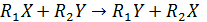 можно представить схемой:
можно представить схемой:

| 
| 

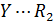
| 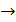
| 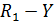

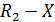
|
| Исходные молекулы
|
| Переходный комплекс
|
| Продукты реакции
|
В активированном комплексе старые связи еще не разорваны, но уже ослаблены, новые связи наметились, но еще не образовались. Время существования его не велико (10-14 – 10-11 с). При распаде комплекса образуются либо продукты реакции, либо исходные вещества.
Для образования переходного комплекса необходима энергия. Система в переходном состоянии имеет более высокую энергию, чем в исходном и конечном состояниях (рис. 3.1).
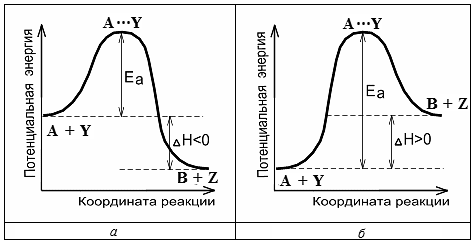
Рис. 3.1. Энергетические диаграммы химических реакций А + Y → B + Z: а – экзотермической, б – эндотермической
Энергия, необходимая для перехода вещества в состояние активированного комплекса, называется энергией активации (Еа).
Если реакция А + Y → B + Z проходит в растворе, то реагенты и активированный комплекс будут сольватированы в различной степени, зависящей от сольватирующей способности растворителя. В зависимости от степени сольватации реагентов и активированного комплекса реакция может ускоряться или замедляться (рис. 3.2).
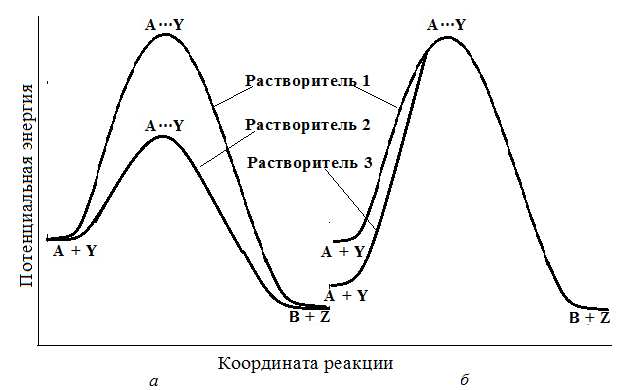
Рис. 3.2. Энергетическая диаграмма химической реакции в трех растворителях: а- реакции с несольватированным (растворитель 1) и с сольватированным (растворитель 2) активированным комплексом; б - реакции с несольватированными (растворитель 1) и с сольватированными (растворитель 3) реагентами.
Из рис. 3.2, а видно, что в растворителе 2 при сольватации активированного комплекса энергия активации ниже, чем в растворителе 1, в котором не сольватируются ни реагенты, ни активированный комплекс. Снижение энергии активации в растворителе 2 приводит к увеличению скорости реакции. В растворителе 3 (рис. 3.2, б) сольватируются только реагенты, поэтому энергия активации увеличивается, что сопровождается снижением скорости реакции. Сольватация продуктов реакции не влияет на скорость реакции.
В реальных условиях, как правило, сольватированы как исходные реагенты, так и активированный комплекс. Замедление или ускорение реакции будет определяться знаком разности эффектов сольватации реагентов и активированного комплекса.
При взаимодействии иона и нейтральной молекулы

заряд рассредоточен по активированному комплексу, поэтому он сольватируется полярным растворителем в меньшей степени, чем исходного иона. Свободная энергия исходных веществ в более полярном растворителе снижается сильнее, чем свободная энергия активированного комплекса, и разность этих величин отрицательная, что ведет к снижению скорости реакции.
При взаимодействии нейтральных молекул (диполь ‒ диполь)

активированный комплекс, наоборот, сольватируется полярным растворителем сильнее реагентов и наблюдается обратный эффект, т.е. в более полярном растворителе скорость реакции увеличивается.
При радикальном взаимодействии

малополярные исходные вещества и активированный комплекс имеют близкую полярность, что ведет к их слабой сольватации и незначительному изменению скорости реакции в более полярном растворителе.
3.3. Кинетические уравнения для неэлементарных химических реакций
Для неэлементарных реакций кинетические уравнения существенно усложняются, и они составляются на основании механизма реакции.
Возьмем в качестве примера неэлементарную реакцию А +Y→В +Z, протекающую в две стадии:

где А* - нестабильный промежуточный комплекс или частица.
Каждая из этих элементарных реакций имеет простое кинетическое уравнение.
При выводе общего кинетического уравнения часто используют принцип стационарности Боденштейна-Семенова, согласно которому скорость изменения концентрации промежуточного соединения так мала по сравнению со скоростью изменения концентрации реагента, что ее можно приравнять нулю.

Из этого уравнения находят концентрацию [А*] как функцию измеряемых концентраций компонентов:
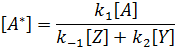
Подставляя значение [А*] в уравнение скорости элементарной реакции накопления основного продукта
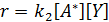
получают
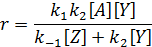
Кинетическое уравнение оказывается сложным, но оно упрощается в в зависимости от соотношения скоростей элементарных стадий.
Нередко одна из стадий идет значительно медленнее, чем другие, и ограничивает общую скорость процесса. Ее называют лимитирующей стадией.
Если превращение А* в конечный продукт происходит значительно медленнее его обратного превращения в А, т.е. k 2[ Y] << k -1[ Z], то лимитирующей является вторая стадия. В этом случае, слагаемым k 2[ Y] в знаменателе можно пренебречь, и уравнение принимает вид:
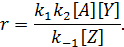
При равновесии скорость прямой и обратной реакций равны:
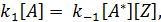
отсюда
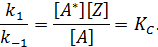
Следовательно, 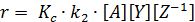
И наоборот, если вторая стадия протекает значительно быстрее обратной реакции, т.е. k 2[ Y] >> k -1[ Z], то лимитирующей является первая стадия и общее уравнение скорости после соответствующих преобразований имеет вид:
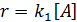
Таким образом, механизм реакции определяет вид кинетического уравнения, и, наоборот, по экспериментальному уравнению скорости реакции можно судить о механизме реакции. Связь между ними лежит в основе количественного описания химических процессов.
3.4. Преобразование кинетических уравнений с учетом разных форм состояний реагентов и катализаторов
При составлении кинетических уравнений на основании механизма протекающих реакций концентрации веществ, входящих в кинетические уравнения, обозначались исключительно в квадратных скобках. Это означает, что данная действующая концентрация относится только к форме реагента находящейся в скобках. Она не обязательно равна его аналитической концентрации, т.к. при образовании различных комплексов, реагент находится в системе в разных формах и только сложение этих форм дает его суммарную концентрацию, которую определяют аналитическим анализом и по которой судят о кинетике процесса. Таким образом, аналитическая концентрация реагентов равна

Поэтому при выводе кинетических уравнений через аналитические (суммарные) концентрации реагентов первоначально требуется оценить возможность их существования в разных формах. Затем необходимо представить действующие концентрации веществ через аналитические и подставить в уравнение кинетики. Решение задачи упрощается, когда действующая концентрация равно аналитической или один из реагентов находится в избытке и можно считать, что 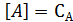 . Если в уравнение кинетики входят растворители или катализаторы, концентрация которых остается постоянной в ходе реакции, то их концентрации учитывают в дальнейших расчетах в константе скорости реакции
. Если в уравнение кинетики входят растворители или катализаторы, концентрация которых остается постоянной в ходе реакции, то их концентрации учитывают в дальнейших расчетах в константе скорости реакции
Рассмотрим на примерах, вытекающие отсюда выводы.
Пример 2. Реакция карбоновых кислот с аминами

описывается кинетическим уравнением
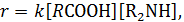
в котором фигурируют реагенты в их свободном несвязанном виде. Однако, известно, что при взаимодействии кислоты с амином образуется соль, переводящая значительную часть реагентов в нереакционноспособное состояние:

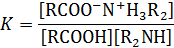
Отсюда 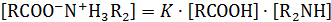
С учетом этого равновесия аналитическая концентрация кислоты и амина будут равны
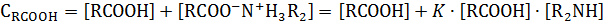
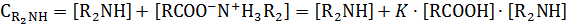
Общее решение этой системы уравнений дает сложное выражение, которое упрощается при эквимольном соотношении реагентов, когда

Подставляя найденные концентрации свободных форм кислоты и аммиака в исходное кинетическое уравнение, получают:

При большой константе равновесия и аналитической концентрации веществ можно пренебречь единицей под корнем, что дает:
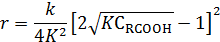
Если пренебречь единицей в последнем выражении по сравнению с 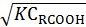 , то получают
, то получают
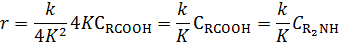
Следовательно, по кинетике бимолекулярная реакция с учетом солеобразования превратилась в реакцию первого порядка с наблюдаемой константой скорости, обратно пропорциональной константе равновесия при образовании соли между реагентами.
Пример 3. При щелочном дегидрохлорировании хлоргидрина с образованием окиси этилена протекает реакция

которая включает следующие стадии:


Равновесие на первой стадии устанавливается моментально, и скорость лимитируется второй стадий, имеющей кинетическое уравнение
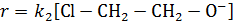
Аналитические концентрации основания и хлоргидрина можно записать в виде балансовых уравнений:
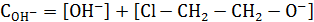

Если один компонент, например, хлоргидрин, находится в избытке по сравнению с основанием, можно считать справедливым равенство
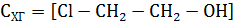
Из уравнения константы равновесия

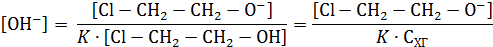
Тогда
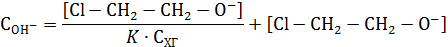


При очень малой константе равновесия можно в знаменателе пренебречь произведением 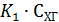 по сравнению с единицей, что дает уравнение второго порядка. Наоборот, при большой константе равновесия можно пренебречь единицей, и в результате получаем уравнение первого порядка. При промежуточных значениях константы будет наблюдаться дробный кажущийся порядок по хлоргидрину, изменяющийся от 0 до 1.
по сравнению с единицей, что дает уравнение второго порядка. Наоборот, при большой константе равновесия можно пренебречь единицей, и в результате получаем уравнение первого порядка. При промежуточных значениях константы будет наблюдаться дробный кажущийся порядок по хлоргидрину, изменяющийся от 0 до 1.
Таким образом, кинетические уравнения, выраженные через аналитические концентрации, могут существенно усложняться из-за нахождения реагентов в нескольких формах. Вид этих уравнений зависит от величины константы равновесия при образовании комплексов, от соотношения реагентов и других факторов, определяемых свойствами участвующих в реакции веществ и условиями проведения процесса.
Вопросы для самопроверки
1. Расскажите о скорости химической реакции и константе скорости химической реакции, их размерности в случае гомогенных и гетерогенных реакций.
2. Кинетические уравнения химического процесса.
3. Расскажите о порядке и молекулярности реакции. В каких случаях они не совпадают? Покажите на примерах
4. Расскажите о влиянии неспецифической и специфической сольватации на скорость реакции, используя примеры
5. Расскажите, каким образом составляют кинетические уравнения неэлементарных реакций на основании механизма реакции, используя метод Боденштейна-Семенова. Приведите примеры.
6. Для следующей системы реакций



запишите через rj скорости превращения бензола, этил- и диэтилбензола.
7. Постройте первичное кинетическое уравнение неэлементарной реакции идущей по механизму

Преобразуйте его в концентрационную форму, если известно, что реагенты и продукты не дают каких-либо комплексов, а промежуточная частица Х получается в пренебрежительно малом количестве. Проанализируйте частные случаи выведенного уравнения.
8. Постройте первичное кинетическое уравнение неэлементарной реакции идущей по механизму

Преобразуйте его в концентрационную форму, если известно, что реагенты и продукты не дают каких-либо комплексов, а промежуточная частица Х получается в пренебрежительно малом количестве. Проанализируйте частные случаи выведенного уравнения.
9. Постройте первичное кинетическое уравнение обратимой реакции идущей по механизму

Преобразуйте его в концентрационную форму, если известно, что реагенты и продукты не дают каких-либо комплексов, а промежуточная частица Х получается в пренебрежительно малом количестве. Проанализируйте частные случаи выведенного уравнения.
10. Преобразуйте кинетические уравнения из примеров 7,8,9 как функции одной переменной (СА или ХА) с учетом материального баланса соответствующих реакций.





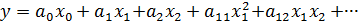






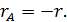
 .
.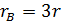
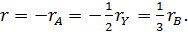

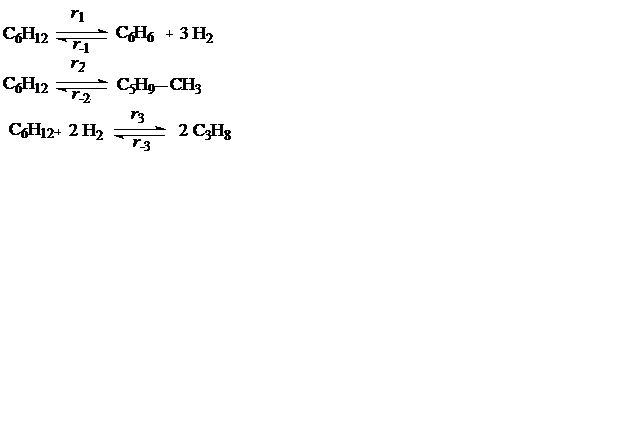
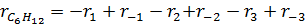
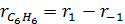
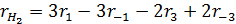
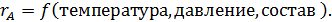
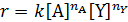 (3.7)
(3.7)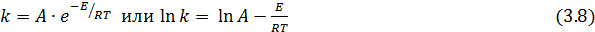
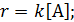
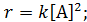
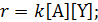
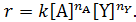
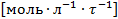


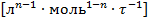
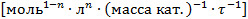
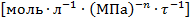
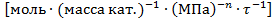
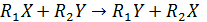 можно представить схемой:
можно представить схемой: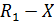

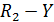
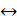


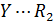
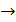
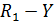
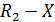







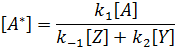
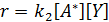
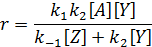
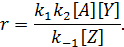
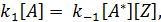
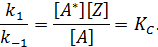
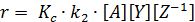
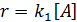

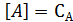 . Если в уравнение кинетики входят растворители или катализаторы, концентрация которых остается постоянной в ходе реакции, то их концентрации учитывают в дальнейших расчетах в константе скорости реакции
. Если в уравнение кинетики входят растворители или катализаторы, концентрация которых остается постоянной в ходе реакции, то их концентрации учитывают в дальнейших расчетах в константе скорости реакции
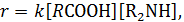

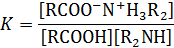
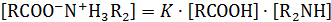
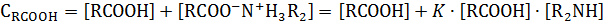
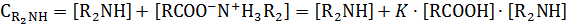


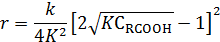
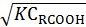 , то получают
, то получают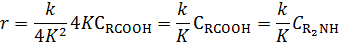



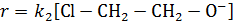
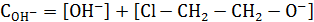

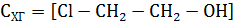

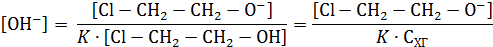
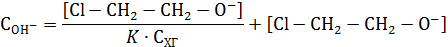


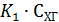 по сравнению с единицей, что дает уравнение второго порядка. Наоборот, при большой константе равновесия можно пренебречь единицей, и в результате получаем уравнение первого порядка. При промежуточных значениях константы будет наблюдаться дробный кажущийся порядок по хлоргидрину, изменяющийся от 0 до 1.
по сравнению с единицей, что дает уравнение второго порядка. Наоборот, при большой константе равновесия можно пренебречь единицей, и в результате получаем уравнение первого порядка. При промежуточных значениях константы будет наблюдаться дробный кажущийся порядок по хлоргидрину, изменяющийся от 0 до 1.








