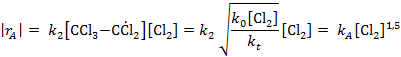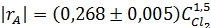5.1. Основные принципы нахождения параметров кинетического уравнения
В результате опытов с варьированием параметров процесса получают ряд кривых или таблиц, из которых можно сделать полуколичественные выводы о влиянии тех или иных факторов. Дальнейшая задача состоит в подборе математических уравнений, адекватно описывающих результаты эксперимента и нахождения параметров этих уравнений (констант скорости и равновесия, абсорбционных коэффициентов, порядков реакции, энергии активации). Обычно для этого надо сделать вероятностное предположение (гипотезу) о механизме реакции и последовательности образования продуктов, вывести на этом основании кинетические уравнения, решить их для данного типа реактора и проверить соответствие эксперименту.
После получения опытных данных с варьированием параметров наступает стадия обработки эксперимента. Первым ее этапом является выдвижение гипотезы о схеме превращения и о механизме реакции. Гипотезу о механизме реакций выдвигают на основании имеющихся теоретических представлений.
Нахождение параметров уравнения основано на принципе максимума правдоподобия, согласно которому наилучшими значениями параметров являются те, которые при подстановке в кинетическое уравнение обеспечивают наибольшую сходимость расчетных значений с экспериментальными данными. Другими словами, поиск констант уравнений сводится к методу наименьших квадратов, который имеет две разновидности: линейный МНК и нелинейный. При использовании метода линейного МНК требуется предварительная линеаризация кинетических уравнений, которые обычно нелинейны в отношении своих констант. Когда поиск констант ведут с помощью нелинейного МНК, то значение параметров находят путем разложения уравнений в ряд Тейлора.
Для линеаризации кинетических уравнений используют два метода: интегральный и дифференциальный.
При интегральном методе выбирают кинетическую модель с соответствующим уравнением скорости. После интегрирования и других математических преобразований устанавливают, что график зависимости С от t, построенный в некоторых специальных координатах х и y, должен быть прямолинейным.
При дифференциальном методе выбирают кинетическую модель и непосредственно проверяют соответствие между выражением скорости, полученным из этой модели, и экспериментальными данными. Однако для такого сопоставления необходимо найти значение производной dn/(V·dt) по опытным данным.
Интегральный метод используют при постановке опытов в ИПР или РИВ. По дифференциальному методу обработку ведут по дифференциальным уравнениям, находя скорости из опытов в безградиентных условиях (РИС) или дифференцированием кинетических кривых.
После нахождения параметров кинетического уравнения оценивают его адекватность с экспериментом статистическими методами.
5.2. Кинетика реакций в периодических условиях
Периодические условия используют для изучения кинетики жидкофазных процессов, и реже — для реакций, протекающих в газовой фазе. В обоих случаях реакционный объем остается практически постоянным, и для описания процесса пригодно уравнение (4.2), которое для периодических аппаратов используют обычно в концентрационной форме. При подстановке в него общего выражения для скорости необратимой реакции с кинетическим уравнением простого типа и проведении исследования при постоянной температуре, когда константу скорости можно вынести из-под знака интеграла, получаем:
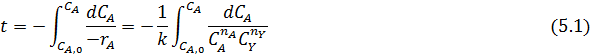
Если реагирует только одно вещество А, а другой реагент отсутствует, имеет постоянную концентрацию или находится в большом избытке,, а также если реакция имеет по нему нулевой порядок, в подынтегральном выражении имеется только одна переменная СА, и уравнение приобретает вид:

Когда взаимодействуют два реагента кинетическое уравнение можно преобразовать как функцию концентраций основного реагента А. Поскольку данный метод используют преимущественно для жидкофазных реакций, при которых объем реакционной смеси остается постоянным, то концентрации второго реагента находят из материального баланса При постоянном объеме
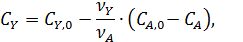
что дает:
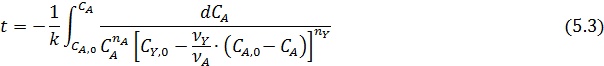
Для нахождения неизвестных порядков реакции и констант скорости проводят ряд опытов в изотермических условиях, изучая зависимость текущих концентраций СА или СB от времени t. В этом отношении периодические реакторы очень удобны: за один: опыт можно получить много экспериментальных точек путем непрерывного наблюдения за изменением какого-либо свойства системы или путем периодического отбора и анализа проб в разное время реакции. Через эти точки легко провести так называемую кинетическую кривую, которая имеет разный вид в зависимости от уравнения скорости данной реакции. Однако одной кинетической кривой недостаточно, и для большей достоверности результатов надо провести еще несколько экспериментов при разных начальных концентрациях и мольных соотношениях реагентов. Обычно для реакций с кинетическим уравнением простого типа достаточно иметь по 4-6 точек при двух-трех комбинациях начальных концентраций реагентов.
| Таким образом, в результате опытов получаем некоторый набор данных СА (или СВ) - t, который при разных начальных условиях дает семейство кинетических кривых (рис. 5.1). Дальнейшая задача состоит в обработке этих данных с целью найти единое уравнение, правильно описывающее полученные результаты. Для этого обычно бывает необходимо решать вышеприведенные интегралы, что возможно, если известны порядки реакции. Следовательно, приходится вначале задаваться ими, решать интеграл и проверять его соответствие эксперименту. Такой метод обработки кинетических данных называется интегральным. При предварительном подборе порядков реакции делают возможные предположения о механизме процесса.
| 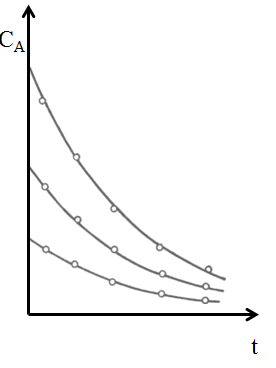 Рис. 5.1. Кинетические кривые простой реакции в периодических условиях
Рис. 5.1. Кинетические кривые простой реакции в периодических условиях
|
Соответствие опытов определенному кинетическому уравнению проверяют по интегральным выражениям, получаемым при решении предыдущих интегралов. Для наиболее часто встречающихся порядков реакции они приведены в табл. 5.1. Нередко это соответствие проверяют подстановкой в уравнения найденных величин СА и t - по постоянству вычисленных констант скорости. Однако наиболее приемлем графический метод, состоящий в изображении полученных данных в таких координатах [ f( СA ) - t ], которые при правильности исходных положений должны привести к линейным зависимостям. При этом лучше всего откладывать по оси ординат (против t) такую функцию, чтобы все точки расположились на одной прямой, что облегчает последующую статистическую обработку опытов. Для реакций с кинетическими уравнениями простых типов эта прямая выходит из начала координат и тангенс угла ее наклона равен константе скорости k. В табл. 5.1 такие функции концентраций взяты в квадратные скобки.
Этот способ линеаризации при обработке опытных данных применим ко многим более простым вариантам кинетики реакций. Он позволяет уже визуально определить соответствие таких уравнений выбранной зависимости, в то время как в других координатах бывает трудно решить, соответствует данное семейство точек уравнениям параболы, гиперболы или других кривых. Оценку этого соответствия и выбор между несколькими вариантами решений можно осуществить статистическими методами. Расчет константы скорости е следует проводить не по наклону проведенной прямой, а способом наименьших квадратов с оценкой ее средней квадратичной ошибки.
Таблица 5.1. Уравнения для интегральной обработки опытов, проведенных в периодических условиях при постоянном объеме
| №
| Кинетическое уравнение
| Решение уравнения в интегральной форме
|
|
| 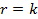
| 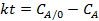
|
|
| 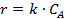
| 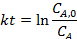
|
|
| 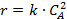
| 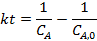
|
|
| 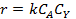
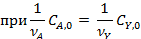
| 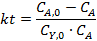
|
|
| 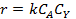
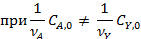
| 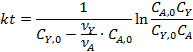
|
|
| 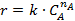
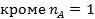
| 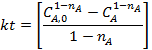
|
Пример 1. Жидкофазная реакция

изучалась в периодических условиях при постоянной температуре и двух разных начальных концентрациях реагентов. Путем титрования непревращенной щелочи были получены следующие результаты:
| СА,0,
моль/л
| СY,0,
моль/л
| СY, моль/л при разном значении t, мин.
|
|
|
|
|
|
|
| 0,4
| 0,4
| 0,32
| 0,245
| 0,201
| 0,122
| 0,065
|
| 0,4
| 0,4
| 0,319
| 0,245
| 0,202
| 0,121
| 0,066
|
| 0,4
| 0,4
| 0,322
| 0,247
| 0,2
| 0,12
| 0,068
|
| 0,2
| 0,3
| 0,265
| 0,22
| 0,205
| 0,158
| 0,134
|
Обосновать механизм и кинетическое уравнение реакции, найти константу скорости и ее доверительный интервал, а также определить коэффициент корреляции.
Решение.
Из литературных данных известно, что для реакций замещения диарилхлорметанов наиболее вероятен SN1-механизм, поэтому для расчетов используем уравнение 2 из табл. 5.1. Определение концентрации Ar2CHCl проводят исходя из полноты реакции, рассчитанной по реагенту Y и баланса СА = СА0 - n.
Расчет константы скорости реакции и проверку адекватности выбранного уравнения 2 экспериментальным данным проводят в программе Mathcad.
1. Ввод данных для параллельных опытов 1-3:
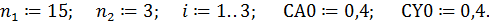
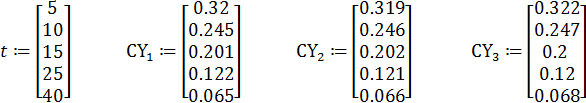
2. Ввод формулы для расчета САi: 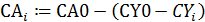
3. Ввод уравнения 2 табл. 5.1 для расчета функции yi: 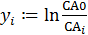
4. Проверка соответствия экспериментальных данных с уравнением 2 из табл. 5.1. путем их линеаризации в координатах yi –t (рис. 5.2).

|
Рис. 5.2. Линеаризация опытов 1-3 при интегральной обработке кинетических данных
|
Точки удовлетворительно уложились на прямую, что делает принятую гипотезу вероятной.
5. Расчет константы скорости реакции k:
- объединяют экспериментальные данные опытов 1-3.

- рассчитываем константу скорости реакции методом наименьших квадратов (функция slope): 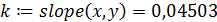
6. Статистическая обработка полученных результатов, рассчитывая:
- функцию yr: 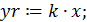
- среднее значение концентрации реагента А:
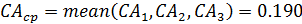
- среднее отклонение концентрации реагента А ΔСА:
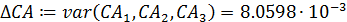
- среднее отклонение функции Δ у:
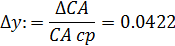
- дисперсию воспроизводства функции у:
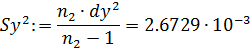
- дисперсию адекватности:
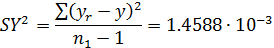
- критерий Фишера:
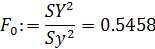
- табличное значение критерия Фишера:
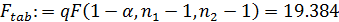
Расчётное значение критерия Фишера меньше, чем его табличное значение, что свидетельствует об адекватности уравнения опыту.
7. Расчет доверительного интервала
- средняя квадратичная ошибка в константе:
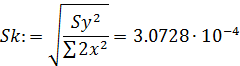
- критерий Стьюдента: 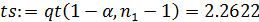
- доверительный интервал 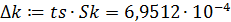
- максимальное допустимое значение константы скорости реакции:
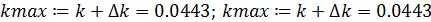
- максимальное допустимое значение константы скорости реакции:
8. Расчет коэффициента корреляции: 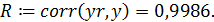
9. Расчет константы скорости для 4 реакции
Задаем параметры стадии; 
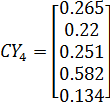
По уравнению материального баланса рассчитываем СА4:
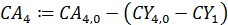
Задаем уравнение: 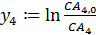
И рассчитываем константу скорости k4:
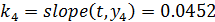
Константа скорости k4 находится в доверительном интервале.
10. Кинетическое уравнение реакции
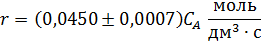
5.3. Кинетика реакций в РИВ
Для изучения газофазных реакций, в том числе гетерогенно-каталитических. используются главным образом непрерывные РИВ. К идеальной модели РИВ близки трубчатые реакторы, в которых линейная скорость газа или пара значительно преобладает над скоростью диффузии. В связи с этим лучше применять достаточно длинные трубки небольшого диаметра, что одновременно облегчает создание изотермичного режима.
Ввиду часто встречающегося изменения объема при газофазных реакциях обычно используют общее уравнение реактора идеального вытеснения (4.5). При подстановке в него уравнения скорости необратимой реакции и при изотермических условиях, когда константу можно вынести из-под знака интеграла, получаем:
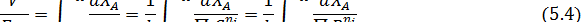
Таким образом, при исследовании процесса в реакторах идеального вытеснения надо варьировать удельную нагрузку, определяя соответствующие степени конверсии, связанные друг с другом уравнением (5.4). Как и в периодических условиях, варьируются также парциальные давления реагентов и их мольные отношения, а иногда и общее давление в аппарате. Исследование в непрерывных реакторах более трудоемко, чем в периодическом. Здесь каждый опыт дает только одну экспериментальную точку, перед его началом требуется холостой пробег для выхода на стационарный режим, а при самом опыте требуется накопить количество продуктов, достаточное для анализа и точного составления баланса. Поэтому разумное снижение числа опытов, поставленных по тщательно продуманному плану, а также применение многофакторного эксперимента является в этом случае значительно более важным, чем для периодических условий.
Обработка полученных результатов интегральным методом аналогична изложенной ранее для периодических условий. При решении интеграла (5.4) надо выразить все переменные через одну, а именно через степень конверсии ХА. Для этого используют рассмотренные ранее уравнения материального баланса, связывающие текущие парциальные давления Pi или концентрации Сi с начальными (РА,0; СА,0, βY), коэффициентом изменения объема ε и степенью конверсии ХА. Так, при необратимой реакции между двумя реагентами А и Y с кинетическим уравнением простого типа при постоянной температуре имеем:
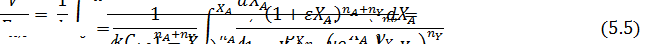
В уравнении (5.5) СA,0 можно заменить на PA,0/RT. Если кинетическое уравнение выражено как функция парциальных давлений  , в том же уравнении CA,0 заменяется на PA,0 что, естественно, ведет к изменению величины и размерности константы скорости.
, в том же уравнении CA,0 заменяется на PA,0 что, естественно, ведет к изменению величины и размерности константы скорости.
Решения интегралов для наиболее часто встречающихся кинетических уравнений простого типа приведены в табл. 5.2. Они же справедливы, при постоянстве объема реакционной смеси, когда уравнения упрощаются, поскольку ε = 0. В квадратных скобках интегральных выражений заключены f (XА), которые следует откладывать по оси ординат против V/FA,0 при линеаризации опытов.
Таблица 5.2. Уравнения для интегральной обработки опытов, проведенных в РИВ в газовой фазе.
| №
| Кинетическое уравнение
| Решение уравнения в интегральной форме
|
|
| r =k
| 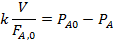
|
|
| 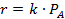
| 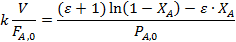
|
|
| 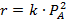
| 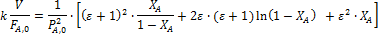
|
|
| 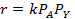
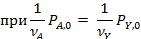
| 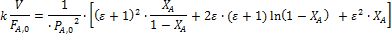
|
Пример 2. Газофазную необратимую реакцию пиролиза хлорпроизводного

изучали в змеевиковом реакторе, близком к модели РИВ, при Т =const и общем давлении 0, 1 МПа. Одну серию опытов проводили без разбавления, а вторую – с разбавлением инертным газом в соотношении 1:1. Получены следующие результаты:
| РА,0,
МПА
| ХА при разных V/FA,0 (в л·мин/моль)
|
|
|
|
|
|
| 0,10
| 0,165
| 0,292
| 0,540
| 0,743
|
| 0,05
| 0,092
| 0,170
| 0,362
| 0,575
|
Найти кинетическое уравнение, константу скорости и ее доверительный интервал. Среднее отклонение ХА в четырех параллельных опытах составляет ± 0,0015.
Решение
Из литературных данных известно, что пиролиз хлорпроизводных обычно протекает по реакции первого порядка. Проверяем эту гипотезу, обрабатывая опыты по уравнению 2 из табл. 5. 2.
Решение
Расчет константы скорости реакции и проверку адекватности выбранного уравнения 2 экспериментальным данным проводим в программе Mathcad.
1. Вводим исходные данные
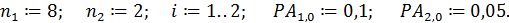
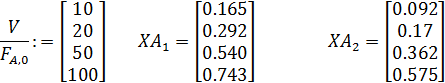
2. Рассчитываем коэффициенты изменения объема
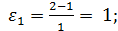
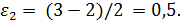
3. Рассчитываем для каждого опыта функцию yi:
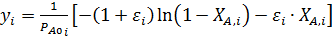
и откладываем ее против 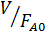 . Соответствие их прямой линии свидетельствует о вероятной адекватности уравнения эксперименту (рис. 5.3).
. Соответствие их прямой линии свидетельствует о вероятной адекватности уравнения эксперименту (рис. 5.3).

| Рис. 5.3. Линеаризация опытов при интегральной обработке кинетических данных для газофазной реакции в РИВ,
где f - 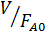 . .
|
Точки удовлетворительно уложились на прямую, что делает принятую гипотезу вероятной.
4. Объединяем экспериментальные данные опытов 1-3.

5. Рассчитываем константу 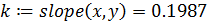
6. Проводим статистическую обработку полученных результатов, рассчитывая:
- функцию yr: 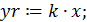
- среднее значение степени конверсии реагента А:
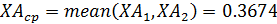
- среднее значение давления реагента А
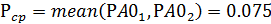
- среднее отклонение степени конверсии реагента А ΔXА:
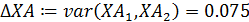
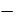 среднее значение коэффициента изменения объема
среднее значение коэффициента изменения объема
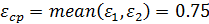
- среднее отклонение функции Δ у:
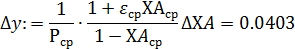
- дисперсию воспроизводства функции у:
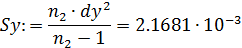
- дисперсию адекватности:
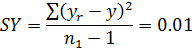
- критерий Фишера:
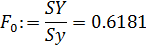
- табличное значение критерия Фишера:
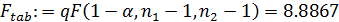
Расчётное значение критерия Фишера меньше, чем его табличное значение, что свидетельствует об адекватности уравнения опыту.
7. Расчет доверительного интервала
- средняя квадратичная ошибка в константе:
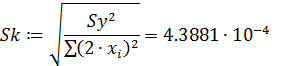
- критерий Стьюдента: 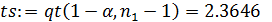
- доверительный интервал 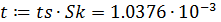
8. Расчет коэффициента корреляции: 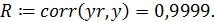
9. Кинетическое уравнение реакции
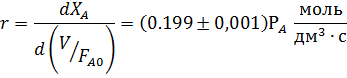
5.4. Дифференциальные методы
Применение интегральных методов значительно осложняется, когда кинетические уравнения оказываются сложными или содержат несколько констант, которые требуется найти из опытных данных. В этих случаях наиболее подходят дифференциальные методы, отличительной особенностью которых является обработка опытов непосредственно по дифференциальному кинетическому уравнению без его интегрирования. При этом набор численных значений скорости реакции при соответствующих значениях Сi (Pi) можно получить двумя путями:
1) дифференцированием кинетических кривых, полученных в ИПР или в РИВ;
б) вычисление скоростей из экспериментальных данных, полученных в безградиентных условиях (РИС)..
5.4.1. Дифференциальный способ обработки опытов, проведенных в интегральных реакторах
Если получены более двух экспериментальных данных СА –t (в ИПР) или ХА - (V / F А,0) (в РИВ) при разных начальных условиях, по ним можно прямо вычислить скорости реакции, пользуясь способами графического или численного дифференцирования, а при небольшом изменении параметров - отношением конечных разностей:
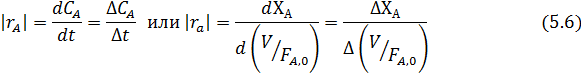
В результате получается ряд численных значений скорости, отнесенных к тем концентрациям или степеням конверсии, при которых они вычислялись. Дальнейший анализ этих данных для необратимых реакций с простыми кинетическими уравнениями типа 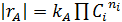 чаще всего осуществляется по логарифмическим формам уравнений, правая часть которых превращается при этом в линейный двучлен или многочлен (табл. 5.3).
чаще всего осуществляется по логарифмическим формам уравнений, правая часть которых превращается при этом в линейный двучлен или многочлен (табл. 5.3).
Таблица5.3. Уравнения дифференциальных способов обработки опытов для простых необратимых реакций
| №
| Дифференциальное уравнение
| Преобразованная формула уравнения для обработки опытов
|
|
| 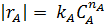
| 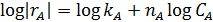
|
|
| 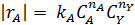
| 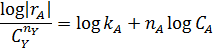
|
|
| 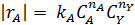
| 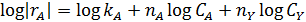
|
|
| 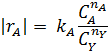
| 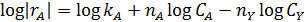
|
|
| 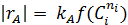
| 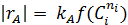
|
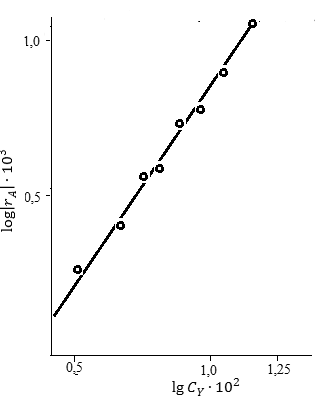
В первом случае ‒ при отсутствии вторых реагентов или при их избытке (уравнение 1), а также при известном или легко предсказуемом порядке по второму реагенту (уравнение 2), возможна линеаризация эксперимента на плоскости. Для этого откладывают по оси ординат левую часть логарифмических уравнений, а по оси абсцисс lgCA. Полученная прямая отсекает на оси ординат отрезок, равный lg k A, и имеет тангенс угла наклона n А.
При взаимодействии двух веществ можно воспользоваться уравнением 2, принимая разные значения nY и проверяя соответствие опыта прямой в тех же логарифмических координатах. Более общее решение состоит в преобразовании уравнения в линейный многочлен (уравнение 3 и 4), по которому опытные данные обрабатывают методом наименьших квадратов. Когда имеются определенные предположения о механизме и порядках реакции, для проверки их соответствия опыту откладывают на осях координат не логарифмы, а абсолютные значения | r А| и 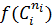 . В этом случае прямая проходит через начало координат и имеет тангенс угла наклона, равный k A (уравнение 5).
. В этом случае прямая проходит через начало координат и имеет тангенс угла наклона, равный k A (уравнение 5).
Иногда используют метод начальных скоростей, согласно которому скорость реакции измеряется при малых изменениях состава реагентов. Если начинать опыт, имея только СА и варьировать скорость реакции, в то время как концентрация этого реагента меняется лишь незначительно, то 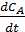 может быть заменено на
может быть заменено на 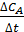 , причем концентрации продуктов реакции можно приравнять к нулю. Тогда кинетическое уравнение примет вид:
, причем концентрации продуктов реакции можно приравнять к нулю. Тогда кинетическое уравнение примет вид: 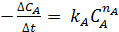
Серия опытов с меняющимися концентрациями реагирующих веществ, позволит найти k А и n А. Следовательно, сущность метода начальных скоростей заключается в том, чтобы проводить не один разовый, а целую серию определений начальной скорости при разных начальных условиях.
5.4.2. Исследование реакции в безградиентных условиях
В полном смысле слова безградиентным является лишь рассмотренный ранее РИС. Ввиду постоянства концентраций по всему объему безградиентных реакторов для них можно определять скорость, не прибегая к приближенной процедуре графического дифференцирования или отношения конечных разностей.
Для этого можно воспользоваться выведенным ранее уравнением (4.9) для РИС, из которого для реакций с постоянным объемом находим
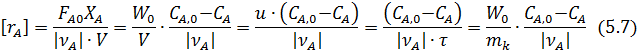
Само исследование состоит в проведении ряда опытов в изотермических условиях с варьированием приведенной объемной скоростью u, начальной концентрации и соотношения реагентов. В каждом опыте определяют выходные концентрации или степени конверсии и рассчитывают соответствующую им скорость реакции. Имея набор этих данных, обработку эксперимента проводят по тем же линейным логарифмическим формулам (табл. 5.3) графическим путем или методом наименьших квадратов.
Исследование в безградиентных реакторах более трудоемко, чем в периодических условиях. Здесь за один опыт получается, как и в аппаратах вытеснения, только одна экспериментальная точка. В то же время точность эксперимента и простота его обработки составляют большое преимущество метода, что и обусловило широкое распространение безградиентных реакторов в научном и технологическом исследовании.
Пример 3. Жидкофазная фотохимическая реакция

изучалась при постоянной интенсивности облучения и температуре в РИС. При этом были получены следующие результаты:
| СА,0
моль/л
| СY,0
моль/л
| СY (моль/л) при разной u, мин-1
|
| 0,2
| 0,1
| 0,05
| 0,025
|
|
| 0,1
| 0,072
| 0,061
| 0,048
| 0,032
|
| 2,5
| 0,2
| 0,133
| 0,109
| 0,082
| 0,054
|
Определить порядки, константу скорости, кинетическое уравнение и механизм реакции. Провести статистическую обработку опытов, если средняя квадратичная ошибка в концентрациях при четырех параллельных опытах составляла ±0,002 моль/л.
Решение
Вычисляем концентрацию реагента А по уравнению материального баланса 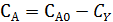 и скорости реакции
и скорости реакции 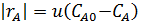 и записываем их вместе с соответствующими концентрациями реагентов:
и записываем их вместе с соответствующими концентрациями реагентов:
| u, мин-1
| 0,2
| 0,1
| 0,05
| 0,025
| 0,2
| 0,1
| 0,05
| 0,025
|
| СА,0, моль/л
| 4,972
| 4,961
| 4,948
| 4,932
| 2,433
| 2,409
| 2,382
| 2,354
|
| СY,0, моль/л
| 0,072
| 0,061
| 0,048
| 0,032
| 0,133
| 0,109
| 0,082
| 0,054
|
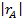 , моль/(л·мин) , моль/(л·мин)
| 0,0056
| 0,0039
| 0,0026
| 0,0017
| 0,0134
| 0,0091
| 0,0059
| 0,0036
|
 Ввиду большого избытка реагента А считаем, что его концентрация в каждой серии опытов постоянна. Это позволяет провести обработку опытов по уравнению:
Ввиду большого избытка реагента А считаем, что его концентрация в каждой серии опытов постоянна. Это позволяет провести обработку опытов по уравнению:
Откладываем на графике значения lg | r A| против lgCА (рис. 5.4).
| Рис. 5.4. Линеаризация опытов при исследовании на безградиентной установке
|
Оказывается, что все экспериментальные точки удовлетворительно укладываются на одну прямую даже при разных начальных концентрациях тетрахлорэтилена, что дает
n A = 0. Тангенс угла наклона прямой равен
n Y = 1,42. Округляя эту величину до 1,5, получаем такое кинетическое уравнение:
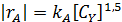
Ему соответствует механизм реакции с квадратичным обрывом цепи на хлоралкильных радикалах:




В стационарных условиях 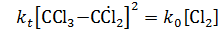 и скороть реакции равна:
и скороть реакции равна:
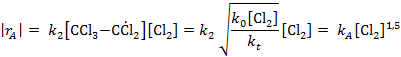
Статистическую обработку опытов проводим по уравнению у = bх.
Принимаем у = rA, b = kA, х = СY 1,5 , получаем kA = 0,268 л-0,5 ·моль -0,5·мин-1
и кинетическое уравнение записывается так:
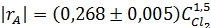
Вопросы для самопроверки
1. Расскажите о проведении кинетических исследований в ИПР.
2. Расскажите о методике расчета константы скорости простой реакции по экспериментальным данным, полученным в ИПР.
3. Расскажите о методике расчета константы скорости простой реакции по экспериментальным данным, полученным в РИВ.
4. Расскажите об исследовании реакций в безградиентных условиях.
5. В каких случаях используются дифференциальные методы для исследования кинетики химических реакций?
6. Обоснуйте принцип интегрального исследования кинетики химических реакций.
Контрольные задачи
Приведены в Сборнике задач по курсу «Теория химико-технологических процессов органического синтеза» - Инженерные расчеты в химической технологии (работа 4).





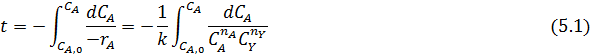

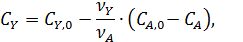
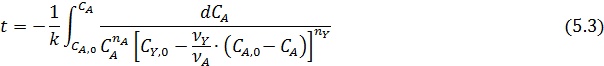
 Рис. 5.1. Кинетические кривые простой реакции в периодических условиях
Рис. 5.1. Кинетические кривые простой реакции в периодических условиях
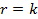
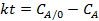
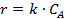
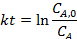
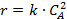
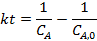
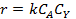
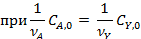
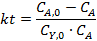
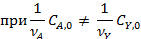
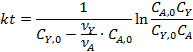
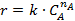
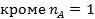
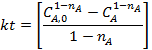

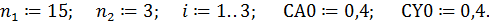
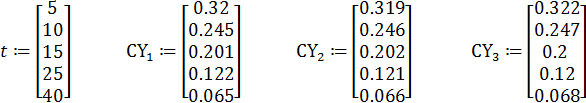
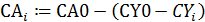
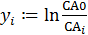


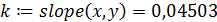
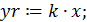
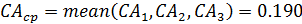
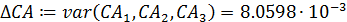
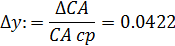
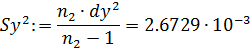
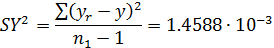
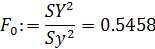
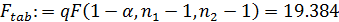
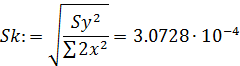
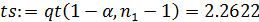
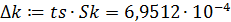
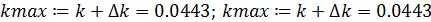
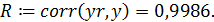

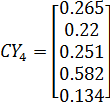
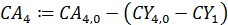
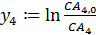
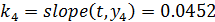
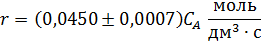
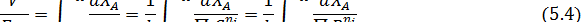
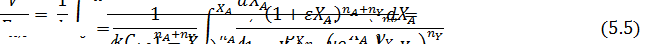
 , в том же уравнении CA,0 заменяется на PA,0 что, естественно, ведет к изменению величины и размерности константы скорости.
, в том же уравнении CA,0 заменяется на PA,0 что, естественно, ведет к изменению величины и размерности константы скорости.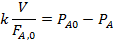
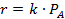
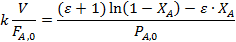
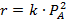
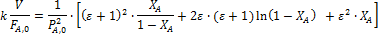
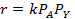
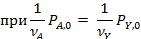
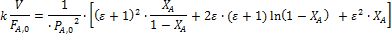

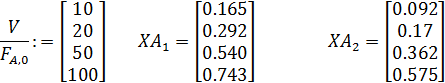
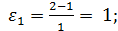
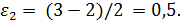
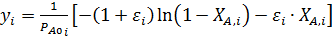
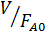 . Соответствие их прямой линии свидетельствует о вероятной адекватности уравнения эксперименту (рис. 5.3).
. Соответствие их прямой линии свидетельствует о вероятной адекватности уравнения эксперименту (рис. 5.3).

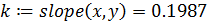
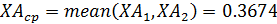
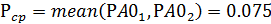
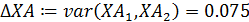
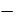 среднее значение коэффициента изменения объема
среднее значение коэффициента изменения объема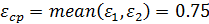
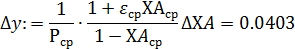
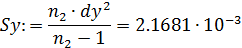
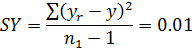
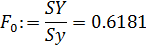
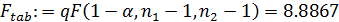
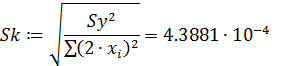
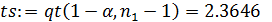
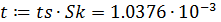
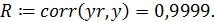
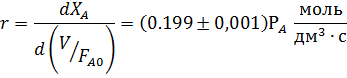
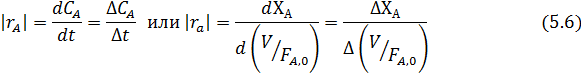
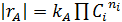 чаще всего осуществляется по логарифмическим формам уравнений, правая часть которых превращается при этом в линейный двучлен или многочлен (табл. 5.3).
чаще всего осуществляется по логарифмическим формам уравнений, правая часть которых превращается при этом в линейный двучлен или многочлен (табл. 5.3).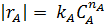
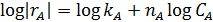
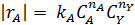
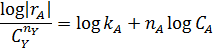
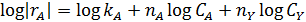
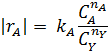
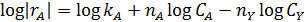
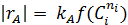
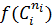 . В этом случае прямая проходит через начало координат и имеет тангенс угла наклона, равный k A (уравнение 5).
. В этом случае прямая проходит через начало координат и имеет тангенс угла наклона, равный k A (уравнение 5).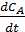 может быть заменено на
может быть заменено на 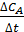 , причем концентрации продуктов реакции можно приравнять к нулю. Тогда кинетическое уравнение примет вид:
, причем концентрации продуктов реакции можно приравнять к нулю. Тогда кинетическое уравнение примет вид: 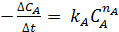
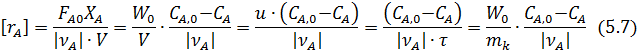

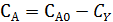 и скорости реакции
и скорости реакции 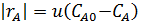 и записываем их вместе с соответствующими концентрациями реагентов:
и записываем их вместе с соответствующими концентрациями реагентов: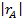 , моль/(л·мин)
, моль/(л·мин)
 Ввиду большого избытка реагента А считаем, что его концентрация в каждой серии опытов постоянна. Это позволяет провести обработку опытов по уравнению:
Ввиду большого избытка реагента А считаем, что его концентрация в каждой серии опытов постоянна. Это позволяет провести обработку опытов по уравнению: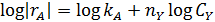
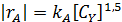




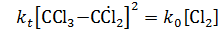 и скороть реакции равна:
и скороть реакции равна: