Растворенный в коррозионной среде кислород является основным окислителем во всех наиболее распространенных на практике видах коррозии (атмосферной, подводной, грунтовой). Именно с коррозией с кислородной деполяризацией в практике приходится сталкиваться наиболее часто.
Катодный процесс при коррозии с кислородной деполяризацией описывается следующими реакциями:
O2 + 4Н+ + 4е → 2H2O кислая среда,
О2 + 2H2O + 4е → 40Н– нейтральная и щелочная среда.
Равновесный потенциал этих реакций описывается уравнением
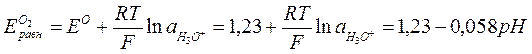 . (4.11)
. (4.11)
Таким образом, равновесный потенциал кислородного электрода всегда на 1,23 В больше равновесного потенциала водородного электрода. В связи с этим термодинамическое условие коррозии с кислородной деполяризацией
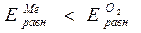
выполняется для всех металлов, за исключением золота.
Реакция восстановления кислорода включает в себя следующие стадии:
- растворение кислорода в коррозионной среде;
- диффузия растворенного кислорода к поверхности корродирующего металла;
- разряд;
- отвод образовавшихся продуктов.
Так как растворимость кислорода в электролитах невелика, то очень часто скорость коррозии определяется диффузией кислорода к корродирующему металлу. Стадия разряда также может быть замедлена, но только в достаточно редких случаях: при интенсивно перемешиваемых коррозионных средах или в тонких пленках электролита. Отвод продуктов не может быть замедленным, так как ионы ОН– обладают аномальной подвижностью.
При замедленности стадии диффузии скорость ее, а следовательно, и скорость коррозионного процесса определяются, исходя из закона Фика:
 , (4.12)
, (4.12)
где СО – концентрация кислорода в коррозионной среде;
СS – концентрация кислорода на поверхности корродирующего металла;
D – коэффициент диффузии кислорода;
d – толщина диффузионного слоя.
При СS = 0 наблюдается максимальный коррозионный ток, определяемый предельным током диффузии кислорода:
iкор mаx =  . (4.13)
. (4.13)
Толщина диффузионного слоя определяется уравнением
δ=311/2 D1/3 v–1/2 υ1/6, (4.14)
где υ – вязкость коррозионной среды,
v – скорость перемешивания коррозионной среды.
Таким образом, скорость коррозии с кислородной деполяризацией зависит прежде всего от концентрации растворенного кислорода в коррозионной среде, которая, в свою очередь, определяется давлением, температурой и концентрацией ионов в коррозионной среде. Кроме того, скорость коррозии существенно зависит от интенсивности движения коррозионной среды.
Коррозионная диаграмма, описывающая коррозию при замедленной стадии растворенного кислорода, представлена на рис.4.2.

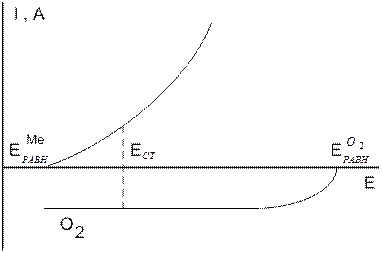
Рис.4.2. Коррозионная диаграмма, описывающая коррозию с кислородной деполяризацией при замедленной диффузии растворенного кислорода
При коррозии в реальных условиях диффузия кислорода к отдельным участкам поверхности корродирующего металла может быть неодинаковой (неравномерная аэрация). В связи с этим коррозия с кислородной деполяризацией часто происходит локально, возникают так называемые аэрационные пары, при работе которых металл разрушается в местах, где диффузия затруднена, а катодный процесс коррозии осуществляется на участках с хорошей аэрацией.
Работой аэрационной пары объясняется, например, щелевая коррозия (рис. 4.3) и неравномерная коррозия подземных трубопроводов на различных участках.
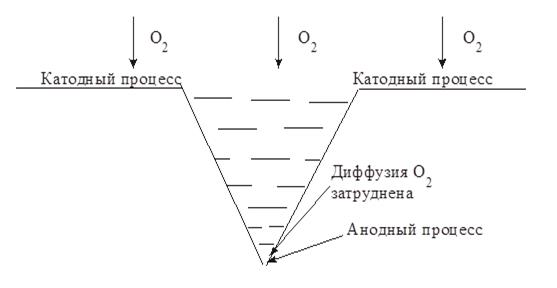
Рис. 4.3. Возникновение аэрационной пары при наличии щелей и
трещин в корродирующем металле
Диффузия кислорода к острию щели затруднена, т.к. путь движения молекул кислорода к острию трещины длиннее, чем к ее основанию. Поэтому на ее вершине локализуется анодный процесс, катодный процесс коррозии будет протекать на поверхности металла вблизи трещины и на стенках трещины. Таким образом, при наличии щели коррозионное поражение интенсивно распространяется вглубь металла (щелевая коррозия).
Ход выполнения работы
В реальных условиях, если возможна коррозия с водородной деполяризацией, то ей обязательно сопутствует в той или иной мере и коррозия с кислородной деполяризацией. В настоящей лабораторной работе коррозию с водородной и кислородной изучают, используя одновременно весовой и объемный методы исследования коррозии.
Весовой метод позволяет рассчитать по разнице между массой металла до коррозии и после нее массовый показатель коррозии под воздействием обоих окислителей (ионов водорода и растворенного кислорода):
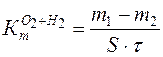 (г/см2∙час), (4.15)
(г/см2∙час), (4.15)
где m1 – масса металла до коррозии, г;
m2 – масса металла после коррозии, г (определяется после удаления продуктов коррозии);
S – площадь поверхности корродирующего металла, см2;
τ – время коррозии, ч.

Рис. 4.4. Установка для определения скорости коррозии с водородной
деполяризацией объемным методом (водородный коррозиметр)
1-измерительная бюретка; 2-сосуд с коррозионной средой;
3- исследуемый металл; 4- резиновая подставка; 5- кран
Объемный метод исследования коррозии с помощью водородного кор–розиметра (рис. 4.4) позволяет определить количество выделившегося водорода, а следовательно, и количество металла, прокорродировавшего за счет коррозии с водородной деполяризацией, и массовый показатель коррозии 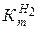 .
.
Определение 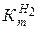 осуществляется в следующей последовательности:
осуществляется в следующей последовательности:
– фиксируется количество водорода  , выделившееся за определенное время τ при коррозии металла с площадью поверхности S;
, выделившееся за определенное время τ при коррозии металла с площадью поверхности S;
– объем выделившегося водорода  приводится к нормальным условиям:
приводится к нормальным условиям:
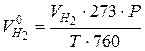 (см3), (4.16)
(см3), (4.16)
где  – измеренный объем водорода, см3;
– измеренный объем водорода, см3;
Р – давление, мм (определяется по барометру);
Т – температура опыта в градусах Кельвина.
Исходя из условия стационарности коррозии, количество металла, прокорродировавшего по коррозии с водородной деполяризацией, пропорционально количеству выделившегося водорода и может быть определено по формуле
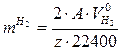 (г), (4.17)
(г), (4.17)
где А – атомный вес металла;
z – заряд металла;
22400 мл – объем занимаемый 1 г/моль H2 при нормальных условиях.
Далее рассчитывается массовый показатель коррозии под действием ионов водорода:
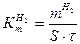 . (4.18)
. (4.18)
При известных 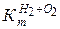 и
и 
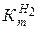 можно определить массовый показатель
можно определить массовый показатель
коррозии с кислородной деполяризацией и долю коррозии (С) с водородной и кислородной деполяризацией:
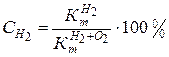 ,
, 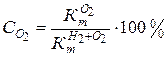 (4.19)
(4.19)
Лабораторная работа проводится в следующей последовательности.
1. Подготовить образцы к работе: измерить поверхность, зачистить, протереть спиртом, высушить, взвесить.
2. Подготовить установку к измерениям (рис. 4.4), для чего в сосуд 2 залить коррозионную среду, с помощью груши заполнить ею бюретку 1, закрыть кран 5.
3. Вставить образец в резиновую пробку.
4. С помощью щипцов подвести резиновую пробку с образцом металла под бюретку, зафиксировать время и начать измерение объема выделившегося водорода.
5. По окончании опыта достать образец, промыть его, описать внешний вид, наличие продуктов коррозии.
6. Снять продукты коррозии ластиком, если они есть, промыть образец, протереть спиртом, высушить, взвесить.
7. Экспериментальные данные записать в табл. 4.1.
Таблица 4.1
Таблица экспериментальных данных
| Материал обр-ца
| Коррозионная среда
| Масса образцов, г
|
∆ m, г
| Объем выделившегося Н2, мл
|
| до опыта
| после опыта
| 10 мин
| 20 мин
| 30 мин
| 40 мин.
| 50 мин
| 1 час
|
| | | | | | | | | | | |
8. Провести необходимые расчеты по определению показателей коррозии 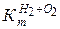 ,
, 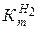 ,
, 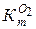 и доли коррозии с кислородной и водородной деполяризациями.
и доли коррозии с кислородной и водородной деполяризациями.
9. Рассчитать глубинный показатель общей коррозии (П мм/год):
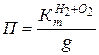 , где g – плотность металла.
, где g – плотность металла.
10. По величине глубинного показателя с помощью шкалы коррозионной стойкости (см. табл.1 приложения) определить группу и балл стойкости исследуемого металла.
11. Построить полученные зависимости V  = f(t) и по их виду сделать выводы об изменении скорости коррозии с водородной деполяризацией во времени.
= f(t) и по их виду сделать выводы об изменении скорости коррозии с водородной деполяризацией во времени.





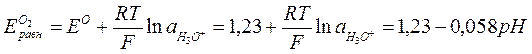 . (4.11)
. (4.11)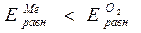
 , (4.12)
, (4.12) . (4.13)
. (4.13)


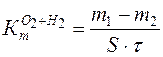 (г/см2∙час), (4.15)
(г/см2∙час), (4.15)
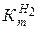 .
. , выделившееся за определенное время τ при коррозии металла с площадью поверхности S;
, выделившееся за определенное время τ при коррозии металла с площадью поверхности S;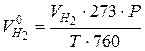 (см3), (4.16)
(см3), (4.16)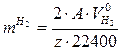 (г), (4.17)
(г), (4.17)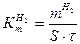 . (4.18)
. (4.18)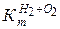 и
и 
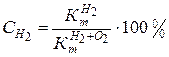 ,
, 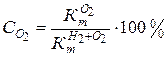 (4.19)
(4.19)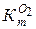 и доли коррозии с кислородной и водородной деполяризациями.
и доли коррозии с кислородной и водородной деполяризациями.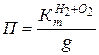 , где g – плотность металла.
, где g – плотность металла. = f(t) и по их виду сделать выводы об изменении скорости коррозии с водородной деполяризацией во времени.
= f(t) и по их виду сделать выводы об изменении скорости коррозии с водородной деполяризацией во времени.


