

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...
Топ:
Теоретическая значимость работы: Описание теоретической значимости (ценности) результатов исследования должно присутствовать во введении...
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного хозяйства...
Эволюция кровеносной системы позвоночных животных: Биологическая эволюция – необратимый процесс исторического развития живой природы...
Интересное:
Мероприятия для защиты от морозного пучения грунтов: Инженерная защита от морозного (криогенного) пучения грунтов необходима для легких малоэтажных зданий и других сооружений...
Искусственное повышение поверхности территории: Варианты искусственного повышения поверхности территории необходимо выбирать на основе анализа следующих характеристик защищаемой территории...
Национальное богатство страны и его составляющие: для оценки элементов национального богатства используются...
Дисциплины:
|
из
5.00
|
Заказать работу |
Содержание книги
Поиск на нашем сайте
|
|
|
|
При коррозии с водородной деполяризацией катодная реакция коррозионного процесса описывается следующими реакциями:
Н3О+ + е → Надс + Н2О →½ Н2 + Н2О кислая среда;
H2O + е → Надс + 20Н– → ½ Н2 + 2 ОН– нейтральная и щелочная среда.
Для того чтобы коррозия с водородной деполяризацией была возможна, необходимо, чтобы было выполнено термодинамическое условие электрохимической коррозии:
 . (4.1)
. (4.1)
Равновесный потенциал металла (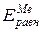 ) можно определить по уравнению
) можно определить по уравнению
Е  , (4.2)
, (4.2)
где Е 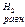 – стандартный потенциал водородного электрода;
– стандартный потенциал водородного электрода;
а  – активность водородных ионов;
– активность водородных ионов;
Р 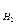 – парциальное давление водорода в коррозионной среде.
– парциальное давление водорода в коррозионной среде.
При Р  = 1, учитывая, что
= 1, учитывая, что 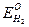 = 0, уравнение значительно упрощается:
= 0, уравнение значительно упрощается:
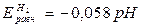 (4.3)
(4.3)
Соотношение (4.1) выполняется для отрицательных металлов, включая железо, в электролитах с любым рН. Для более положительных в сравнении с железом металлов, стоящих в ряду активности левее водорода, оно выполняется только в кислых средах. Металлы, стоящие в ряду активности правее водорода, ни в каких средах не корродируют по коррозии с водородной деполяризацией. Для производственной практики это коррозия металлов в кислых грунтах, кислых сточных водах, коррозия оборудования на производствах, связанных с применением кислот (травильные участки заводов ОЦМ, гальванические цеха) и т.д.
Как уже отмечалось выше, при электрохимической коррозии на поверхности металла протекает две сопряженные реакции: анодный процесс ионизации металла и катодный процесс восстановления окислителя (ей). В целом скорость коррозии будет зависеть от скорости каждой из этих реакций. Однако, если коррозия идет с образованием растворимых соединений металла, то анодная реакция в этом случае часто протекает быстро с малой поляризацией и скорость коррозии определяется, в основном, замедленностью катодной реакции. Рассмотрим, от каких факторов в этом случае будет зависеть скорость коррозии.
|
|
Катодный процесс коррозии с водородной деполяризацией состоит из следующих стадий:
1. Диффузия гидратированных ионов водорода или молекул воды к поверхности корродирующего металла.
2. Разряд водородных ионов или молекул воды:
Н3О++е →Надс+Н2О
Н2О+е → Надс+ОН–
3. Растворение и диффузия части атомов водорода в металле.
4. Молизация водородных атомов путем рекомбинации:
Надс + Надс→ Н2
или электрохимической десорбции:
Надс + Н3О++е→ Н2+ Н2О
Надс+ Н2О+е → Н2+ ОН–
5. Диффузия и перенос конвекцией водорода от катодных участков вглубь, а затем его диффузия в воздух.
6. Образование и отрыв пузырьков от поверхности металла:
Н2+ Н2+ Н2+ → nН2
Первая стадия – диффузия деполяризатора к поверхности металла при выделении водорода является быстрой в связи с большой подвижностью водородных ионов и высокой концентрацией молекул воды в двойном электрическом слое. В реальных условиях коррозии наиболее часто замедленными стадиями являются: разряд, электрохимическая десорбция и отвод пузырьков в газовую фазу. Возможность замедленной стадии рекомбинации при рассмотрении коррозионных процессов можно не учитывать, так как рекомбинационная теория водородного перенапряжения справедлива, в основном, для благородных металлов (Pt,Pd,Ro), термодинамически не способных к коррозии с водородной деполяризацией. В величину перенапряжения всегда вносит свой вклад стадия 5.
Кинетические зависимости при замедленности стадий разряда и электрохимической десорбции сходны между собой. Рассмотрим влияние различных факторов на коррозию в случае замедленной стадии разряда.
|
|
|

Археология об основании Рима: Новые раскопки проясняют и такой острый дискуссионный вопрос, как дата самого возникновения Рима...

Адаптации растений и животных к жизни в горах: Большое значение для жизни организмов в горах имеют степень расчленения, крутизна и экспозиционные различия склонов...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!