В.А. ЛИХАЧЕВ
КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ
Учебно-методическое пособие
Киров
УДК 658.52 (07)
К897
Допущено к изданию методическим советом института химии и экологии ФГБОУ ВО ВятГУ в качестве учебно-методического пособия для студентов, обучающихся по направлению 18.03.01 «Химическая технология» уровня подготовки – бакалавриат всех форм обучения
Рецензент:
заведующая кафедрой неорганической
и физической химии ВятГУ, доцент Ю.Н.Ушакова
Лихачев, В.А.
К 897 Коррозия и защита металлов: учебно-методическое пособие / В.А. Лихачев. – Киров: ФГБОУ ВО ВятГУ, 2017. – 99с.
УДК 658.52 (07)
Учебно-методическое пособие предназначено для студентов, обучающихся по направлению 18.03.01 «Химическая технология», уровня подготовки – бакалавриат всех форм обучения. Пособие оказывает студентам помощь в прохождении лабораторного практикума.
Тех. редактор А.В. Куликова
© ФГБОУ ВО ВятГУ, 2017
СОДЕРЖАНИЕ
Химическая коррозия металлов 3
Электрохимическая коррозия металлов и анализ коррозионной ситуации 11
Коррозия металлов в контакте 26
Коррозия с водородной и кислородной деполяризациями 36
Анодные процессы при коррозии, пассивность металлов 50
Ингибиторы коррозии 61
Электрохимическая защита металлов от коррозии 73
Финишная контрольная работа 85
Контрольное задание по курсу «Основы коррозии и защиты металлов» 87
Перечень вопросов к экзамену по курсу 96
Список литературы 98
.Приложение 97
Десятибалльная шкала коррозионной стойкости металлов
Стандартные потенциалы некоторых реакций
ХИМИЧЕСКАЯ КОРРОЗИЯ МЕТАЛЛОВ
(Лабораторная работа 1)
Цель работы: ознакомиться с химической коррозией металлов и с влиянием различных факторов на ее скорость.
Теоретические предпосылки
Химической коррозией называется процесс самопроизвольного разрушения металлов под действием сухих газов и не электролитов, при котором окисление металла и восстановление окислителя протекают в виде одной химической реакции. Наиболее распространенным случаем химической коррозии является газовая коррозия под действием воздуха, при которой основным окислителем является кислород. В качестве дополнительных окислителей в воздухе могут присутствовать сероводород, диоксид серы и др.
Согласно термодинамическим оценкам все металлы, за исключением золота, должны корродировать под действием кислорода воздуха, при этом на поверхности металла протекает гетерогенная химическая реакция. Для двух валентного металла она запишется следующим образом:
2Ме + 02 — 2МеО.
В результате такой реакции на металле появляются продукты коррозии в виде пленки оксидов (другие окислители приводят к образованию солевых пленок). Скорость коррозии и, следовательно, опасность ее для практики, зависит от свойств получающихся продуктов коррозии. В свою очередь, свойства образующихся при коррозии оксидов и солевых пленок определяются тремя основными факторами: природой корродирующего металла, температурой коррозии, составом коррозионной среды.
Природа металла прежде всего определяет, какая пленка продуктов коррозии получается: сплошная или не сплошная. Сплошная пленка образуется, если выполняется так называемое условие сплошности:
1 < Vок/VМе < 2,5 ÷ 3,5,
где vок – объем продуктов коррозии,
VМе– объем корродирующего металла.
При невыполнении условия сплошности, например,Vок/VМе < 1, образующаяся пленка не может защитить металл и не оказывает тормозящего влияния на скорость коррозии. Подобная ситуация характерна при коррозии щелочных и щелочноземельных металлов (К, Na, Ca), в связи с чем они не могут храниться на воздухе при любых температурах. Сплошная защитная пленка не может получиться и в том случае, если Vок/VМе >2,5÷3,5. В этом случае в пленке возникают высокие внутренние напряжения, она постоянно разрушается и отслаивается от поверхности корродирующего металла. Это характерно, например, для коррозии вольфрама при температурах выше 600°С.
В случае образования не сплошной пленки толщина ее (h) пропорциональна времени коррозии (t) h = kt. В этом случае говорят, что коррозия протекает по линейному закону (рис. 1.1).
Рис. 1.1. Линейный закон роста оксидной пленки
Рис. 1.2. Изменение скорости коррозии во времени при линейном законе роста оксидной пленки
Скорость коррозии, которую можно выразить отношением Vкор = dh/dt, при этом будет постоянна во времени (рис.1.2).
Для большинства конструкционных металлов условие сплошности (1 < Vок/VМе < 2,5÷3,5) выполняется, пленка продуктов коррозии получается сплошной, а скорость коррозии уменьшается во времени. Степень торможения коррозионного процесса зависит от упорядоченности образующейся пленки, при этом в зависимости от температуры, состава газовой среды и природы металла могут наблюдаться следующие законы роста оксидной пленки: логарифмический, степенной, параболический, паралинейный. На рис. 1.3 приведены графические и математические выражения этих законов.

Рис. 1.3. Изменение толщины оксидной пленки во времени при различных
законах роста оксидной пленки
На основании графиков рис.1.3 на рис. 1.4 построены зависимости скорости коррозии от времени при различных законах роста оксидной пленки.

Рис. 1.4. Изменение скорости коррозии во времени при различных законах роста оксидной пленки
Как видно из рис.1.4, для практики наиболее благоприятен логарифмический закон роста оксидной пленки, так как скорость коррозии в этом случае резко снижается со временем, и уже через небольшое время металл практически перестает корродировать. Для многих металлов, в частности для железа, логарифмический закон роста оксидной пленки наблюдается при невысоких температурах (до 300°С), поэтому химическая коррозия в таких условиях не опасна, а металлы не требуют специальной защиты. При повышении температуры происходит переход к степенному, параболическому и далее к паралинейному закону, в связи с чем опасность химической коррозии с ростом температуры резко возрастает.
Температура, при которой наблюдается переход к параболическому закону, и на поверхности металла начинает образовываться неупорядоченная толстая пленка продуктов коррозии (окалина), называется температурой окалинообразования. Температура окалинообразования является характеристикой жаростойкости металла, выше температуры окалинообразования металл требует защиты (например, температура окалинообразования для железа и его сплавов равна 300 оС, для хрома более 1300 оС).
Газовая химическая коррозия металлов наблюдается при обработке и эксплуатации горячего металла, например, в процессах термической обработки, при литье, в процессах горячего деформирования, при эксплуатации печного оборудования и т.д.
Химическая коррозия в не электролитах протекает в нефти и продуктах ее перегонки.
L.2. Ход выполнения работы
В данной лабораторной работе изучение газовой коррозии производится при высокой температуре в муфельной печи, температура в которой контролируется с помощью хромель–алюмелевой термопары, соединенной с цифровым вольтметром. В ходе экспериментов изучается влияние на газовую коррозию температуры, продолжительности коррозии и природы металла в зависимости от конкретного задания.
В качестве задания к лабораторной работе преподавателем может быть предложен один из следующих вариантов исследований:
а) при постоянной температуре и продолжительности опыта изучить влияние природы металла на скорость газовой коррозии;
б) исследовать влияние температуры окружающей среды на скорость коррозии конкретного металла;
в) исследовать скорость газовой коррозии во времени.
Исследования проводятся в следующей последовательности:
- Включить печь и нагреть ее до необходимой температуры.
- Подготовить образцы к испытаниям:
- Определить площадь исследуемых образцов.
- Удалить с их поверхности продукты коррозии зачисткой наждачной бумагой.
- Промыть образцы водой, обезжирить этиловым спиртом, высушить, промаркировать.
- Взвесить образцы исследуемых металлов на аналитических весах.
- Загрузить образцы в печь. Зафиксировать время. При загрузке в печь располагать образцы в тиглях так, чтобы они не экранировали друг друга.
- По окончании процесса коррозии достать образцы из печи, охладить и описать их внешний вид.
- Взвесить образцы с продуктами коррозии. (Взвешивание производится, если продукты коррозии получаются достаточно плотными и не осыпаются.)
- Удалить продукты коррозии в соответствующих растворах или ластиком.
- После удаления продуктов коррозии образцы тщательно промыть, протереть этиловым спиртом, высушить.
- Взвесить образцы без продуктов коррозии.
- Экспериментальные данные записать в табл. 1.1.
Таблица 1.1
Экспериментальные данные по газовой коррозии
| N п/п
| Изменяющийся фактор
| Площадь образца,
S, см2
| Масса образца до коррозии,
m1,г
| Масса образца после коррозии, m2, г
| Внешний вид образца после коррозии
| Кол–во
прокорродировавшего металла,
m,г
| Показатели коррозии
|
| с продуктами
| без продуктов.
| Кm,
г/см2ч
| П,
мм/год
|
| | | | | | | | | | |
1.3. Обработка экспериментальных данных
1. По количеству прокорродировавшего металла определить массовый показатель коррозии Кm = m/St г/см2 ·ч, где, t - время коррозии в часах.
2. Исходя из средней величины Km, полученной при обработке параллельных опытов, определить глубинный показатель коррозии (П) в см/час, П=Кm/g, где, g – плотность металла, г/см3. Плотность металла берется из справочника. Плотность сплава определяется по правилу аддитивности.
3. Выразить глубинный показатель в мм/год и по его величине в соответствии с таблицей коррозионной стойкости металлов (см. приложение) определить жаростойкость металла в исследуемых условиях.
4. Построить график зависимости "скорость коррозии – изменяющийся фактор", пояснить его ход и соответствие с теорией.
5. Дополнительно по заданию преподавателя, сравнивая массу образцов с продуктами коррозии и без них, определить возможные продукты коррозии и написать уравнение коррозионного процесса.
6. Сделать выводы.
Теоретические предпосылки
Процесс электрохимической коррозии наблюдается всегда, когда на поверхности металла появляется электролит. В промышленной практике электрохимическая коррозия – это коррозия металлических конструкций в условиях атмосферной, подводной и грунтовой коррозии, это коррозия металлов в различных технологических средах, коррозия транспорта и т.д. При электрохимической коррозии на поверхности металла одновременно протекают две электрохимические реакции: реакция ионизации металла (анодная реакция коррозионного процесса), реакция восстановления какого–либо окислителя(лей), присутствующего(щих) в коррозионной среде (катодная реакция коррозионного процесса).
Корродирующий в электролите металл за счет одновременного протекания на нем двух электрохимических реакций, связанных с переносом электронов, приобретает потенциал, который называют потенциалом коррозии Екор. Этот потенциал легко измерить с помощью вольтметра, если имеется электрод сравнения с известным потенциалом (например, хлорсеребряный электрод сравнения с потенциалом + 0,201 В).
Катодная реакция коррозионного процесса заключается в восстановлении окислителя, каковым в промышленной практике обычно является растворенный в коррозионной среде кислород:
O2 + 4Н+ + 4е → 2H2O или 02 + 2H2O + 4е →40Н–
(кислая среда) (нейтральная или щелочная среда)
Вторым по распространенности окислителем являются ионы водорода (Н+), в некоторых случаях в коррозионной среде могут присутствовать и другие окислители (например, SO2, H2S и т.д.).
Если в качестве одного из окислителей выступают ионы Н+, что обычно характерно для кислых сред, тогда коррозия металла сопровождается выделением водорода. В этом случае катодная реакции коррозионного процесса запишется: 2Н+ + 2е → H2 или 2H2O + 2е → Н2 + 20Н–
(кислая среда) (нейтральная или щелочная среда)
Анодная реакция коррозионного процесса может протекать разными путями, что приводит к появлению на поверхности металла или в коррозионной среде разнообразных продуктов коррозии, ими могут быть оксиды, гидроксиды, комплексные соединения, растворимые в коррозионной среде соли, труднорастворимые соли.
 гидратированные катионы [Ме(Н2О)]ne+
гидратированные катионы [Ме(Н2О)]ne+
 комплексные соединения [Ме(Кn)]m+, [Ме(Кn)]m–
комплексные соединения [Ме(Кn)]m+, [Ме(Кn)]m–


 Ме – ne оксиды и гидроксиды МеО, Ме(ОН)2
Ме – ne оксиды и гидроксиды МеО, Ме(ОН)2
сложные анионы металла МеО–2, МеО22– труднорастворимые соли МеА
Вид образующихся продуктов оказывает решающее влияние на скорость и, следовательно, на опасность коррозии.
Наиболее опасен для практики случай, когда в результате анодной реакции коррозионного процесса получаются растворимые продукты коррозии (гидратированные катионы, сложные анионы металла, комплексные соединения). Такие продукты не оказывают тормозящего влияния на скорость коррозии, и, следовательно, она постоянно идет с высокой скоростью.
Если в результате анодной реакции коррозионного процесса получаются нерастворимые продукты коррозии (оксиды, гидроксиды, труднорастворимые соли), то такие продукты обычно снижают скорость коррозии во времени, и тем в большей степени, чем выше степень упорядоченности (плотности) получаемых продуктов коррозии. В том случае, когда нерастворимые продукты коррозии получаются с очень высокой степенью упорядоченности, коррозия резко тормозится во времени, продукты коррозии защищают металл, и он становится пассивным (явление пассивности).
Таким образом, чтобы проанализировать коррозионную ситуацию и оценить опасность коррозии, необходимо выяснить:
- какие катодные реакции идут на поверхности металла при коррозии, т.е. какие окислители ее вызывают;
- по какому пути идет анодная реакция коррозионного процесса, т.е. какие продукты коррозии получаются: растворимые, нерастворимые, упорядоченные, неупорядоченные.
Чтобы ответить на поставленные вопросы, необходимо знать состав коррозионной среды, ее рН и измерить значение стационарного потенциала коррозии (Екор).
Исходя из состава коррозионной среды, прежде всего определяется, какие окислители в ней присутствуют. Обычно их минимум два: ионы водорода (Н+) и растворенный в коррозионной среде кислород (O2). Иногда в коррозионной среде могут быть и дополнительные окислители (Fе3+, N0з–, S2– и т.д.). Чтобы узнать, какие из этих окислителей участвуют в процессе коррозии, необходимо сравнить стационарный потенциал коррозии (Екор) с равновесными потенциалами этих окислителей (Eoxpaвн). Если выполняется соотношение 
 ,
,
то данный окислитель участвует в процессе коррозии.
Это соотношение проверяется для всех окислителей, которые присутствуют в данной коррозионной среде, причем значения Еохравн берутся из справочной литературы или рассчитываются, например:
 рН (2.1)
рН (2.1)
В дальнейшем, также с учетом состава коррозионной среды, ее рН и величины стационарного потенциала коррозии (Екор), определяется возможный путь анодной реакции коррозионного процесса и, следовательно, получающиеся продукты коррозии. Если в коррозионной среде присутствует комплексообразователь, способный образовывать с корродирующим металлом растворимые комплексы, то продуктами коррозии будут именно эти комплексы и опасность коррозии резко возрастает.
В том случае, когда в коррозионной среде имеются анионы, способные образовывать с корродирующим металлом труднорастворимые соли, эти соли в той или иной мере обязательно будут оказывать тормозящее влияние на коррозию и опасность ее уменьшается, а в некоторых случаях коррозия практически прекращается (явление солевой пассивации). Если в коррозионной среде отсутствуют комплексообразователи и анионы, способные давать труднорастворимые соли, то дальнейшие предположения о характере образующихся продуктов делают с помощью диаграмм Пурбе при известных значениях рН коррозионной среды и стационарного потенциала коррозии. Диаграммы Пурбе дают представление о наиболее термодинамически устойчивых соединениях металла в зависимости от его потенциала и рН коррозионной среды. Пример такой диаграммы для алюминия приведен на рис. 2.1.

Рис.2.1. Диаграмма Пурбе для системы алюминий – Н2О
Согласно диаграмме, алюминий в средах, близких к нейтральным (рН 3–10), корродирует с образованием упорядоченного нерастворимого оксида алюминия A12О3, который хорошо защищает металл от дальнейшей коррозии, поэтому в этих средах алюминий устойчив. В кислых (рН<3) и щелочных (рН>10) средах получаются растворимые продукты коррозии А13+ и AlО2–, они не могут оказывать тормозящего влияния на коррозию, и в этих средах алюминий не устойчив (алюминий относится к классическим амфотерным металлам). Применять алюминий и его сплавы в кислых и щелочных средах без специальных мероприятий по защите нельзя.
Для примера проанализируем также коррозию железа в растворах Na2S04 с рН 2, рН 7, рН 12, если известно, что потенциалы коррозии железа (Екор) в этих средах соответственно равны: –0,35, –0,40 и –0,46 В (н.в.э.).
Прежде всего рассмотрим, какие окислители могут быть в этих растворах. Так как речь идет о водных растворах Na2S04, то ясно, что в них есть ионы водорода Н+ и растворенный кислород О2 (ионы Na+, S042– окислителями не являются).
Равновесные потенциалы этих двух окислителей для растворов с различным рН могут быть рассчитаны по уравнениям (2.1) и соответственно равны:
при  ;
;
при  ;
;
при  .
.
Если проверить, когда выполняется соотношение Екор < Еохравн , то можно сделать вывод, что при рН=2 коррозия протекает под действием обоих окислителей, а при рН=7, и рН=12 в коррозионном процессе участвует только один окислитель растворенный в коррозионной среде O2.

Рис. 2.2. Диаграмма Пурбе для системы железо - Н2О
Далее проанализируем, по какому пути пойдет анодная реакция коррозионного процесса. В рассматриваемых растворах нет комплексообразователей и анионов, способных образовывать с железом труднорастворимые соли, поэтому можно сразу обратиться к диаграмме Пурбе для железа (рис. 2.2).
Как видно из диаграммы, в растворах Na2S04 железо в зависимости от рН корродирует с образованием:
 Fe2+, Fe3+ гидратированные катионы
Fe2+, Fe3+ гидратированные катионы

 Fe – 2e Fe(OH)2, Fe(OH)3 гидроксиды
Fe – 2e Fe(OH)2, Fe(OH)3 гидроксиды
НFeO2– сложный анион металла
Так, в растворе Na2SО4 с рН =2 (рис. 2.2) в качестве продукта коррозии получаются ионы Fe2+, которые в дальнейшем под действием кислорода, растворенного в коррозионной среде, окисляются до ионов Fe3+ (т.е. коррозия идет с образованием растворимых солей железа). При этом продукты коррозии не оказывают тормозящего влияния на скорость коррозии, поэтому в таких средах коррозия протекает быстро и тем быстрее, чем кислее коррозионная среда, так как количество основного окислителя ионов Н+ увеличивается.
В растворе Na2S04 с рН=7 в качестве продуктов коррозии образуется смесь нерастворимых гидроксидов (nFе(ОН)2∙mFе(ОН)3 ∙kH2O). Чтобы определить насколько сильно эти оксиды тормозят скорость коррозии, необходимо узнать, насколько упорядоченными они получаются. Это можно выяснить, только поставив опыт по коррозии железа в растворе Na2S04. Если такой опыт провести, то легко определить, что при таком рН оксиды получаются очень неупорядоченные (такие неупорядоченные оксиды на железе часто называют ржавчиной). Ржавчина может снизить скорость коррозии только при достаточно большой толщине, в связи с этим в растворе Na2S04 с рН=7 коррозия железа опасна, и его необходимо защищать.
В щелочном растворе Na2S04 с рН=12, согласно диаграмме Пурбе, также получаются гидроксиды Fe(OH)2 и Fе(ОН)3, но, как показывает опыт, в данных условиях они получаются упорядоченными и хорошо защищают металл, поэтому в растворе Na2S04 с рН=12 железо пассивируется и становится устойчивым.
Если раствор Na2S04 подщелочить еще в большей степени, до рН >13, то в таком растворе железо может дополнительно корродировать с образованием НFe02–, т.е. вновь получаются растворимые продукты коррозии, при этом повышается скорость общей коррозии и увеличивается вероятность локальных форм коррозии, в частности коррозионного растрескивания.
График зависимости скорости коррозии железа от рН коррозионной среды представлен на рис. 2.3.
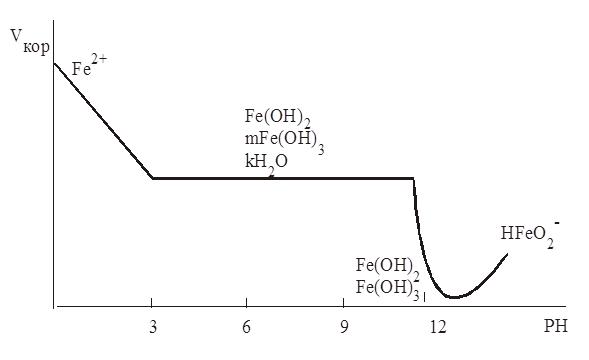
Рис. 2.3. Зависимость скорости коррозии углеродистых и
низколегированных сталей от рН коррозионной среды
Ход выполнения работы
В данной лабораторной работе предлагается проанализировать коррозионное поведение 3–4 металлов в трех средах, отличающихся по рН.
Опыты проводятся в следующей последовательности:
1. Подготовить образцы исследуемых металлов (механическая обработка. обезжиривание).
2. С помощью рН–метра определить рН всех коррозионных сред, которые будут использоваться в работе. Значение рН коррозионных сред записать в таблицу.
3. Измерить последовательно коррозионные потенциалы всех металлов в исследуемых коррозионных средах. Измерение стационарного потенциала коррозии производится с помощью цифрового вольтметра в коррозионной ячейке, в виде стакана с крышкой. В качестве электрода сравнения использовать хлорсеребряный электрод с потенциалом 0,201 В. Измерение потенциала производится в течение 3–7 мин, до получения стационарного значения.
4. Рассчитать значение стационарного потенциала коррозии по водородной шкале.
5. Исходя из состава коррозионной среды, определить окислители, присутствующие в ней и их равновесные потенциалы.
6. Сравнить значение экспериментально полученного стационарного потенциала коррозии исследуемого металла с рассчитанными значениями равновесных потенциалов окислителей. Сделать вывод, под действием каких окислителей идет процесс коррозии. Если Еравнох < ЕкорМе, то данный окислитель не участвует в коррозионном процессе.
7. Исходя из состава (наличие комплексообразователей, анионов, способных давать труднорастворимые соли с корродирующим металлом) и рН коррозионной среды, сделать предположение о возможной анодной реакции коррозионного процесса.
Например, при коррозии железа растворе 10% Na2SO4 с рН = 2,5 стационарный потенциал коррозии оказался равным – 0,36 В (н.в.э.), а в этой же среде с рН = 6 Екор = -0,34 В (н.в.э.). В данной коррозионной среде отсутствуют комплексообразователи и нет анионов, способных давать с железом труднорастворимые соли, поэтому на основании диаграммы Пурбе (рис 2.2) видим, что в Na2SO4 с рН 2,5 наиболее вероятна анодная реакция
Fe – 2e → Fe2+,
а в среде с рН = 6
Fe – 2e + 2OH → Fe(OH)2.
Равновесные потенциалы этих реакций следующие:


Подставляя в уравнения значения активности ионов железа в коррозионной среде и ее pH, можно рассчитать величины равновесных потенциалов железа в средах с рН 2,5 и 6. (Активность ионов железа в солевых средах NaCl, Na2SO4 и др. зависит от чистоты соли и обычно берется равной 10-3 – 10-4 моль/л).
8. Расчетное значение Е  сравнивается с Екор. Если при этом окажется, что Екор отрицательнее рассчитанного значения Е
сравнивается с Екор. Если при этом окажется, что Екор отрицательнее рассчитанного значения Е  , то это означает, что предполагаемая анодная реакция определена неверно и, следовательно, необходимо сделать другое предположение по виду анодной реакции и вновь рассчитать равновесный потенциал металла.
, то это означает, что предполагаемая анодная реакция определена неверно и, следовательно, необходимо сделать другое предположение по виду анодной реакции и вновь рассчитать равновесный потенциал металла.
9. На основании проведенного анализа записать уравнения катодных и анодных реакций коррозионного процесса. Сделать вывод об опасности коррозии исследуемого металла в данной коррозионной среде.
Если в результате коррозионного процесса получаются растворимые продукты коррозии, то в этом случае коррозия всегда опасна. Если продукты коррозии нерастворимы, то коррозия будет не опасна только в том случае, когда эти продукты получаются упорядоченными, плотными, способными пассивировать металл. Какие получаются нерастворимые продукты коррозии, упорядоченные или неупорядоченные, может быть определено на основании литературного или жизненного опыта, или с помощью специально поставленного длительного эксперимента.
Результаты анализа свести в табл. 2.1.
Таблица 2.1
Анализ коррозионной ситуации
|
Ме
| Корроз. среда
|
рН
среды
| Екор
| Анодные и катодные реакции
| Продукты коррозии
| Опасность коррозии
|
| Ag/AgCl
| н.в.э.
|
| | | | | | | | |
10. Сравнивая значения коррозионного потенциала с равновесными потенциалами катодного и анодного процессов, сделать вывод, какая из реакций коррозионного процесса является наиболее замедленной. Если Екор близок к равновесному потенциалу анодной реакции, то замедлен катодный процесс коррозии. Если коррозионный потенциал близок к равновесному потенциалу катодной реакции, то замедлена анодная реакция коррозионного процесса.
Оценка скорости коррозии металлов с помощью коррозиметра
Качественный анализ коррозионной ситуации предлагается подтвердить количественной оценкой скорости коррозии исследуемых металлов с помощью коррозиметра «Эксперт–004». Коррозиметр «Эксперт–004» состоит из измерительного преобразователя (ИП) и двухэлектродного измерительного датчика с меняющимися электродами. Измерительный датчик включает в себя специальный разъем, с помощью которого датчик присоединяется к разъему «ИЗМ» на задней панели измерительного преобразователя, головку датчика и два электрода, меняющихся в ходе выполнения работы. Характеристика электродов, использующихся при выполнении лабораторной работы, приведена в табл. 2.2. Электроды находятся в специальной коробке.
Перед выполнением измерений два электрода из исследуемого материала вынимают из коробки, полируют с помощью войлока, обезжиривают содой, промывают, сушат фильтровальной бумагой и вкручивают в головку датчика. С датчика откручивают защитную гайку, после чего с помощью разъема его присоединяют к измерительному преобразователю. Датчик зажимают в лапке штатива, а электроды датчика помещают в стаканчик с исследуемой коррозионной средой так, чтобы коррозионная среда закрывала рабочую поверхность электродов, но не касалась головки датчика.
Таблица 2.2
Характеристики электродов для измерения скорости коррозии.
|
Материал
| Длина электрода, см
| Диаметр электрода, см2
| Рабочая площадь электрода, см2
| Маркировка
(цвет и количество полос)
|
| Ст 45
|
| 0,6
| 7,54
| 1зеленая
|
| Цинк
|
| 0,6
| 7,54
| -
|
|
|
| 0,6
| 9,42
| 1 черная
|
| Никель
|
| 0,6
| 7,54
| -
|
| Алюминий, А0
|
| 0,65
| 8,16
| Красная.
зеленая
|
| Алюминиевый сплав, АМг6
|
| 0,5
| 6,28
| 2 красных
|
| Медь, М1
|
| 0,6
| 7,54
| -
|
| Олово
|
| 0,8
| 10,05
| -
|
| Свинец
|
| 0,86
| 10,8
| -
|
Измерение показателя общей скорости коррозии (П, мкм/год) на исследуемом металле проводится в следующей последовательности:
– нажать клавишу «ВКЛ» прибора и удерживать ее до тех пор, пока на дисплее прибора последовательно не появится сообщение:
Коррозиметр
Изм. Коррозии;
– провести ввод параметров режима измерения показателя общей коррозии. Для этого нажать клавишу «ВВОД». На дисплее появится сообщение о параметрах, которые нужно ввести.
– нажать клавишу «7». На дисплее появится пояснение «Площадь эл.» Ввести численное значение рабочей площади электрода в соответствии с табл. 2.2 и снова нажать на клавишу «ВВОД». После появления запроса на дисплее прибора вновь нажать клавишу «ВВОД»;
– ввести время измерения скорости коррозии нажатием клавиши «Ф1», для исследуемых сред, представляющих собой солевые растворы с различным рН, достаточно ввести время 30 – 60 с. После ввода числа дважды нажать клавишу «ВВОД»;
– ввести диапазон измерения скорости коррозии нажатием кнопки «→», при этом цифра 1 позволяет измерять скорость коррозии до 20000 мкм/год, 2 - до 2000 мкм/год, 3 - до 200 мкм/год, 4 – до 20 мкм/год. При неизвестных величинах скорости коррозии для данного материала в исследуемой коррозионной среде всегда рекомендуется выбирать диапазон 1.
– выбрать электродную систему нажатием клавиши «2». В настоящей работе используется двухэлектродная система (2х);
– ввести материал электрода нажатием клавиш «1» или «3». При этом необходимо выбрать символ того материала, из которого изготовлены электроды датчика;
– ввести коэффициент материала электрода. Для ввода коэффициента вначале нажать клавишу «Ф2», при этом на экране появиться текущее значение коэффициента и материала электрода. Для ввода нового значения нажать клавишу «7»,а после приглашения необходимое число (таблица 2.3).
Таблица 2.3.
Коэффициент материала электрода
| №
| Материал
| Валентность
металла
| Коэффициент материала электродов
|
|
| Железо, сталь
|
| 1,00
|
|
| Медь
|
| 1.00309
|
|
| Цинк
|
| 1,29056
|
|
| Свинец
|
| 2,57847
|
|
| Алюминий
|
| 0,93746
|
|
| Олово
|
| 2,29389
|
|
| Никель
|
| 0,93817
|
– дважды нажать клавишу «Ввод». При этом коэффициент пересчета запоминается преобразователем;
– для выхода из режима изменения коэффициента пересчета нажать клавишу «Отм»;
– провести измерение показателя общей коррозии исследуемого металла. Для этого нажать клавишу «ИЗМ». На дисплее прибора появится сообщение:
00:03
0.15 мВ … 2х,
где 00:03 – текущее время измерения напряжения поляризации;
0,15мВ – начальная разность потенциалов рабочего и вспомогательного электродов (желательно, чтобы она не превышала 100 мВ), обусловленная дефектами и небольшими различиями в качестве образцов.
2х – тип электродной системы.
В этом режиме в течение 10 с без наложения поляризующего импульса происходит измерение начальной разности потенциалов рабочего и вспомогательного электродов. По истечении времени измерения начальной разности потенциалов электродов происходит включение поляризующего импульса, а на дисплее появляется сообщение:
МВ 00:04
МкА u 2х,
где 0,15 мВ – сохраненное в памяти прибора значение начальной разности потенциалов электродов; 00:04 – отсчет выбранного времени поляризующего импульса; 0,12 мкА – текущее значение внешнего тока; 2х – тип электродной системы; u – символ выбранного диапазона автоматической компенсации начальной разности потенциалов электродов (u – 100 или U – 500 мВ).
По истечении времени измерения на экране появляется измеренное значение скорости общей коррозии в мкм/год. Для выхода из режима измерения скорости общей коррозии нажать клавишу «ОТМ».
При необходимости исследовать скорость коррозии этого же металла в другой среде повторить операции по подготовке электродов к измерению (отполировать войлоком, обезжирить содой, промыть), заменить коррозионную среду в измерительной ячейке и измерить скорость коррозии.
Экспериментальные результаты по оценке скорости коррозии различных материалов занести в табл. 2.3., и сравнить с результатами качественного анализа табл. 2.1
Таблица 2.3
Скорость коррозии исследуемых металлов
| Металл
| Исследуемая среда
| Глубинный показатель коррозии, мм/год
| Балл и группа стойкости
|
Теоретические предпосылки
Контактная коррозия является довольно распространенным видом коррозии. Ее нужно учитывать всегда, когда корродирующий объект имеет в своем составе по крайней мере два различных по природе металла.
Наиболее удобно теоретические основы коррозии металлов в контакте разбирать с помощью коррозионных диаграмм.
Ход выполнения работы
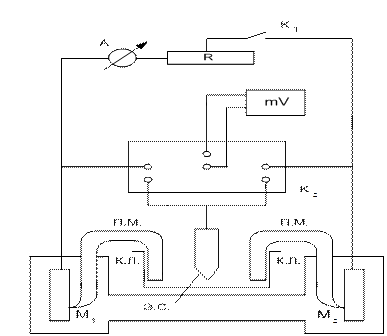
В настоящей лабораторной работе контактную коррозию предлагается исследовать с помощью установки, представленной на рис.3.4. Согласно схеме рис. 3.4, при разомкнутом ключе К1 металлы работают без контакта. Измеряя в этом случае потенциалы металлов, можно определить стационарные потенциалы коррозии металлов М1 и М2 , работающих без контакта (Е  и Е
и Е  ). Далее металлы приводятся в контакт через амперметр и мост сопротивлений R (начальное значение R = 100000 Ом). За счет постепенного уменьшения сопротивления моста R постепенно улучшается контакт двух металлов. Измеряя при каждом значении сопротивления R внешний ток и величину потенциалов металлов, снимают поляризационные кривые (1 и 2), выделенные на рис 3.3 жирными линиями.
). Далее металлы приводятся в контакт через амперметр и мост сопротивлений R (начальное значение R = 100000 Ом). За счет постепенного уменьшения сопротивления моста R постепенно улучшается контакт двух металлов. Измеряя при каждом значении сопротивления R внешний ток и величину потенциалов металлов, снимают поляризационные кривые (1 и 2), выделенные на рис 3.3 жирными линиями.
Рис. 3.4. Схема установки для исследования к








 гидратированные катионы [Ме(Н2О)]ne+
гидратированные катионы [Ме(Н2О)]ne+ комплексные соединения [Ме(Кn)]m+, [Ме(Кn)]m–
комплексные соединения [Ме(Кn)]m+, [Ме(Кn)]m–

 Ме – ne оксиды и гидроксиды МеО, Ме(ОН)2
Ме – ne оксиды и гидроксиды МеО, Ме(ОН)2
 ,
, рН (2.1)
рН (2.1)
 ;
; ;
; .
.
 Fe2+, Fe3+ гидратированные катионы
Fe2+, Fe3+ гидратированные катионы
 Fe – 2e Fe(OH)2, Fe(OH)3 гидроксиды
Fe – 2e Fe(OH)2, Fe(OH)3 гидроксиды


 сравнивается с Екор. Если при этом окажется, что Екор отрицательнее рассчитанного значения Е
сравнивается с Екор. Если при этом окажется, что Екор отрицательнее рассчитанного значения Е  и Е
и Е  ). Далее металлы приводятся в контакт через амперметр и мост сопротивлений R (начальное значение R = 100000 Ом). За счет постепенного уменьшения сопротивления моста R постепенно улучшается контакт двух металлов. Измеряя при каждом значении сопротивления R внешний ток и величину потенциалов металлов, снимают поляризационные кривые (1 и 2), выделенные на рис 3.3 жирными линиями.
). Далее металлы приводятся в контакт через амперметр и мост сопротивлений R (начальное значение R = 100000 Ом). За счет постепенного уменьшения сопротивления моста R постепенно улучшается контакт двух металлов. Измеряя при каждом значении сопротивления R внешний ток и величину потенциалов металлов, снимают поляризационные кривые (1 и 2), выделенные на рис 3.3 жирными линиями.