

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Своеобразие русской архитектуры: Основной материал – дерево – быстрота постройки, но недолговечность и необходимость деления...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Своеобразие русской архитектуры: Основной материал – дерево – быстрота постройки, но недолговечность и необходимость деления...
Топ:
Проблема типологии научных революций: Глобальные научные революции и типы научной рациональности...
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного хозяйства...
Эволюция кровеносной системы позвоночных животных: Биологическая эволюция – необратимый процесс исторического развития живой природы...
Интересное:
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Национальное богатство страны и его составляющие: для оценки элементов национального богатства используются...
Инженерная защита территорий, зданий и сооружений от опасных геологических процессов: Изучение оползневых явлений, оценка устойчивости склонов и проектирование противооползневых сооружений — актуальнейшие задачи, стоящие перед отечественными...
Дисциплины:
|
из
5.00
|
Заказать работу |
Содержание книги
Поиск на нашем сайте
|
|
|
|
Поскольку состояние системы характеризуется 3 состояниями, то: равновесие в точке фазового перехода наблюдается, если выделяются 3 условия, которые подчиняются правилу Максвела.
Правило Максвела: Т=const (термич. равновесие), P=const (механическое равновесие), μ=const (химический потенциал) μ1(Р, Т)= μ2(Р, Т).
 Уравнение Клапейрона-Клаузиуса.
Уравнение Клапейрона-Клаузиуса.
dG=VdP-SdT- μdN (μdN – если число частиц меняется),
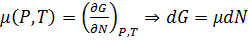 ; G=μN
; G=μN
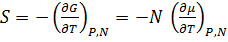 ;
;
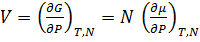 ;
;
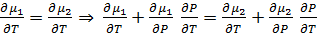 группируем
группируем
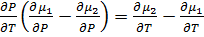 ;
;
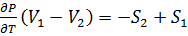 ;
;
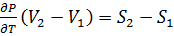 ;
;
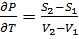 , по определению энтропия
, по определению энтропия 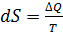 ; ⇒
; ⇒ 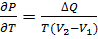
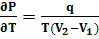 - Уравнение Клапейрона-Клаузиуса (q- удельная (скрытая) теплота перехода).
- Уравнение Клапейрона-Клаузиуса (q- удельная (скрытая) теплота перехода).
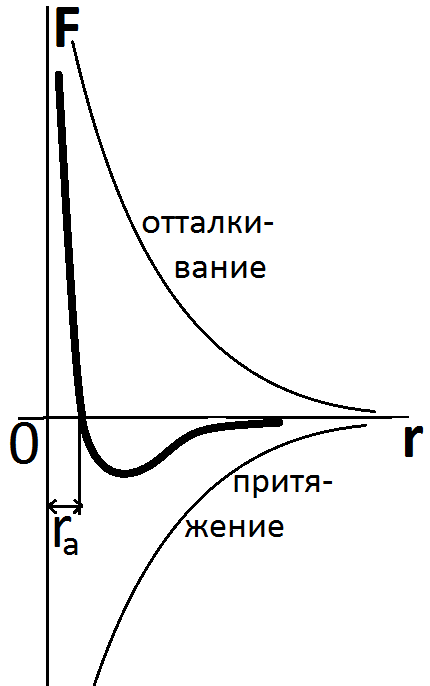 65. Силы и потенциальная энергия межмолекулярного взаимодействия. Межмолекулярный потенциал Леннард-Джонса. Уравнение Ван-дер-Вальса.
65. Силы и потенциальная энергия межмолекулярного взаимодействия. Межмолекулярный потенциал Леннард-Джонса. Уравнение Ван-дер-Вальса.
Силы межмолекулярного взаимодействия в газах.
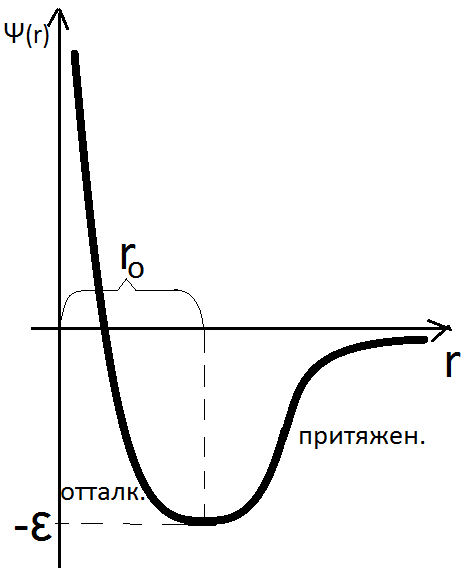
Если мы рассмотрим 2 частицы и покажем силу взаимодействия, как функцию расстояния между частицами, то при уменьшении расстояния между частицами, резко увеличатся силы межмолекулярного отталкивания, в то же время возрастают силы притяжения.
Взаимодействие между частицами описывается межмолекулярным потенциалом Леннард-Джонса: 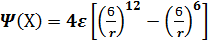 .
.
 Силы притяжения:
Силы притяжения:
1) Ван-дер-Вальсовы силы. Они эффективны на расстоянии до 10-9м – для всех сил притяжения. Они обусловлены тем, что при взаимодействии 2-х частиц возникает переориентация, связанная с наличием у несимметричных молекул (полярных) электронных дипольных моментов.
 .
.
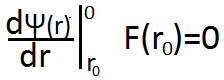
 2) Индукционные силы. Силы, связанные с поляризацией неполярных молекул в поле, которое создано другими молекулами
2) Индукционные силы. Силы, связанные с поляризацией неполярных молекул в поле, которое создано другими молекулами 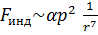 .
.
3) Дисперсионные силы связаны с возбуждением колебаний электронов в молекулах, посредством колебания электронов в других молекулах. Эти колебания происходят в фазе и являются резонансным. 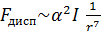 .
.
Силы отталкивания убывают значительно быстро, с ростом расстояния 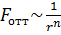 , где n≥9. Силы отталкивания обусловлены квантово-механическим взаимодействием, возникающим при перекрывании электронных оболочек атомов.
, где n≥9. Силы отталкивания обусловлены квантово-механическим взаимодействием, возникающим при перекрывании электронных оболочек атомов. 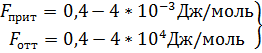 .
.
Если мы сложим две ветки, которые мы нарисовали, то на каком-то расстоянии мы получим силу взаимодействия, равную нулю. r0 – величина складывания.
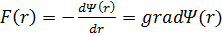
Уравнение Ван-дер-Вальса.
Необходимо внести правки в уравнение Менделеева-Клапейрона PV=νRT.
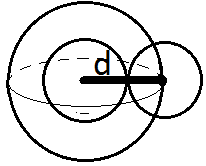 1)Правка к V.
1)Правка к V.
Пусть в системе (сосуде) N частиц, каждая которых характеризуется объёмом V0.
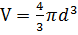 , r=d/2,
, r=d/2,
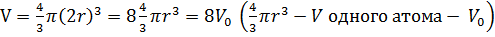 .
.
Поскольку 2 взаимодействующие частицы, то V1=4V0 .
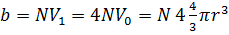 , b – коэффициент правки.
, b – коэффициент правки.
P(V-νb)=νRT.
Мы учли только парное взаимодействие, т.е. исключили тройные столкновения и более, т.к. они практически невозможны.

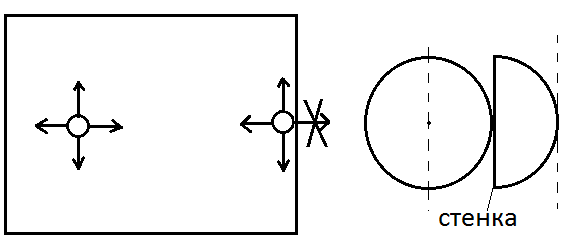 2)Правка на межмолекулярное взаимодействие.
2)Правка на межмолекулярное взаимодействие.
Давление реального газа на стенки сосуда оказывается меньше, чем давление, оказываемое на стенки идеальным газом.
р=рид-∆р, где ∆р – правка.
F=a1n0, p=F/S
 ;
;
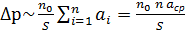 ;
;
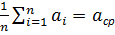 ;
;
n=n0Sr0 ;
∆р ~ a2n02, n0=N/V;
∆р ~ а/V2
|
|
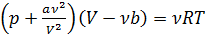 - Уравнение Ван-дер-Вальса способно описать поведение реального газа.
- Уравнение Ван-дер-Вальса способно описать поведение реального газа.
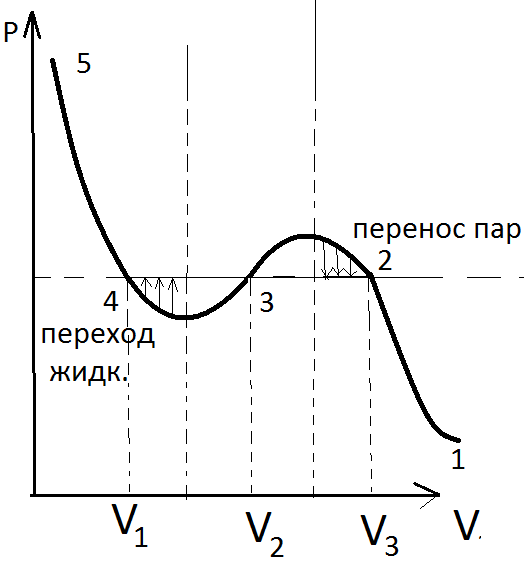
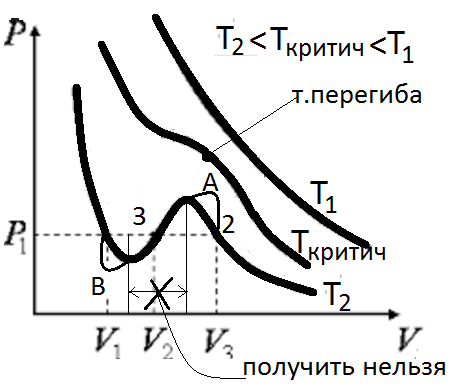 66. Изотермы Ван-дер-Вальса. Теоретические и экспериментальные изотермы реальных газов. Связь критических параметров и параметров уравнения Ван-дер-Вальса.
66. Изотермы Ван-дер-Вальса. Теоретические и экспериментальные изотермы реальных газов. Связь критических параметров и параметров уравнения Ван-дер-Вальса.
Изотермы газа Ван-дер-Вальса.
При высоких Т уравнениеВан-дер-Вальса и Менделеева-Клапейрона дают одну и туже величину.
А – область перегретого пара, для чистых газов.
2 – переохлаждённый, перенасыщенный пар;
3- перегретая жидкость;
2-3 нестабильное состояние – неравновесное состояние.
В – участок которому соответствует перегретая жидкость
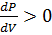 ,
,
1-2, 4-5 Изотерма реального вещества
2-3-4 соответствует переход из газа в жидкость.
Длинна дуги 2-3 = длине дуги 3-4.
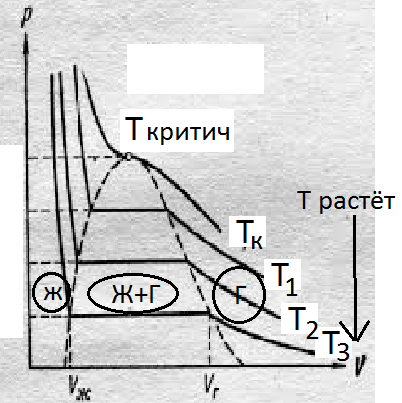 Если построить набор изотер при различных температурах, начиная с критической, то набор изотерм, которые получ., позволяет определить области, в которых мы можем получить либо фазовое состояние, либо несколько.
Если построить набор изотер при различных температурах, начиная с критической, то набор изотерм, которые получ., позволяет определить области, в которых мы можем получить либо фазовое состояние, либо несколько.
Фазовая диаграмма: показывает условия для наблюдения той или иной фазы при определённых термодинамических условиях.
ТK, VK, PK –a, b.
В критической точке ТK различие между жидкостью и газом исчезает.
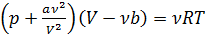 - Уравнение Ван-дер-Вальса.
- Уравнение Ван-дер-Вальса.
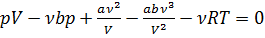 , умножим на
, умножим на  ,
,
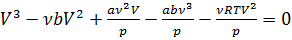 ,
,
 ,
,
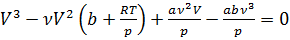 ,
,
Формула (А-В)3=А3+3В2А-3А2В-В3=0
(V-VK)3= V 3+3 VK 2 V -3 V 2 VK - VK 3=0,
① 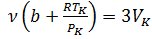 , ②
, ② 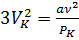 , ③
, ③ 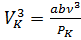 ,
,
②/③ ⇒  ⇒ VK=3bν → ②
⇒ VK=3bν → ②
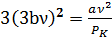 ,
, 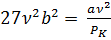 ,
, 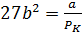 ⇒
⇒  ; VK и PK → ①
; VK и PK → ①
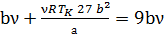 ,
, 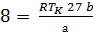 ⇒
⇒ 
Uиг=νСVT – внутренняя энергия для идеального газа. Для газа, который подчиняется уравнению Ван-дер-Вальса это выражение не подходит.
67. Внутренняя энергия реального газа (газа Ван-дер-Вальса). Сжижение газов и получение низких температур.
Внутренняя энергия газа Ван-дер-Вальса. U=Uпоступ.движ.+Uпотен.энерг.взаимод.
δА=dUпотен.энерг.взаимод.
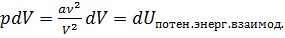 ,
, 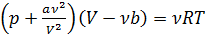 ,
,
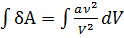 ,
,
 ,
,
Если V→∞, то Uвзаимод.→0 ⇒ С=0 т.о. 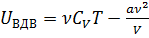 Изменение Т реального газа (газа Ван-дер-Вальса) возможно не только за счёт совершённой работы, но и за счёт изменения потенциальной энергии взаимодействия, которое сопутствует изменению энергии этого V.
Изменение Т реального газа (газа Ван-дер-Вальса) возможно не только за счёт совершённой работы, но и за счёт изменения потенциальной энергии взаимодействия, которое сопутствует изменению энергии этого V.
|
|
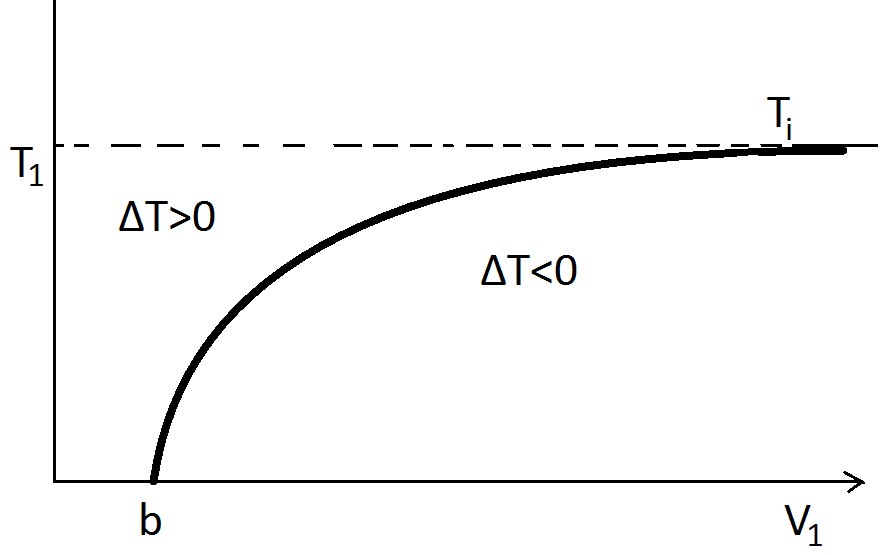
Тi – температура инверсии при которой эффект Джоуля-Томпсона меняет знак.
Тi = Тi (V1)
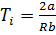 ,
,
 ,
,
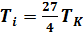 , для большинства газов Тi выше комнатной температуры. Для этих газов при охлаждении легко получается жидкая фаза, например N2: Тi =1063K, CO2: Тi =2073K, но О2: Тi =155К.
, для большинства газов Тi выше комнатной температуры. Для этих газов при охлаждении легко получается жидкая фаза, например N2: Тi =1063K, CO2: Тi =2073K, но О2: Тi =155К.
Не и О2 предварительно охлаждают и после этого проводится сжижение.
Эффект Джоуля – Томпсона показывает, что внутренняя энергия для идеального газа и для модели реального газа (газа Ван-дер-Вальса), при процессах дросселирования происходит взаимный переход кинетической энергии и потенциальной энергии.
Если Ткритич больше Ткомнатной, то газы можно превратить в жидкость путём сжатия в компрессоре. Если Ткритич меньше Ткомнатной, то нужно сначала охладить газ, потом сжимать.
Сжиженные газы применяют: О2 и Н2 – самое высокоэнергетическое ракетное топливо, для заправки автомобилей и т.п.
|
|
|

Архитектура электронного правительства: Единая архитектура – это методологический подход при создании системы управления государства, который строится...

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!