

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...
Топ:
Установка замедленного коксования: Чем выше температура и ниже давление, тем место разрыва углеродной цепи всё больше смещается к её концу и значительно возрастает...
Генеалогическое древо Султанов Османской империи: Османские правители, вначале, будучи еще бейлербеями Анатолии, женились на дочерях византийских императоров...
Интересное:
Что нужно делать при лейкемии: Прежде всего, необходимо выяснить, не страдаете ли вы каким-либо душевным недугом...
Средства для ингаляционного наркоза: Наркоз наступает в результате вдыхания (ингаляции) средств, которое осуществляют или с помощью маски...
Наиболее распространенные виды рака: Раковая опухоль — это самостоятельное новообразование, которое может возникнуть и от повышенного давления...
Дисциплины:
|
из
5.00
|
Заказать работу |
Содержание книги
Поиск на нашем сайте
|
|
|
|
2 начало т/д. определяет условия, при которых возможно превращение одних видов Е в другие, а также можно указать возможное направление протекания этих процессов. 1850-Клаузиус- невозможен самопроизвольный переход тепла от менее к более нагретому телу, или не возможны процессы, единственным результатом которых была бы передача тепла от менее к более нагретому телу. (формулировка Клаузиуса).
Неравенство Клаузиуса выражает теорему термодинамики для кругового процесса:

Неравенство (Q1/T1)-(Q2/T2)≤0 показывает, что любой произвольный циклический (тепловой) процесс происходит в направлении понижения температуры.
Неравенство Клаузиуса можно записать:
 кол-во теплоты, сообщаемое системе (или отводимое от неё) на бесконечно малом участке цикла, Т – абсол. температура соответств. элемента среды.
кол-во теплоты, сообщаемое системе (или отводимое от неё) на бесконечно малом участке цикла, Т – абсол. температура соответств. элемента среды.
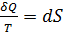 –в случае обратимых процессов.
–в случае обратимых процессов.
Неравество Клаузиуса позволяет ввести понятие энтропии S(p;V;T). В статистической физике энтропия явл. мерой вероятности осуществления какого-либо макроскопического состояния.
Энтропия – величина аддитивная. Если есть две подсистемы, энтропии которых известны, то энтропия системы, сост. из этих подсистем, будет равна сумме их энтропий.
 Процесс перехода из состояния 1 в состояние 2 в принципе может быть неравновесным, но если он равновесный, то изменение энтропии можно рассчитывать. Энтропия является функцией состояния.
Процесс перехода из состояния 1 в состояние 2 в принципе может быть неравновесным, но если он равновесный, то изменение энтропии можно рассчитывать. Энтропия является функцией состояния.
Замкнутый теплоизолированный сосуд объёмом V0 c идеальным газом. А=0- работу газ не совершает, при перестановке перегородки из V1 в V2 он просто расширяется. 
Если процесс явл-ся адиабатическим (без обмена теплотой), то δQ=0, dS=0
Q=A= ϑRTln(V2/V1)
∆S=Q/T=ϑRln(V2/V1)=ϑkNA ln(V2/V1)=kNln(V2/V1). (R= N A k)
Рассмотрим вероятность того, что одна частица будет находится в объёме, который явл. частью всего объёма системы. Чем больше V, который мы рассматриваем, тем больше вероятность найти частицу.
Используя выражения (V1/V0)N=p1 и (V2/V0)N=p2 , получаем:
∆S=kNln(V2/V1)= kln(V2/V1)N= kln(p2/p1).
Статистический вес- число способов, или число макросостояний, которыми можно реализовать данное состояние (Ω). Макросостояние – состояние в-ва, характеризуемое термодинамическими параметрами (объем, давление, температура, внутренняя энергия).
p1~ Ω1, p2~ Ω2 ⇒∆S=kln(Ω2/ Ω1);  - Формула Больцмана, где
- Формула Больцмана, где  ; W=(Ω2/ Ω1) - вероятность данного состояния.
; W=(Ω2/ Ω1) - вероятность данного состояния.
Равновесное сост., кот. формируется у системы, характеризуется тем, что с течением времени не изменяются т/д характеристики. - В равновесном сост. энтропия максимальна. - В изолированной системе, процессы, протекающие произвольно, идут в направлении возрастания энтропии.
5 определение 2-го начала термодинамики: все самопроизвольные процессы в изолированной системе протекают в сторону возрастания энтропии.
Свойства S: 1) Функция состояния S зависит от набора термодинам. параметров. Если рассмотреть процесс адиабатический (система не обменивается теплотой с окружающей средой), то изменение S в таком процессе=0, из этого следует, что это изоэнтропийный процесс. 2) S-величина аддитивная (S =S1+S2+S3…+Sn). 3) S изолированной системы либо возрастает, либо const 4) Если ∆S=0, то в этой системе возможны и прямые и обратные процессы. Если ∆S >0, то процесс может идти только в одну сторону (обратный процесс невозможен). ∆S <0 не может быть в изолированной системе.
Статистическое толкование: энтропия является мерой неупорядоченности системы.
|
|
|

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...

Историки об Елизавете Петровне: Елизавета попала между двумя встречными культурными течениями, воспитывалась среди новых европейских веяний и преданий...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...
© cyberpedia.su 2017-2025 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!