При горении топлива горючие элементы воздействуют с окислителем, т.е. с кислородом, и образуют соответствующие окислы СО2, SO2, H2O. Так как окисление идет в основном за счет кислорода, содержащегося в воздухе (21%), то в продуктах сгорания содержится, кроме указанных окислов азот, входивший ранее в воздух.
Кроме этого в продуктах сгорания содержится зола, содержание которой и обусловлено количеством минеральных примесей в топливе (SiO2, Al2O3, Fe2O3, известь – CaO, окислы щелочных металлов Na2O, K2O и сульфаты).
Действительный объем продуктов сгорания 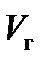 , м3/кг, равен
, м3/кг, равен
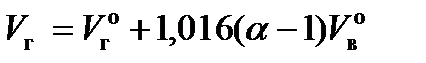 , где
, где
Теоретический объем продуктов сгорания V г °, м3/кг, равен
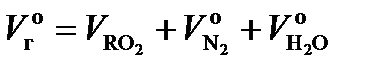
Суммарный теоретический объем трехатомных газов,  и
и  обозначен символом м3/кг,
обозначен символом м3/кг,  и записывается
и записывается 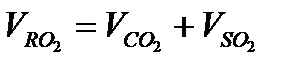
Эта величина для твердых (кроме сланцев) и жидких топлив равна
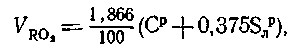
Теоретический объем азота 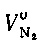 , м3/кг, обусловлен азотом, входящим в теоретически необходимое для горения количество воздуха, и азотом топлива.
, м3/кг, обусловлен азотом, входящим в теоретически необходимое для горения количество воздуха, и азотом топлива.
Тогда 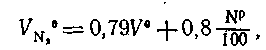 где 0,8=l/ρN2
где 0,8=l/ρN2
Теоретический объем водяных паров, м3/кг, для твердых и жидких топлив
V0Н2О = 0,0124 Wр+0,111Нр+0,0161V0в
1) часто требуется оценка парциальных давлений трехатомных газов 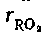 и
и  МПа (кгс/см2).
МПа (кгс/см2). 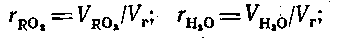
2) концентрация золы в продуктах сгорания, г/м3, равная 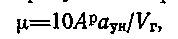
где —  доля золы, уносимой с газами и в среднем равной для топок слоевых 0,2—0,3, для пылеугольных — 0,60—0,95;
доля золы, уносимой с газами и в среднем равной для топок слоевых 0,2—0,3, для пылеугольных — 0,60—0,95;
Вопрос № 61
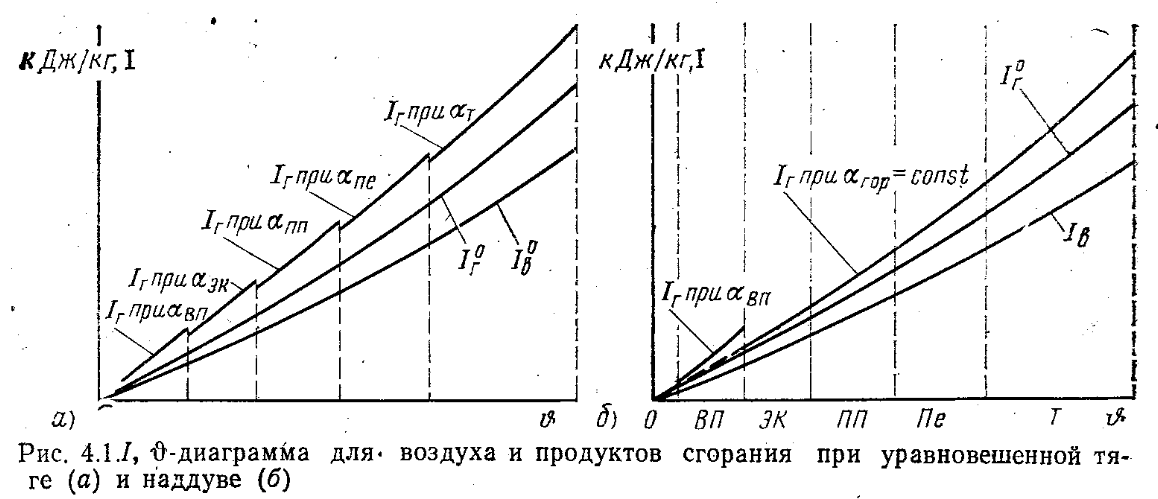
Таблицы и диаграммы энтальпий для расчетов. Теоретическая температура продуктов сгорания
Расчет энтальпий осуществляется по ⇒ зависимостям:
Теплота продуктов сгорания I, кДж/кг или кДж/м3, является суммой физической теплоты 3-х атомных газов (RO2), двухатомных (N2), и водяных паров (H2O). Для теоретического избытка воздуха и температуры это:
I0г = (VRO2*CRO2+V0N2*CN2+V0Н2О*CН2О)
VRO2 – теоретический объем 3–х атомных газов;
V0N2 – тоже азота;
V0Н2О – тоже водяных паров.
Теплоемкости С, кДж/(м3∙К), принимаются по табличным данным в зависимости в зависимости от температуры; с ростом температуры теплоемкость неизменно растет.
Энтальпия дымовых газов  для действительных объемов воздуха равна:
для действительных объемов воздуха равна:
Iг=I0г+(α–1)Iв+Iзл, или Iг=I0г+ΔIв+Iзл
где 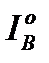 - энтальпия теоретического объема воздуха:
- энтальпия теоретического объема воздуха:
Iв=V0в+Св*υ.
V0в – теоретически необходимый объем воздуха.
При пылевидном сжигании топлив, когда имеет место высокий унос летучей золы с газами(высокозольные тл) – (Арαун)/Qрн> 1,4 (%*кг/МДж), следует учитывать отдельным членом в формуле физическую теплоту золы Iзл, кДж/кг:
Iзл=((СV)зл*Ар*αун)/100
где (СV)зл – энтальпия 1 кг золовых частиц при данной температуре газов.
Энтальпия дополнительного объема водяных паров из-за своей малости и для упрощения расчетов обычно не учитывается.
На основе этих формул составляются табл. позволяющие определить Энтальпии воздуха и продуктов сгорания для тл при α=1, при данной температуре. Также на основе этих зависимостей построены I, υ диаграммы.





 , м3/кг, равен
, м3/кг, равен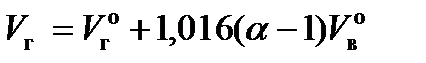 , где
, где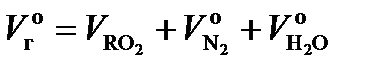
 и
и  обозначен символом м3/кг,
обозначен символом м3/кг,  и записывается
и записывается 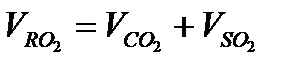
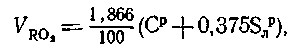
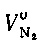 , м3/кг, обусловлен азотом, входящим в теоретически необходимое для горения количество воздуха, и азотом топлива.
, м3/кг, обусловлен азотом, входящим в теоретически необходимое для горения количество воздуха, и азотом топлива.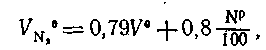 где 0,8=l/ρN2
где 0,8=l/ρN2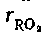 и
и  МПа (кгс/см2).
МПа (кгс/см2). 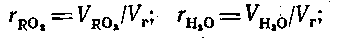
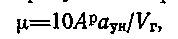
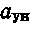 доля золы, уносимой с газами и в среднем равной для топок слоевых 0,2—0,3, для пылеугольных — 0,60—0,95;
доля золы, уносимой с газами и в среднем равной для топок слоевых 0,2—0,3, для пылеугольных — 0,60—0,95;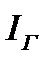 для действительных объемов воздуха равна:
для действительных объемов воздуха равна: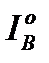 - энтальпия теоретического объема воздуха:
- энтальпия теоретического объема воздуха:



