Задача 1
Густина повітря при нормальних умовах (t=0 °С, р=105 Па) 1,293 кг/м3. Визначити густину повпря при тиску 104 Па і температурі-10 °С.
Задача 2
Газ, який можна вважати ідеальним, знаходиться у циліндрі під поршнем, який може вільно рухатись. Діаметр циліндра 20 см. У початкових умовах при 30 °С газ мае об'єм 0,0012 м3. До якої температури необхідно нагріти при постійному тиску, щоб поршень піднявся на 29 см?
Задача 3
До деякого двохатомного газу в ізобарному процесі підводиться теплота Q. Питома газова стала R=260 Дж/(кг К), теплоємність газу Сv=660 Дж/(кг К). Визначити, яка частка теплоти пішла на зміну внутрішньої енергії, а яка на виконання роботи.
Задача 4
У посудині, що мае об'єм 300 л, знаходиться кисень при тиску р1=2 бар та температурі t1=300°С. Який тиск при цьому встановиться?
Задача 5
Вода об'емом 5 л нагрівається електрокип'ятильником, що мае потужшсть 600 Вт. Скільки часу вода буде нагріватись до кипіння, якщо її початкова температура 30 °С:а
Основні процеси ідеальних газів
Основними термодинамічними процесами є ізохорний (що відбуваеться при сталому об'ємі V=const), ізобарний (при сталому тиску Р=const), ізотермічний (при сталій температурі Т=const), адіабатний (без теплообміну з навколишшми тілами). Всі ці процеси є окремі випадки пол і тропного процесу.
Рівняння політропного процесу
р∙vn =const, (2)
де показник політропи:
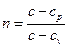 .
.
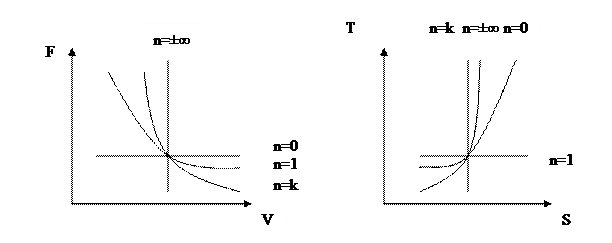
При n=±∞ 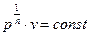 -процес ізохорний,
-процес ізохорний,
n=0 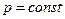 -процес ізобарний,
-процес ізобарний,
n=1 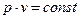 -процес ізотермічний,
-процес ізотермічний,
n=k 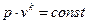 -процес адіабатний.
-процес адіабатний.
Діаграми цих процесів зображено на рисунку:
Залежність між параметрами стану в політропному процесі:
Зміна внутрішньої енергії^
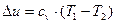 . (3)
. (3)
Робота процесу
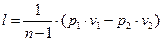 , (4)
, (4)
або
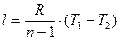 . (5)
. (5)
Теплоємність
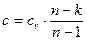 . (6)
. (6)
де показник адіабатики:
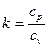 . (7)
. (7)
Теплота:
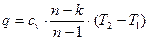 . (8)
. (8)
Зміна ентропії:
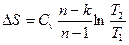 . (9)
. (9)
Рівняння адіабатного процесу
pVk=const, (10)
де показник адіабати
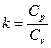 . (11)
. (11)
Залежність між параметрами стану в адіабатному процесі:
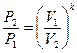 ; (12)
; (12)
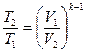 ; (13)
; (13)
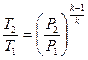 . (14)
. (14)
Зміна внутрішньої енергії:
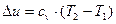 . (15)
. (15)
Робота процессу:
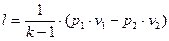 , (16)
, (16)
або
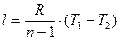 . (17)
. (17)
Теплоемність, кількість теплоти та зміна ентропії в адіабатному процесі дорівнюють нулю.
Рівняння ізохорного процессу:
V= const. (18)
Залежність між параметрами стану:
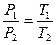 . (19)
. (19)
Зміна внутрішньої енергії:
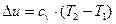 . (20)
. (20)
Робота дорівнює 0.
Теплоемнють:
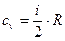 , (21)
, (21)
де і - ступень вільності газу (для одноатомних газів і = 3; для двохатомних газів і = 5; для багатоатомних газів і = 6).
Питома газова стала:
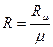 [Дж/(кг К)]; (22)
[Дж/(кг К)]; (22)
Універсальна газова стала:
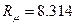 (Дж/ моль К ]; (23)
(Дж/ моль К ]; (23)
µ - молярна маса газу [ кг / моль ].
Теплота процессу:
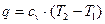 . (24)
. (24)
Зміна ентропії:
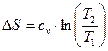 . (25)
. (25)
Р і вняння і зобарного процессу :
р=const. (26)
Залежність між параметрами стану:
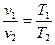 . (27)
. (27)
Зміна внутрішньої енергії:
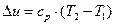 . (28)
. (28)
Робота процессу:
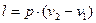 , (29)
, (29)
або
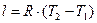 . (30)
. (30)
Теплоємність:
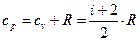 [Дж/кгК]. (31)
[Дж/кгК]. (31)
Теплота процессу:
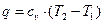 . (32)
. (32)
Змінення ентропії:
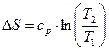 . (33)
. (33)
Рівняння ізотермічного процессу:
pv=const. (34)
Залежність між параметрами стану:
 . (35)
. (35)
Зміна внутрішньої ентропії:
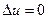 . (36)
. (36)
Робота процессу:
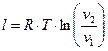 , (37)
, (37)
або
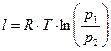 , (38)
, (38)
або
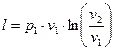 . (39)
. (39)
Теплоємність:
с=∞. (40)
Кількість теплоти дорівнює роботі процесу (тому що 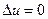 ) q=1.
) q=1.
Зміна ентропії:
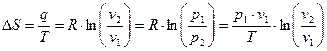 . (41)
. (41)





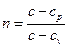 .
.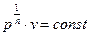 -процес ізохорний,
-процес ізохорний,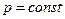 -процес ізобарний,
-процес ізобарний,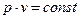 -процес ізотермічний,
-процес ізотермічний,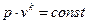 -процес адіабатний.
-процес адіабатний.
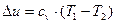 . (3)
. (3)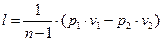 , (4)
, (4)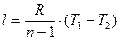 . (5)
. (5)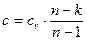 . (6)
. (6)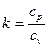 . (7)
. (7)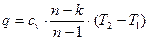 . (8)
. (8)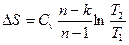 . (9)
. (9)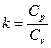 . (11)
. (11)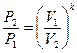 ; (12)
; (12)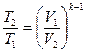 ; (13)
; (13)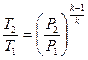 . (14)
. (14)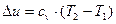 . (15)
. (15)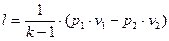 , (16)
, (16)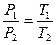 . (19)
. (19)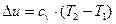 . (20)
. (20)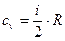 , (21)
, (21)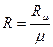 [Дж/(кг К)]; (22)
[Дж/(кг К)]; (22)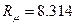 (Дж/ моль К ]; (23)
(Дж/ моль К ]; (23)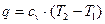 . (24)
. (24)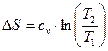 . (25)
. (25)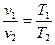 . (27)
. (27)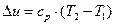 . (28)
. (28)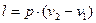 , (29)
, (29)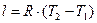 . (30)
. (30)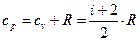 [Дж/кгК]. (31)
[Дж/кгК]. (31)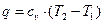 . (32)
. (32)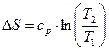 . (33)
. (33) . (35)
. (35)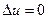 . (36)
. (36)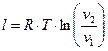 , (37)
, (37)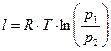 , (38)
, (38)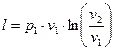 . (39)
. (39)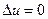 ) q=1.
) q=1.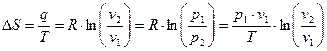 . (41)
. (41)

