Для расстановки коэффициентов в окислительно-восстановительном уравнении реакции протекающей в растворе наиболее оправдано использовать метод электронно-ионного баланса. Преимущество данного метода в том, что нет необходимости пользоваться формальной величиной степени окисления, так как для многих реакций в растворах она лишена физического смысла. Например, частица Mn, которой мы оперировали в методе электронного баланса, в водном растворе существовать не может и под действием воды переходит в MnO4-. Таким образом, в методе электронно-ионного баланса рассматриваются реально существующие частицы в растворе. Кроме того, этот метод позволяет учитывать роль среды (H2O, Н+, ОН-) на протекание окислительно-восстановительной реакции.
Необходимо помнить, что если в результате реакции частица теряет кислород в форме [О2-], то его акцептором в кислой среде являются ионы водорода, а в нейтральной и щелочной средах – вода
[О2-] + 2Н+ = H2O
[О2-] + H2O = 2ОН-
И наоборот, в щелочной среде донором О-2 являются группы ОН-, а в кислой и нейтральной - H2O. Участие среды в данных процессах неизбежно, так как частицы [О2-], вследствие высокой реакционной способности, появится в свободном виде не могут и должны быть связаны в устойчивую форму.
Применяя метод электронно-ионного баланса, расставим коэффициенты в уравнениях окисления сульфита натрия перманганатом калия в различных средах.
1. В кислой среде происходит обесцвечивание раствора перманганата калия, первоначально имевшего розовую окраску, что указывает на переход окрашенных ионов MnO4- в бесцветные катионы Mn2+. Уравнение протекает по следующей схеме:
KMnO4 + Na2SO4 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + 8H2O
В этом методе учитывают конкретные формы ионов, участвующих во взаимодействии, поэтому уравнение записывают в ионном виде.
K+ + MnO4- + 2Na+SO32- + 2H+ + SO42- → Mn2+ + SO42- + 2Na+ + SO42- + 2K+ + + SO42- + H2O
Процессы восстановления и окисления записываются в виде полуреакций:
 2 MnO4- + 8Н+ + 5е- = Mn2+ + 4H2O
2 MnO4- + 8Н+ + 5е- = Mn2+ + 4H2O
5 SO32- + H2O – 2e = SO42- + 2H+
Суммируя две полуреакции получаем ионное уравнение:
2MnO4- + 16Н+ + 5SO32- + 5H2O = 2Mn2+ + 8H2O + 5SO42- + 10Н+
Приводим подобные члены, получаем:
2MnO4- + 6Н+ + 5SO32- = 2Mn2+ + 3H2O + 5SO42-
Ионы водорода необходимы в первой полуреакции для связывания кислорода в воду, а вода во второй полуреакции для превращения сульфит иона в сульфат. Баланс зарядов в левой и правой частях уравнения осуществляется при помощи электронов.
Коэффициенты из краткого ионного уравнения переносят в молекулярное. Правильность уравнения проверяют по балансу атомов кислорода.
2КMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3Н2O
2. В нейтральной среде реакция окисления сульфита перманганатом калия протекает согласно уравнению:
KMnO4 + K2SO3 + H2O → MnO2 + K2SO4 + KOH
Полуреакции для данного случая записываются в следующем виде:
 2 MnO4- + 2H2O = MnO2 + 4OH-
2 MnO4- + 2H2O = MnO2 + 4OH-
3 SO32- + H2O = SO42- + 2Н+
2MnO4- + 4H2O + SO32- + 3H2O = 2MnO2 + 8OН- + 3SO42- + 6Н+
Решая алгебраическое уравнение принимаем во внимание тот факт, что после реакции 6Н+ и 6ОН- образуют 6H2O.
2MnO4- + H2O + SO32- = 2MnO2 + 2OН- + 3SO42-
Перенося коэффициенты в молекулярное уравнение получают:
2КMnO4 + 3К2SO3 + H2O = 2MnO2 + 3К2SO4 + 2KOH
3. Восстановление перманганата калия в щелочной среде протекает до К2MnO4:
КMnO4 + К2SO3 + KOH → К2MnO4 + К2SO4 + H2O
Используя тот же подход для нахождения стехиметрических коэффициентов запишем
 2 MnO4- + е- = MnO42-
2 MnO4- + е- = MnO42-
1 SO32- + 2ОН- -2е = SO42- + H2O
2MnO4- + SO32- + 2ОН- = 2MnO42- + SO42- + H2O
2КMnO4 + К2SO3 + 2КОН = 2 К2MnO4 + К2SO4 + H2O
Электродный потенциал
Одним из центральных понятий в электрохимии является электродный потенциал, который связан с возникновением двойного электрического слоя на границе металл раствор.
Рассмотрим механизм возникновения электродного потенциала на примере ионно-металлического электрода, который представляет собой металлическую пластину, погруженную в полярную жидкость.
Как известно, в кристаллической решетке металлов находятся как атомы, так и ионы, связанные подвижным равновесием:
 Ме Меn+ + ne-
Ме Меn+ + ne-
где Ме – атом металла, Меn+ - ион металла, n – заряд иона, e- - электрон.
Под действием полярных молекул воды ионы поверхностного слоя металла гидратируются и переходят в раствор, заряжая его положительно, а избыток электронов на металле создают отрицательный заряд. Появление отрицательного заряда на электроде препятствует выходу катионов в раствор, часть же катионов из раствора, взаимодействуя с электронами, входят в узлы кристаллической решетки металла, которую они покинули. При достижении равенства скоростей выхода катионов в раствор и их вхождением в металл устанавливается динамическое равновесие.
 Ме + aq Меn+ · aq + ne- (1)
Ме + aq Меn+ · aq + ne- (1)
где aq – молекулы воды.
Результатом установившегося динамического равновесия является возникновение двойного электрического слоя (рис. 1), который напоминает плоский конденсатор, одна из обкладок которого представлена поверхностью металла, а другая – слоем ионов, находящихся в растворе.
Ме раствор
Рис. 1 Двойной электрический слой на границе раздела фаз
металл – раствор
Однако ионный слой не весь сосредоточен у поверхности металла, а вследствие теплого движения частично размыт в растворе. На границе раздела фаз металл – раствор (как и в случае между обкладками конденсатора) возникает разность электростатических потенциалов, которую называют скачком потенциала или электродным потенциалом.
Аналогичный процесс можно наблюдать и при погружении металла в водный раствор собственной соли. Здесь могут наблюдаться три случая:
1. Вследствие увеличения концентрации катионов в растворе равновесие (1) будет смещено в сторону входа катионов в узлы кристаллической решетки, поэтому отрицательный заряд электрода в растворе собственной соли будет меньше, чем в чистой воде.
2. Изменяя концентрацию соли в растворе, можно добиться того, что образование двойного электрического слоя не произойдет.
3. Малоактивные металлы: медь, серебро, золото, платина и другие характеризуются наличием прочной металлической решетки (высокой энергией связи катиона с электроном). В данном случае окисление металла происходит с трудом, в то время как катионы из раствора активно осаждаются на поверхность металла. Электрод в этом случае заряжается положительно, а раствор отрицательно, из-за избытка оставшихся в нем анионов.
Таким образом, строение двойного электрического слоя, а следовательно, и электродный потенциал зависят от металла, который используют в качестве электрода, концентрации катионов металла в растворе, оказывающей влияние на равновесие (1), и температуры, которая влияет на Кр.
Зависимость электродного потенциала от концентрации катионов в растворе и температуры описывается уравнением:
 (2)
(2)
где n – число е- участвующих в окислительно-восстановительной реакции, F – число Фарадея, R – универсальная газовая постоянная, a(ax), а(red) – активности, соответственно, окисленной и восстановительной формы. Если рассматривать потенциал металла в растворе его собственной соли, то при Р = 101,3 кПа и Т = 298 К активность чистого металла постоянна и принята равной единице, следовательно а(red) = a(Me) = 1. В этом случае выражение (2) упрощается:
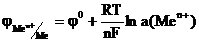 (3)
(3)
В разбавленном растворе вместо активностей можно подставить концентрации. Уравнение (2) носит название уравнения Нернста, которое характеризует электродный потенциал в условиях отличных от стандартных. В данном уравнении φ0 – стандартный электродный потенциал. Стандартным электродным потенциалом считают потенциал, возникающий при погружении металлического электрода в раствор собственной соли при стандартных условиях (Т= 298, концентрация катионов металла – 1 моль · л-1) и измеренный относительно водородного электрода. Если в уравнении (2) подставить значения соответствующих констант R, T и F, то с учетом перехода от ln к lg получим:




 2 MnO4- + 8Н+ + 5е- = Mn2+ + 4H2O
2 MnO4- + 8Н+ + 5е- = Mn2+ + 4H2O  2 MnO4- + 2H2O = MnO2 + 4OH-
2 MnO4- + 2H2O = MnO2 + 4OH- 
 2 MnO4- + е- = MnO42-
2 MnO4- + е- = MnO42- 
 Ме Меn+ + ne-
Ме Меn+ + ne- Ме + aq Меn+ · aq + ne- (1)
Ме + aq Меn+ · aq + ne- (1)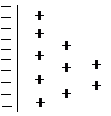
 (2)
(2)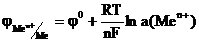 (3)
(3)



