

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...
Топ:
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного хозяйства...
Устройство и оснащение процедурного кабинета: Решающая роль в обеспечении правильного лечения пациентов отводится процедурной медсестре...
Комплексной системы оценки состояния охраны труда на производственном объекте (КСОТ-П): Цели и задачи Комплексной системы оценки состояния охраны труда и определению факторов рисков по охране труда...
Интересное:
Финансовый рынок и его значение в управлении денежными потоками на современном этапе: любому предприятию для расширения производства и увеличения прибыли нужны...
Берегоукрепление оползневых склонов: На прибрежных склонах основной причиной развития оползневых процессов является подмыв водами рек естественных склонов...
Мероприятия для защиты от морозного пучения грунтов: Инженерная защита от морозного (криогенного) пучения грунтов необходима для легких малоэтажных зданий и других сооружений...
Дисциплины:
|
из
5.00
|
Заказать работу |
Вапиров В.В., Ханина Е.Я., Волкова Т.Я.
Основы электрохимии
Учебное пособие для студентов
инженерно-технических специальностей университетов
Окислительно-восстановительные реакции
Степень окисления
Каждый элемент в химическом соединении характеризуется определенной степенью окисления. Это связано с тем, что электроны, образующие химическую связь, могут быть по-разному распределены между элементами. Если химическая связь образована одинаковыми атомами, валентные электроны являются в равной степени общими и ни один из элементов не обладает эффективным электрическим зарядом. В ковалентной связи между различными атомами электроны смещены к более электроотрицательному элементу, в результате чего последний приобретает некоторую долю отрицательного заряда, а элемент, от которого смещены электроны – такую же долю положительного. В соединениях с ионной связью происходит почти полная передача электронов с образованием ионов. Для характеристики состояния элемента в молекуле и введено понятие степени окисления.
Степень окисления – условный электрический заряд, который может получить атом, если бы все электроны, образующие с ним химическую связь, были бы полностью смещены к более электроотрицательному элементу.
Обращает на себя внимание то, что степень окисления – величина формальная. Так, например, в молекуле HI ни атом водорода, ни атом йода не обладают целочисленными положительными или отрицательными зарядами, однако степень окисления водорода и йода в HI равны соответственно +1 и –1. Иными словами, степень окисления определяют исходя из предположения, что все связи в молекуле ионные и молекула состоит из ионов.
Не отражая истинного эффективного заряда атома в молекуле, степень окисления не всегда совпадает и с валентностью элемента. В молекуле муравьиной кислоты углерод является четырехвалентным, однако проявляет степень окисления +2.
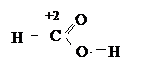 |
В результате многих химических реакций распределение электронов у одного и того же элемента, входящего в состав исходных веществ и продуктов реакции, может принципиально отличаться. При этом, несмотря на формальность, степень окисления отражает изменение электронного окружения элемента.
Химические реакции, в результате которых изменяется степень окисления элементов, называются окислительно-восстановительными.
В окислительно-восстановительной реакции один из элементов теряет электроны (окисляется), а другой их приобретает (восстанавливается). Однако не следует понимать, что при этом всегда происходит полная передача электронов от одного атома к другому. При окислении цинка кислородом
2Zn + O2 = 2ZnO
цинк только частично передает валентные электроны атому кислорода, но при этом меняет степень окисления от 0 до +2. При химическом взаимодействии натрия с хлором
2Na + Cl2 = 2NaCl
происходит почти полный перенос электрона от натрия к хлору и степени окисления элементов в молекуле NaCl совпадают с зарядами ионов.
При окислении элемента его степень окисления всегда увеличивается, а при восстановлении – уменьшается.
Элемент, восстанавливающийся в результате реакции, выступает в роли окислителя, а окисляющийся – в роли восстановителя. Процессы окисления и восстановления между собой тесно взаимосвязаны и один не возможен без другого.
В роли восстановителей в химической реакции могут выступать вещества, которые содержат элементы, способные отдавать электроны (окисляться), повышая при этом свою степень окисления. К типичным восстановителям относятся элементы главных подгрупп I и II группы периодической системы Д.И. Менделеева, водород и вещества, содержащие в своем составе атомы в состоянии низшей степени окисления – сероводород, аммиак, а также ионы, хлорид-анион, иодид-анион и т.д.
Роль окислителя могут выполнять вещества, содержащие элементы в высшей степени окисления, так как они способны только к восстановлению. К ним относятся азотная кислота, селеновая кислота, концентрированная серная кислота, бихромат калия и т.д. В роли окислителя могут выступать и элементы, способные к расширению своего электронного окружения (галогены, кислород, азот).
Вещества, образованные элементами в промежуточных степенях окисления, в зависимости от условий, могут выполнять функцию, как окислителя, так и восстановителя.
Межмолекулярные реакции
Атомы, выполняющие функцию донора и акцептора электронов, находятся в различных веществах.
|
|
 |
|
Zn + Cu2+ = Zn2+ + Cu
Метод электронного баланса
Рассмотрим применение метода электронного баланса на примере окисления сульфата железа пермангатом калия. Для расстановки коэффициентов поступают следующим образом.
1. Записывают схему окислительно-восстановительной реакции и определяют элементы, изменившие степень окисления.
|
|
|
|
KMnO4 + FeSO4 + H2SO4 → MnO4 + Fe2(SO4)3 + K2 SO4 + H2O
2.
|
|
окислитель Mn + 5e- → Mn восстановление
|
|
восстановитель 2Fe - 2 e- → 2Fe окисление
В окислительно-восстановительной реакции не образуется свободных электронов, поэтому число отдаваемых и приобретаемых электронов должно быть сбалансировано. Общее число перемещающихся электронов находят по правилу наименьшего общего кратного (НОК), а коэффициенты в полуреакциях окисления и восстановления делением НОК на количество приобретенных и отданных электронов.
Таким образом, уравнения полуреакций принимают вид
|
|

 полуреакция окисления 2 Mn + 5e- → Mn
полуреакция окисления 2 Mn + 5e- → Mn
|
|
полуреакция восстановления 5 2Fe - 2 e- → 2Fe
Складывая два уравнения с учетом найденных коэффициентов и производя его алгебраическое решение, получают краткое ионное уравнение:
|
|
|
|
2Mn + 10Fe → 2Mn + 10Fe
Коэффициенты из краткого ионного уравнения переносят в полное молекулярное, а затем подбором подводят баланс в левой и правой части уравнения.
2KMnO4 + 10FeSO4 + 8H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O
Электродный потенциал
Одним из центральных понятий в электрохимии является электродный потенциал, который связан с возникновением двойного электрического слоя на границе металл раствор.
Рассмотрим механизм возникновения электродного потенциала на примере ионно-металлического электрода, который представляет собой металлическую пластину, погруженную в полярную жидкость.
Как известно, в кристаллической решетке металлов находятся как атомы, так и ионы, связанные подвижным равновесием:
 Ме Меn+ + ne-
Ме Меn+ + ne-
где Ме – атом металла, Меn+ - ион металла, n – заряд иона, e- - электрон.
Под действием полярных молекул воды ионы поверхностного слоя металла гидратируются и переходят в раствор, заряжая его положительно, а избыток электронов на металле создают отрицательный заряд. Появление отрицательного заряда на электроде препятствует выходу катионов в раствор, часть же катионов из раствора, взаимодействуя с электронами, входят в узлы кристаллической решетки металла, которую они покинули. При достижении равенства скоростей выхода катионов в раствор и их вхождением в металл устанавливается динамическое равновесие.
 Ме + aq Меn+ · aq + ne- (1)
Ме + aq Меn+ · aq + ne- (1)
где aq – молекулы воды.
Результатом установившегося динамического равновесия является возникновение двойного электрического слоя (рис. 1), который напоминает плоский конденсатор, одна из обкладок которого представлена поверхностью металла, а другая – слоем ионов, находящихся в растворе.
 |
Ме раствор
Рис. 1 Двойной электрический слой на границе раздела фаз
металл – раствор
Однако ионный слой не весь сосредоточен у поверхности металла, а вследствие теплого движения частично размыт в растворе. На границе раздела фаз металл – раствор (как и в случае между обкладками конденсатора) возникает разность электростатических потенциалов, которую называют скачком потенциала или электродным потенциалом.
Аналогичный процесс можно наблюдать и при погружении металла в водный раствор собственной соли. Здесь могут наблюдаться три случая:
1. Вследствие увеличения концентрации катионов в растворе равновесие (1) будет смещено в сторону входа катионов в узлы кристаллической решетки, поэтому отрицательный заряд электрода в растворе собственной соли будет меньше, чем в чистой воде.
2. Изменяя концентрацию соли в растворе, можно добиться того, что образование двойного электрического слоя не произойдет.
3. Малоактивные металлы: медь, серебро, золото, платина и другие характеризуются наличием прочной металлической решетки (высокой энергией связи катиона с электроном). В данном случае окисление металла происходит с трудом, в то время как катионы из раствора активно осаждаются на поверхность металла. Электрод в этом случае заряжается положительно, а раствор отрицательно, из-за избытка оставшихся в нем анионов.
Таким образом, строение двойного электрического слоя, а следовательно, и электродный потенциал зависят от металла, который используют в качестве электрода, концентрации катионов металла в растворе, оказывающей влияние на равновесие (1), и температуры, которая влияет на Кр.
Зависимость электродного потенциала от концентрации катионов в растворе и температуры описывается уравнением:
 (2)
(2)
где n – число е- участвующих в окислительно-восстановительной реакции, F – число Фарадея, R – универсальная газовая постоянная, a(ax), а(red) – активности, соответственно, окисленной и восстановительной формы. Если рассматривать потенциал металла в растворе его собственной соли, то при Р = 101,3 кПа и Т = 298 К активность чистого металла постоянна и принята равной единице, следовательно а(red) = a(Me) = 1. В этом случае выражение (2) упрощается:
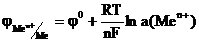 (3)
(3)
В разбавленном растворе вместо активностей можно подставить концентрации. Уравнение (2) носит название уравнения Нернста, которое характеризует электродный потенциал в условиях отличных от стандартных. В данном уравнении φ0 – стандартный электродный потенциал. Стандартным электродным потенциалом считают потенциал, возникающий при погружении металлического электрода в раствор собственной соли при стандартных условиях (Т= 298, концентрация катионов металла – 1 моль · л-1) и измеренный относительно водородного электрода. Если в уравнении (2) подставить значения соответствующих констант R, T и F, то с учетом перехода от ln к lg получим:

Рис. 2. Строение водородного электрода
Между поверхностным слоем водорода на платине и раствором устанавливается равновесие
 Н+ + е- Н
Н+ + е- Н
и возникает разность потенциалов, которая, как указано выше, принята равной нулю.
Для измерения величины стандартного электродного потенциала металлического электрода, данный электрод соединяют с водородным электродом проводником первого рода. При замыкании электрической цепи вследствие разности электродных потенциалов начнется движение электронов от электрода с меньшим потенциалом (обладающие избытком электронов) к электроду с большим потенциалом (обладающим меньшим количеством электронов). Так, если в качестве измеряемого электрода выступает цинк, то движение электронов будет направлено от цинка к платине. Уменьшение электронов на цинковой пластине будет смещать равновесие в сторону выхода катионов цинка в раствор, а следовательно на цинковом электроде будет протекать процесс окисления.
Zn0 → Zn2+ + 2e
На водородном электроде катионы Н+ принимают электроны и восстанавливаются.
2Н+ + е → Н2
Принято считать электрод, на котором протекает процесс окисления – анодом, а на котором процесс восстановления – катодом.
Зная величину ЭДС, измеренную в такой системе, можно легко вычислить потенциал электрода (метод измерения ЭДС разобран в разделе 3).
Так как в рассматриваемом процессе катодом является водородный электрод, а 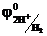 = 0
= 0
- φА = ЭДС
Если потенциал измеряемого электрода больше водородного, то движение электронов будет направлено от платины к металлу и величина потенциала электрода будет положительной.
Гальванический элемент
Гальванический элемент – это устройство, в котором химическая энергия окислительно-восстановительной реакции непосредственно преобразуется в электрический ток. Гальванический элемент состоит из двух электродов, соединенных металлическим проводником. Работа гальванических элементов основана на пространственном разделении процессов окисления и восстановления.
Например, если из окислительно-восстановительных систем Zn2+/Zn и Cu2+/Cu составить электрохимическую цепь (цинковую и медную пластинки поместить соответственно в растворы ZnSO4 и CuSO4, разделенные диафрагмой), то получим гальванический элемент Даниэля-Якоби (рис. 3).
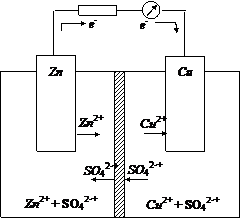 |
Рис. 3. Схема гальванического элемента Даниэля-Якоби

 На границе раздела фаз металл – раствор возникает двойной электрический слой и устанавливаются равновесные электродные потенциалы, характеризующие равновесие для цинкового электрода
На границе раздела фаз металл – раствор возникает двойной электрический слой и устанавливаются равновесные электродные потенциалы, характеризующие равновесие для цинкового электрода
Zn Zn2+ + 2e и для медного электрода Cu Cu2+ + 2e.
Для внешней цепи этой электрохимической системы цинковый электрод станет отрицательным полюсом ( 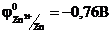 ), а медный – положительным (
), а медный – положительным ( 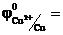 0,34 В). Если замкнуть внешнюю цепь, то вследствие разности потенциалов цинка и меди, часть электронов с цинковой пластины перейдет на медную. Это нарушит равновесие в двойном слое у цинка (его потенциал повысится) и у меди (ее потенциал понизится). Изменение потенциала связано с изменением концентрации катионов металла у электродов. Обе системы Zn2+/Zn и Сu2+/Cu снова стремятся к равновесию за счет окисления цинка (Zn → Zn2++ 2e) и восстановление меди (Сu2++2е-→ Сu). Этими процессами сохраняется разность потенциалов пластинок, обеспечивающая электрический ток в цепи. Во внутреннем участке цепи анионы SO42- перемещаются от медного электрода, где их избыток к цинковому, а катионы Zn2+ и Сu2+ - в обратном направлении, обеспечивая протекание ионного тока в растворе. Суммарный процесс выражается тем же уравнением реакции, что и при непосредственном взаимодействии окислительно-восстановительных систем Zn2+/Zn и Сu2+/Cu.
0,34 В). Если замкнуть внешнюю цепь, то вследствие разности потенциалов цинка и меди, часть электронов с цинковой пластины перейдет на медную. Это нарушит равновесие в двойном слое у цинка (его потенциал повысится) и у меди (ее потенциал понизится). Изменение потенциала связано с изменением концентрации катионов металла у электродов. Обе системы Zn2+/Zn и Сu2+/Cu снова стремятся к равновесию за счет окисления цинка (Zn → Zn2++ 2e) и восстановление меди (Сu2++2е-→ Сu). Этими процессами сохраняется разность потенциалов пластинок, обеспечивающая электрический ток в цепи. Во внутреннем участке цепи анионы SO42- перемещаются от медного электрода, где их избыток к цинковому, а катионы Zn2+ и Сu2+ - в обратном направлении, обеспечивая протекание ионного тока в растворе. Суммарный процесс выражается тем же уравнением реакции, что и при непосредственном взаимодействии окислительно-восстановительных систем Zn2+/Zn и Сu2+/Cu.
Zn + Сu2+ → Cu + Zn2+
Электрический ток в гальваническом элементе возникает за счет окислительно-восстановительной реакции, протекающей так, что окислительный и восстановительный процессы оказываются разделенными пространственно: на положительном электроде (катоде) происходит процесс восстановления, а на отрицательном (аноде) – процесс окисления.
Необходимое условие работы гальванического элемента – разность потенциалов электродов. Наибольшего значения работа гальванического элемента достигает при изотермическом обратимом проведении реакции. В этом случае разность потенциалов максимальна и называется электродвижущей силой гальванического элемента (ЭДС). При схематической записи гальванического элемента границу раздела между металлом и раствором обозначают одной вертикальной чертой, а границу раздела между растворами – двумя чертами. Схема элемента Даниэля-Якоби, например, записывается в виде:
Zn Zn2+ Cu2+ Cu
ЭДС элемента (Е) равна разности электродных потенциалов Cu и Zn. Так как ЭДС величина положительная, то для ее расчета от потенциала катода вычитают потенциал анода (Е = jCu2+/Cu - jZn2+/Zn = 1,1 В).
Измерить ЭДС элемента можно скомпенсировав ее от внешнего источника (противоположно направленной ЭДС) – компенсационным методом (рис. 4). Перемещая подвижный контакт К, можно подобрать такое положение на потенциометре, при котором ток в цепи будет отсутствовать и в системе у электродов достигается равновесие, т.е. создаются условия, необходимые для протекания обратимых полуреакций и электрическая работа элемента будет максимальна. Следовательно, падение напряжения на участке АК и есть ЭДС гальванического элемента.
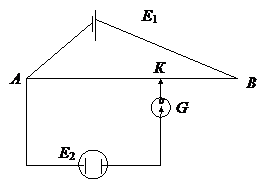 |
Рис. 4. Схема компенсационного измерения ЭДС
Е1 – внешний источник
Е2 – гальванический элемент, АВ – потенциометр
К – подвижный контакт, Г – гальванометр.
Более простой и менее точный метод измерения ЭДС заключается в прямом измерении напряжения на клеммах гальванического элемента вольтметром, имеющим высокое входное сопротивление.
В рассмотренном элементе Даниэля-Якоби материал электрода сам участвует в окислительно-восстановительных реакциях. Такие элементы называются элементами с активным электродом. В окислительно-восстановительных гальванических элементах синертными электродами металл электрода служит лишь передатчиком электронов. Например,
Pt Sn2+, Sn4+ Fe3+, Fe2+ Pt

 Один полуэлемент (электрод) представляет собой раствор, состоящий из смеси солей Sn2+ и Sn4+, в который погружен платиновый электрод. На поверхности электрода устанавливается равновесие
Один полуэлемент (электрод) представляет собой раствор, состоящий из смеси солей Sn2+ и Sn4+, в который погружен платиновый электрод. На поверхности электрода устанавливается равновесие
Sn2+ Sn4++ 2е, которое определяет потенциал электрода (в стандартных условиях) 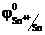 = 0,15 В). В другом полуэлементе платиновый электрод погружается в раствор смеси солей Fe3+ и Fe2+ (например, FeCl3 и FeCl2). На его поверхности устанавливается равновесие Fe2+ Fe3+ + е, характеризуемое в стандартных условиях потенциалом
= 0,15 В). В другом полуэлементе платиновый электрод погружается в раствор смеси солей Fe3+ и Fe2+ (например, FeCl3 и FeCl2). На его поверхности устанавливается равновесие Fe2+ Fe3+ + е, характеризуемое в стандартных условиях потенциалом  = 0,77 В. Следовательно, при замыкании внешней цепи, состоящей из этих двух полуэлементов, один из них будет выступать анодом (Pt/Sn4+, Sn2+), а второй – катодом (Fe3+, Fe2+/Pt) и Е = 0,77 В – 0,15 = 0,62 В.
= 0,77 В. Следовательно, при замыкании внешней цепи, состоящей из этих двух полуэлементов, один из них будет выступать анодом (Pt/Sn4+, Sn2+), а второй – катодом (Fe3+, Fe2+/Pt) и Е = 0,77 В – 0,15 = 0,62 В.
Необходимую для работы гальванического элемента разность потенциалов можно создать, используя одинаковые электроды и один и тот же раствор, но разной концентрации разной концентрации. В этом случае гальванический элемент называется концентрационным и работает он за счет выравнивания концентраций растворов.
Zn Zn2+ Zn2+ Zn
а| = 0,1моль/л а|| = 0,001моль/л
Е = jК - jА = 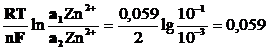
Электролиз
Электролизом называется окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного тока через раствор или расплав электролита. При электролизе происходит превращение электрической энергии в химическую. Процессы окисления и восстановления и в этом случае пространственно разделены: они протекают на разных электродах. На отрицательном электроде (катоде) происходит восстановление катионов, а на положительном электроде (аноде) – окисление анионов. Характер протекания электродных процессов при электролизе зависит от многих факторов: состава электролитов, материала электрода, режима электролиза (i, Т).
Различают электролиз расплавов и растворов электролитов. В качестве примера рассмотрим электролиз расплава бромида натрия. В расплаве соли бромида натрия NaBr существуют ионы Na+ и Br-. При подведении напряжения к электродам через расплав начнет протекать электрический ток.
Катионы Na+ подходят к катоду и восстанавливаются до металлического натрия, за счет электронов, поступающих к электроду от внешнего источника Na+ + е = Na. К аноду подходят бромид-ионы Br- и окисляются до Br2, отдавая электроны во внешнюю цепь 2Br- - 2е = Br2.
Общая реакция электрохимического разложения вещества представляет собой сумму двух электродных реакций и для бромида натрия она выразится уравнением:
|
 2Na+ + 2Br- 2Na + Br2
2Na+ + 2Br- 2Na + Br2
Электролиз водных растворов электролитов осложняется участием в электродных реакциях молекул воды, способных восстанавливаться на катоде (2Н2О + 2е = Н2 + 2ОН-,  = -0,41 В) и окисляться на аноде (2Н2О - 4е = О2 + 4Н+,
= -0,41 В) и окисляться на аноде (2Н2О - 4е = О2 + 4Н+,  = 0,814 В). На электродах возможно и разрядка ионов Н+ и ОН-, относительная концентрация которых определяется средой.
= 0,814 В). На электродах возможно и разрядка ионов Н+ и ОН-, относительная концентрация которых определяется средой.
Из нескольких возможных параллельных электродных процессов будет протекать тот, осуществление которого требует меньшей затраты энергии. Критериями, определяющими преимущества того или иного электрохимического процесса, служат величины электродных потенциалов соответствующих равновесных систем.
В общем случае на аноде легче окисляются атомы, молекулы или ионы с наименьшим электродным потенциалом, а на катоде восстанавливаются те ионы, молекулы, атомы, потенциалы которых наиболее высокие.
Например, при электролизе нейтрального водного раствора NaI на катоде будут восстанавливаться молекулы воды, так как  = -0,41 В, а
= -0,41 В, а  = -2,71В. Окисляются же на аноде ионы I-, так как
= -2,71В. Окисляются же на аноде ионы I-, так как 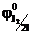 = 0,536 В, а
= 0,536 В, а  = 0,814 В. Схематически это можно записать следующим образом:
= 0,814 В. Схематически это можно записать следующим образом:
на катоде : в растворе : на аноде
← Na+ + I- →
← H2O →
2 Н2О + 2е- = Н2↑ + 2ОН 2I - 2е = → J2
|
 2NaI + 2 Н2О Н2↑ + I2 + 2NaОН
2NaI + 2 Н2О Н2↑ + I2 + 2NaОН
Для качественного предсказания результатов электролиза водных растворов электролитов можно руководствоваться следующими практическими правилами:
Для процессов на катоде:
1. В первую очередь восстанавливаются катионы металлов, имеющие электродный потенциал положительнее водородного (от Cu2+ до Au3+).
2. Катионы металлов, электродные потенциалы которых отрицательнее потенциала алюминия включительно, не восстанавливаются, на катоде идет восстановление молекул воды или ионов Н+.
3. При электролизе солей металлов, электродные потенциалы которых находятся между потенциалами алюминия и водорода, на катоде выделяются совместно как металлы, так и водород.
Если электролит содержит катионы различных металлов, то при электролизе восстановление их на катоде протекает в порядке уменьшения стандартного электродного потенциала соответствующего металла. Так из смеси Sn2+, Cu2+, Cr3+сначала будут восстанавливаться катионы меди, 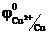 = 0,34 В, затем катионы олова
= 0,34 В, затем катионы олова 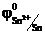 = -0,136 В и, наконец, катионы хрома
= -0,136 В и, наконец, катионы хрома  = -0,744 В.
= -0,744 В.
Для процессов на аноде:
Характер окислительных процессов зависит от материала электрода. Различаются нерастворимые (инертные) электроды и растворимые (активные) электроды. Инертные электроды изготовляются обычно из платины, графита, иридия. В процессе электролиза они служат лишь для передачи электронов во внешнюю цепь. При использовании инертных электродов:
1. в первую очередь окисляются анионы бескислородных кислот в порядке возрастания их φ (S-2, I-, Вr-, Cl-);
2. при электролизе водных растворов, содержащих анионы кислородосодержащих кислот (CO32-, NO3-, SO42-, PO43-), на аноде окисляются молекулы воды.
3. в щелочных растворах окисляются гидроксид-ионы:
4OH- - 4e → O2 ↑ + 2H2O
При использовании растворимых анодов (из меди, цинка, никеля, серебра и т.д.) анодному окислению будет подвергаться сам материал анода:
Ме → Men+ + ne-
анод уходят уходят
в раствор во внешнюю цепь


 Так, например, при электролизе раствора сульфата меди с медным анодом происходит его растворение, поскольку потенциал системы
Так, например, при электролизе раствора сульфата меди с медным анодом происходит его растворение, поскольку потенциал системы
Cu Cu2+ + 2e-(0,34 В) меньше потенциалов других возможных анодных процессов: 2SO42- - 2e S2O82- (2,01 В) и 2Н2О – 4е О2 + 4Н+ (1,23 В при рН < 7).
Как будет показано ниже, указанные правила не являются догмой, а руководством к действию и зачастую процессы на аноде и катоде осложняются, так как на практике электрохимические процессы проводят в условиях отличных от стандартных.
Рассмотрим несколько примеров электролиза водных растворов:
1. Как протекает электролиз раствора сульфата натрия с инертными электродами.
Схематически процесс можно представить так:

 Катод (Pt) р-р Na2SO4 Анод (Pt)
Катод (Pt) р-р Na2SO4 Анод (Pt)
← 2Na+ + SO42- →
← Н2О →
4Н2О + 4е- = 2Н2↑ + 4ОН- 2Н2О - 4е- = О2 + 4Н+
Из вышеприведенной схемы видно, что если катодное и анодное пространство будут разделены перегородкой, то в прикатодном пространстве будут накапливаться катионы Na+ гидроксид-анионы, образующиеся в результате восстановления воды. При упаривании воды из этого раствора может быть выделен NaOH. Около анода среда становится кислой, вследствие окисления воды, в результате чего в этой области накапливается серная кислота.
Если катодное и анодное пространства не разделены перегородкой, то ионы Н+ и ОН- образуют воду.
4Н+ + 4ОН- = 4Н2О
 Электролиз водного раствора Na2SО4 в конечном итоге сводится к электролизу воды, которая окисляется на аноде и восстанавливается на катоде.
Электролиз водного раствора Na2SО4 в конечном итоге сводится к электролизу воды, которая окисляется на аноде и восстанавливается на катоде.
2Н2О 2Н2↑ + О↑2
2. Как протекает электролиз водного раствора сульфата меди с применением электродов из меди.
Схематически процесс изобразится следующим образом:
 |
 Катод (Cu) р-р CuSO4 Анод (Cu)
Катод (Cu) р-р CuSO4 Анод (Cu)
← Cu2+ + SO42- →
← Н2О →
Cu2+ + 2е = Cu Cu - 2е = Cu2+
Медный анод растворяется, ионы меди Cu2+ перемещаются к катоду и там восстанавливаются до свободного металла. При равных площадях электродов количество соли в растворе остается неизменным: сколько меди растворяется на аноде, столько же ее восстанавливается на катоде.
Законы электролиза
Количественная характеристика электролиза выражается двумя законами Фарадея:
1. Масса вещества, выделяющегося на электродах, прямо пропорциональна количеству прошедшего через электролит электричества
m = КэQ = КэI · t , где
m – масса выделившегося вещества, Q – количество электричества (Кл), I – сила тока (А), t – время (с), Кэ – электрохимический эквивалент вещества, выделившегося на электродах при протекании тока силой в 1 А в течение 1 сек (или количеством электричества в 1 Кл).
2. При электролизе различных электролитов равные количества электричества выделяют на электродах массы веществ, пропорциональные молярным массам их эквивалентов.
Кэ =  m =
m =  , где
, где
F – число Фарадея, Мэ – молярная масса эквивалента. Если I · t = F = 96500 Кл, то m = Мэ . Для химического превращения молярной массы эквивалента любого вещества необходимо пропустить через электролит количество электричества, равное числу Фарадея (96500 Кл).
На законах Фарадея основан один из точных способов измерения количества электричества, прошедшего в системе. Для этого служат приборы, называемые кулонометрами.
Вследствие параллельных побочных процессов масса вещества, получаемого при электролизе, оказывается часто меньше той, которая соответствует количеству прошедшего электричества. Отношение массы реально выделенного вещества на электроде к теоретической и умноженное на 100% называют выходом по току:
ηэ = 
Химические источники тока
Любой гальванический элемент может быть источником постоянного тока. Но лишь немногие из них удовлетворяют техническим требованиям, делающим возможным их использование.
В основе некоторых современных сухих батарей, питающих слуховые аппараты, карманные фонари, переносную аппаратуру связи, лежит схема элемента Лекланше, предложенная в 1876 г.:
Zn/NH4Cl/MnO2. Удобство такого портативного источника тока заключается в том, все его составные части представляют собой твердые или пастообразные вещества, упаковка которых предотвращает их попадание на окружающие предметы. Анодом сухого элемента служит его цинковая оболочка, а катодом – графитовый стержень, спрессованный в слой оксида марганца (IV) и углерода. В качестве электролита используется паста из хлорида цинка, хлорида амония и воды. На электродах сухого элемента протекают следующие полуреакции.
На аноде: Zn(тв) → Znag2+ + 2e-
На катоде: 2MnO2(тв) + 2NH4+ + 2e- → Mn2O3(тв) + 2NH3 + H2O
Суммарная реакция описывается уравнением:
Zn + 2MnO2 + 2NH4Cl → [Zn(NH3)2]Cl2 + Mn2O3 + H2O
Напряжение такого элемента – 1,5 В. Сухие элементы представляют собой первичные химические источники тока (или гальванический элемент одноразового действия). После разрядки сухой элемент использовать нельзя и его приходится выбрасывать.
Вторичным источником тока являются аккумуляторы. Работоспособность разряженного аккумулятора можно восстановить, зарядив его, т.е. пропустив через него в обратном направлении ток от внешнего источника (электролиз). При зарядке аккумулятор работает как электролизер, а при разрядке – как гальванический элемент. Процессы заряда аккумуляторов осуществляются многократно. В таблице 3 приведены характеристики наиболее распространенных гальванических элементов.
Наиболее распространенным является свинцовый (кислотный) аккумулятор. Свинцовый аккумулятор представляет собой систему свинцовых перфорированных пластин, заполненных губчатым свинцом и являющихся катодом, а положительным электродом служит оксид свинца PbO2, впрессованный в свинцовую решетку. В качестве электролита используется 30%-ный раствор серной кислоты. Схема аккумулятора:
Pb ׀ H2SO4 ׀ PbO2
При погружении пластины в серную кислоту на их поверхности образуется труднорастворимая соль-сульфат свинца PbSO4. В этом состоянии электроды имеют одинаковый химический состав и окислительно-восстановительное взаимодействие невозможно, аккумулятор разряжен. Поэтому предварительно проводят зарядку аккумулятора, пропуская через него постоянный электрический ток от внешнего источника. Процессы, протекающие при зарядке подобны процессам при электролизе.
На катоде (-) происходит процесс восстановления.
Pb2+ + 2e- = Pb0 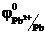 = -0,36 В
= -0,36 В
Этой реакции разряда соответствует электрохимическая реакция:
PbSO4 + 2H+ + 2e → Pb0 + H2SO4
На аноде (+) ионы Pb2+ окисляются.
Pb2+ - 2е → Pb+4 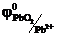
PbSO4 – 2е + SO42- → Pb(SO4)2
Образующаяся соль подвергается гидролизу
Pb(SO4)2 + 4H2О → Pb(ОН)4 + H2SO4
с последующим разложением Pb(ОН)4 = PbО2 + 2H2О, т.е. конечным результатом является образование оксида свинца (IV) - PbО2.
Таким образом, после зарядки один электрод аккумулятора представляет собой губчатый металлический свинец, а другой – оксид свинца (IV).
Общее химическое уравнение

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!