Протекание электрического тока через электрическую ванну приводит к сдвигу потенциалов от их равновесных значений, отвечающему определенной плотности тока, т.е. к поляризации электродов.
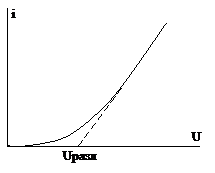 Рассмотрим электролиз 0,1М раствора HCl. Если к электродам приложить небольшую разность потенциалов от внешнего источника тока, а затем постепенно ее увеличивать, то можно зафиксировать изменение силы тока в цепи в зависимости от приложенного напряжения (рис. 6). Лишь при определенном напряжении (1,3 В) происходит резкое увеличение тока в цепи и одновременно начинается видимое разложение электролита.
Рассмотрим электролиз 0,1М раствора HCl. Если к электродам приложить небольшую разность потенциалов от внешнего источника тока, а затем постепенно ее увеличивать, то можно зафиксировать изменение силы тока в цепи в зависимости от приложенного напряжения (рис. 6). Лишь при определенном напряжении (1,3 В) происходит резкое увеличение тока в цепи и одновременно начинается видимое разложение электролита.
Рис. 6. Зависимость силы тока от напряжения при электролизе
При электролизе водного раствора серной кислоты это напряжение –1,7 В, а для раствора сульфата натрия –2,3 В. То есть каждому электролиту свойственно определенное минимальное напряжение, которое необходимо приложить к раствору, чтобы начался электролиз. Такое необходимое напряжение получило название «напряжение разложения» (Uразл.).
Это объясняется тем, что катодный и анодный процессы
2Н+ + 2е = Н2 (на катоде)
2Cl- - 2е = Cl2 (на аноде) для раствора НCl сопровождаются химической поляризацией электродов, обусловленной превращением катода в водородный электрод а анода в хлорный с соответствующими потенциалами (рис. 7).
Рис. 7. Поляризационные кривые, иллюстрирующие процессы при электролизе раствора HCl с платиновым электродом
В результате химической поляризации электродов возникает гальванический элемент, электродвижущая сила которого равна Епол = 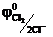 -
- 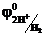 = 1,36 – 0,000 = 1,36 В и имеет направление противоположное внешней ЭДС. Возникновение обратной ЭДС при электролизе, называемой ЭДС поляризации, составляет сущность явления поляризации при электролизе. Поэтому электролиз возможен при условии компенсации ЭДС поляризации внешним напряжением. Часто реально напряжение разложения оказывается много больше ЭДС поляризации, так как необходимо скомпенсировать еще и водородное перенапряжение на катоде и хлорное перенапряжение на аноде, вызванные замедленностью реакции разряда.
= 1,36 – 0,000 = 1,36 В и имеет направление противоположное внешней ЭДС. Возникновение обратной ЭДС при электролизе, называемой ЭДС поляризации, составляет сущность явления поляризации при электролизе. Поэтому электролиз возможен при условии компенсации ЭДС поляризации внешним напряжением. Часто реально напряжение разложения оказывается много больше ЭДС поляризации, так как необходимо скомпенсировать еще и водородное перенапряжение на катоде и хлорное перенапряжение на аноде, вызванные замедленностью реакции разряда.
Таким образом, в общем случае напряжение, при котором будет происходить электролиз (напряжение разложения), складывается из ЭДС поляризации (Епол = φk – φА), анодного и катодного перенапряжения (ηA и ηk), омического падения напряжения на электролите (ΔUэл).
Uразл = Епол + ηа + ηк + ΔUэл
Перенапряжение для катодных реакций, в процессе которых выделяются металлы, обычно невелико. Так, для меди и цинка ηk достигает несколько десятков милливольт. Ртуть, серебро, олово, свинец выделяются из водных растворов солей почти без перенапряжения. Наибольшее перенапряжение достигается у металлов семейства железа, доходя до нескольких десятых долей вольта. Очень велико перенапряжение при выделении водорода (водородное перенапряжение). Оно очень сильно зависит от природы катода и состояния его поверхности. Эта зависимость отражена в константе «а» уравнения Тафеля (η = а + blgi). Постоянная «b» при 20˚С для всех металлов ≈ 0,12 В. В кислых растворах при i = I A/см2 величина «а» для разных металлов имеет следующие значения: платина – 0,1 В; железо – 0,7 В; медь – 0,87 В; олово – 1,2 В; цинк – 1,24 В; свинец – 1,56 В; ртуть – 1,47 В. Это делает возможным при электролизе водных растворов разряд ионов тех металлов (Ni, Cd, Cr, Zn и др., вплоть до Mn), потенциалы которых оказываются в соответствующих условиях более электроотрицательными, чем потенциал водородного электрода (рис. 8). Благодаря этому получили широкое распространение методы электроосаждения металлов: например, электролитическое хромирование, цинкование, никелирование, лужение. На ртутном катоде из нейтральных водных растворов удается восстановить даже натрий.
Протекание анодных реакций часто сопровождается выделением газов и для них характерно также высокое перенапряжение, особенно для кислорода ηО2 = 1,5 В. Из-за большого кислородного перенапряжения в случае электролиза раствора NaBr или HCl на платиновом аноде выделяются Br2(  = 1,06 В) и Cl2 (
= 1,06 В) и Cl2 ( 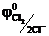 = 1,36 В), а не кислород, хотя в нейтральной и кислой средах соответственно равновесный потенциал кислородного электрода ниже, чем у брома и хлора (0,81 В и 1,23 В).
= 1,36 В), а не кислород, хотя в нейтральной и кислой средах соответственно равновесный потенциал кислородного электрода ниже, чем у брома и хлора (0,81 В и 1,23 В).
Рис. 8. Поляризационные кривые, иллюстрирующие процессы при электролизе водного раствора хлорида цинка с графитовыми электродами
Водородное и кислородное перенапряжение имеет большое прикладное значение и должно учитываться при электролизе водных растворов. Их роль в процессах очень различна. Она негативна, например, при промышленном получении кислорода и водорода электролитическим способом, так как перенапряжение связано с дополнительным расходом электроэнергии в этом случае и, позитивна при электролитическом получении металлических покрытий, при зарядке кислотных аккумуляторов и т.д.
Законы электролиза
Количественная характеристика электролиза выражается двумя законами Фарадея:
1. Масса вещества, выделяющегося на электродах, прямо пропорциональна количеству прошедшего через электролит электричества
m = КэQ = КэI · t , где
m – масса выделившегося вещества, Q – количество электричества (Кл), I – сила тока (А), t – время (с), Кэ – электрохимический эквивалент вещества, выделившегося на электродах при протекании тока силой в 1 А в течение 1 сек (или количеством электричества в 1 Кл).
2. При электролизе различных электролитов равные количества электричества выделяют на электродах массы веществ, пропорциональные молярным массам их эквивалентов.
Кэ =  m =
m =  , где
, где
F – число Фарадея, Мэ – молярная масса эквивалента. Если I · t = F = 96500 Кл, то m = Мэ . Для химического превращения молярной массы эквивалента любого вещества необходимо пропустить через электролит количество электричества, равное числу Фарадея (96500 Кл).
На законах Фарадея основан один из точных способов измерения количества электричества, прошедшего в системе. Для этого служат приборы, называемые кулонометрами.
Вследствие параллельных побочных процессов масса вещества, получаемого при электролизе, оказывается часто меньше той, которая соответствует количеству прошедшего электричества. Отношение массы реально выделенного вещества на электроде к теоретической и умноженное на 100% называют выходом по току:
ηэ = 
Химические источники тока
Любой гальванический элемент может быть источником постоянного тока. Но лишь немногие из них удовлетворяют техническим требованиям, делающим возможным их использование.
В основе некоторых современных сухих батарей, питающих слуховые аппараты, карманные фонари, переносную аппаратуру связи, лежит схема элемента Лекланше, предложенная в 1876 г.:
Zn/NH4Cl/MnO2. Удобство такого портативного источника тока заключается в том, все его составные части представляют собой твердые или пастообразные вещества, упаковка которых предотвращает их попадание на окружающие предметы. Анодом сухого элемента служит его цинковая оболочка, а катодом – графитовый стержень, спрессованный в слой оксида марганца (IV) и углерода. В качестве электролита используется паста из хлорида цинка, хлорида амония и воды. На электродах сухого элемента протекают следующие полуреакции.
На аноде: Zn(тв) → Znag2+ + 2e-
На катоде: 2MnO2(тв) + 2NH4+ + 2e- → Mn2O3(тв) + 2NH3 + H2O
Суммарная реакция описывается уравнением:
Zn + 2MnO2 + 2NH4Cl → [Zn(NH3)2]Cl2 + Mn2O3 + H2O
Напряжение такого элемента – 1,5 В. Сухие элементы представляют собой первичные химические источники тока (или гальванический элемент одноразового действия). После разрядки сухой элемент использовать нельзя и его приходится выбрасывать.
Вторичным источником тока являются аккумуляторы. Работоспособность разряженного аккумулятора можно восстановить, зарядив его, т.е. пропустив через него в обратном направлении ток от внешнего источника (электролиз). При зарядке аккумулятор работает как электролизер, а при разрядке – как гальванический элемент. Процессы заряда аккумуляторов осуществляются многократно. В таблице 3 приведены характеристики наиболее распространенных гальванических элементов.
Наиболее распространенным является свинцовый (кислотный) аккумулятор. Свинцовый аккумулятор представляет собой систему свинцовых перфорированных пластин, заполненных губчатым свинцом и являющихся катодом, а положительным электродом служит оксид свинца PbO2, впрессованный в свинцовую решетку. В качестве электролита используется 30%-ный раствор серной кислоты. Схема аккумулятора:
Pb ׀ H2SO4 ׀ PbO2
При погружении пластины в серную кислоту на их поверхности образуется труднорастворимая соль-сульфат свинца PbSO4. В этом состоянии электроды имеют одинаковый химический состав и окислительно-восстановительное взаимодействие невозможно, аккумулятор разряжен. Поэтому предварительно проводят зарядку аккумулятора, пропуская через него постоянный электрический ток от внешнего источника. Процессы, протекающие при зарядке подобны процессам при электролизе.
На катоде (-) происходит процесс восстановления.
Pb2+ + 2e- = Pb0 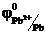 = -0,36 В
= -0,36 В
Этой реакции разряда соответствует электрохимическая реакция:
PbSO4 + 2H+ + 2e → Pb0 + H2SO4
На аноде (+) ионы Pb2+ окисляются.
Pb2+ - 2е → Pb+4 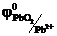
PbSO4 – 2е + SO42- → Pb(SO4)2
Образующаяся соль подвергается гидролизу
Pb(SO4)2 + 4H2О → Pb(ОН)4 + H2SO4
с последующим разложением Pb(ОН)4 = PbО2 + 2H2О, т.е. конечным результатом является образование оксида свинца (IV) - PbО2.
Таким образом, после зарядки один электрод аккумулятора представляет собой губчатый металлический свинец, а другой – оксид свинца (IV).
Общее химическое уравнение процесса зарядки:
PbSO4 + 2H2О → Pb + PbO2 + 2H2SO4
При работе аккумулятора (разрядке) процессы на электродах протекают в обратном направлении.
Окисление на аноде:
Pb – 2е + SO42-→ PbSO4
Восстановление на катоде:
PbO2 + 4Н+ + SO42- + 2е → PbSO4 + 2H2О
Суммарная реакция
PbO2 + Pb + 2H2SO4 2PbSO4 + 2H2О
В процессе зарядки концентрация кислоты увеличивается, а в процессе разрядки наоборот, уменьшается. Относительная плотность серной кислоты указывает насколько разряжен аккумулятор. ЭДС свинцового аккумулятора достигает 2,1 В.
Напряжение при заряде выше ЭДС и растет в течение заряда. В конце напряжение достигает значения, достаточного для электролиза воды, тогда начинается выделение водорода и кислорода, поэтому выделение пузырьков газа (кипение) служит признаком окончания заряда аккумулятора.
При разрядке аккумулятора его ЭДС и напряжение падают. Если напряжение упадет ниже 1,7 В, на электродах начинается образование пленки PbSO4 особой кристаллической структуры (так называемое сульфатирование), которая изолирует электроды от электролита. Вследствие этого недопустимо снижение напряжения до 1,7 В.
Свинцовый аккумулятор обладает высоким КПД (≈ 80%), высокой ЭДС, простотой и невысокой ценой. Недостатки – небольшая удельная энергия ≈ 20-30 Вт∙ч/кг и малый срок службы (от 2 до 5 лет).
Топливный элемент
Разновидностью гальванического элемента является топливный элемент, в котором химическая энергия окислительно-восстановительной реакции сгорания газообразного и жидкого топлива превращается непосредственно в электрическую. Особенность топливных элементов состоит в том, что топливо и окислитель подводятся по мере их расходования. Это обеспечивает непрерывность работы источника тока теоретически в течение сколь угодно длительного времени. Одновременно и также непрерывно выводятся продукты окисления.
В качестве окислителя в топливных элементах почти всегда используется или чистый кислород или кислород воздуха. В качестве топлива применяются водород, гидразин, метанол, водяной и генераторный газы. Наибольшие успехи достигнуты в разработке водородно-кислородного топливного элемента.
Рассмотрим работу такого топливного элемента, который представляет собой два электрода специальной конструкции, погруженные в раствор щелочи (КОН). К поверхности одного из них непрерывно подводится водород (топливо), а к другому окислитель (кислород).
При замыкании внешней цепи на аноде протекает реакция окисления водорода:
2Н2 + 4ОН- = 4Н2О + 4е
На катоде восстанавливается кислород:
О2 + 2Н2О + 4е- = 4ОН-
По внешней цепи электроны перемещаются от анода к катоду, а в растворе цепь замыкается движением ионов ОН- от катода к аноду. Суммарное уравнение реакции сводится к получению воды.
2Н2 + О2 = 2Н2О
Для эффективной работы топливного элемента используются катализаторы, которые наносят на электроды.
Таблица 3
Некоторые гальванические элементы, применяемые
в промышленности и на транспорте
| Название элемента
| Электрохимическая схема
| Электрохимические процессы
| ЭДС В
|
| у анода
| у катода
|
| Марганцево-магниевый
| Mg/MgBr2//MnO2/C
| Mg-2e-→Mg2+
| 2MnO2+H2O+2e→Mn2O3+2OH-
| 2,0
|
| Свинцово-
цинковый
| Zn/H2SO4//PbO2/Pb
| Zn-2e-→Zn2+
| PbO2+2e+4H+→PbO2+2H2O
| 2,5
|
| Серебряно-цинковый с оксидом серебра
| Zn/KOH//Ag2O/Ag
| Zn-2e→Zn2+
| Ag2O+H2O+2e-→2Ag+2
| 1,85
|
| Кислородно-цинковый
| Zn/NH4Cl//O2/C
| Zn-2e-→Zn2+
| O2+2H2O+4e-→ 4OH-
4OH-+4NH4+→4NH3+4H2O
| 1,4
|
| Свинцово-кадмиевый
| Cd/H2SO4//PbO2/Pb
| Cd-2e-→Cd2+
| PbO2+2e+4H+→Pb2++2H2O
| 2,2
|
Важнейшей проблемой топливного элемента является кинетика электродных процессов – даже при очень слабом токе напряжение на клеммах источника быстро падает, так как элемент сильно поляризуется. Только большая скорость реакции окисления и восстановления позволяет получить довольно высокий коэффициент использования топлива. Для снижения поляризации топливного элемента используются пористые электроды с сильно развитой поверхность, изготовленные из порошков металлов или угля, обладающие каталитическим действием. В качестве катализаторов электродов используются металлы платиновой группы, серебро, специально обработанные никель и кобальт (поэтому топливные элементы еще являются дорогостоящими). Скорость электродных процессов можно также увеличить путем увеличения температуры и давления.
Топливные элементы вырабатывают постоянный ток низкого напряжения (1-1, 1 В), обеспечивают довольно высокий КПД 70% (по сравнению с тепловыми машинами), работают бесшумно и не выделяют вредных продуктов. Топливные элементы использовались в космических кораблях «Джемини» и «Апполон».
Коррозия
Коррозией называется процесс самопроизвольного разрушения металлов под влиянием внешней среды.
Вред, причиняемый коррозией, весьма велик. По имеющимся данным, примерно треть получаемого металла выбывает из технического употребления из-за коррозии.
В процессе коррозии происходит переход из металлического состояния в ионное. Коррозия – самопроизвольный процесс, сопровождается уменьшением свободной энергии (ΔG<0), увеличением энтропии системы и определенным энергетическим эффектом.
В некоторых случаях коррозия поражает всю поверхность, в других – часть ее. Характер разрушения зависит от свойств металла и условий протекания процесса. На рис. 7 представлены различные виды коррозийных разрушений: равномерное (а), пятнами (б), точечное (в), питтинг (г), межкристаллитное (д), растрескивающее (Е), селективное (Ж). Наиболее опасными являеются питтинг и межкристаллитное разрушения.
Рис. 7. Виды коррозийный разрушений
По принципу их протекания все коррозийные процессы принято подразделять на: химические и электрохимические.
Химическая коррозия
Химическая коррозия обусловлена взаимодействием металла с сухими газами или жидкостями, не проводящими электрического тока. Химической коррозии подвергаются детали и узлы машин, работающих в атмосфере кислорода, галогенов, при высоких температурах (турбинные, ракетные двигатели, оборудование химических производств).
Механизм реакции сравнительно прост. Продукты реакции образуются на тех участках металлической поверхности, которые вступили в реакцию. Так, на железе при 250-300оС появляется видимая пленка оксидов, при 600оС и выше поверхность металла покрывается слоем окалины, состоящей из оксидов железа различной степени окисления (FeO, Fe3O4, Fe2O3). Окалина не может защитить металл от дальнейшего окисления, так как содержит трещины и поры, которые позволяют проникать кислороду к металлу. При повышении температуры свыше 800оС скорость окисления железа резко увеличивается.
Образующиеся на металле оксидные пленки часто препятствуют дальнейшему окислению (образуется так называемая «защитная» пленка, которая препятствует проникновению к металлу как газов, так и жидкостей). Защитными свойствами обладает только та пленка, которая может покрывать сплошь весь металл. Расчеты показывают, что это возможно, если объем оксида металла больше объема самого металла, пошедшего на образование этого оксида:
Vокс/Vме>1
Для щелочных и щелочно-земельных металлов это условие не соблюдается (Vокс/Vме<1). Такие пленки защитными свойствами не обладают и эти металла ввиду своей химической активности принадлежат к числу коррозионно нестойких. На алюминии и хроме образуются хорошие защитные пленки, благодаря чему металлы в атмосферных условиях коррозийно стойки (хотя химически активны). Толщина таких пленок крайне мала, например, на алюминии она достигает только 100 Å. Такие пленки состоят всего из нескольких слоев молекул и могут быть обнаружены только специальными оптическими методами.
Если металл, покрытый пленкой, продолжает корродировать, то это означает, что имеет место диффузия атомов кислорода сквозь пленку к металлу, а атомов металла – в обратном направлении. Диффузия металла и кислорода в слое твердого защитного оксида может происходить по одному из двух возможных механизмов:
а) движение ионов в междоузельном пространстве кристаллической решетки;
б) движение ионов по пустым узлам решетки.
Первый механизм имеет место при образовании пленок ZnO, CdO, BeO, Al2O3; второй – Cu2O, FeO, NiO, CoO, ZrO2, TiO2.
Диффузия катионов в защитной пленке сопровождается одновременным перемещением в том же направлении эквивалентного числа электронов в междоузлиях при первом механизме и по «электронным дефектам» (катионом с более высокой валентностью) при втором механизме. При повышении температуры окисление металлов на воздухе происходит более интенсивно (увеличивается скорость диффузии).
Электрохимическая коррозия
Разрушение металла при соприкосновении с электролитом с возникновением в системе электрического тока называется электрохимической коррозией.
В атмосферных условиях роль электролита играет водная пленка на металлической поверхности, в которых часто растворены электропроводящие примеси. Электродами обычно являются сам металл и примеси в нем содержащиеся. В качестве примера рассмотрим действие серной кислоты на железо, содержащего примесь меди. При таком контакте возникает множество микроскопических гальванических элементов.
(-) Fe ׀ H2SO4 ׀ Cu(+) 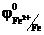 = - 0,44 В
= - 0,44 В 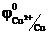 = 0,34 В
= 0,34 В
Более активный металл-железо – окисляется, посылая электроны атомам меди и переходит в раствор в виде ионов Fe2+, а ионы водорода разряжаются (восстанавливаются) на меди.
Помимо этого железо может растворяться и при непосредственном взаимодействием с кислотой (Fe + 2Н+ = Fe2+ + Н2↑), но опыт показывает, что скорость этой реакции мала по сравнению со скоростью растворения железа как анода гальванопары. Механизм коррозии в кислой и нетральной среде различен.
Рассмотрим коррозию технического железа на воздухе, когда оно покрыто влажной пленкой или находится в растворе электролитов с небольшой концентрацией гидроксид ионов. В качестве анода здесь служит основной металл – железо, катодом, являются примеси содержащиеся в металле, например, зерна графита:
Анод: Fe – 2e- = Fe2+
Катод: 2H2O + O2 + 4e- = 4OH-
Ионы OH- соединяются с перешедшими в раствор ионами Fe2+
Fe2+ + 2OH- = Fe(ОН)2
4Fe(ОН)2 + O2 + 2H2O = 4Fe(ОН)3
Fe(ОН)3 = Fe + H2O
Согласно теории электрохимической коррозии при соприкосновении металла с электролитом на его поверхности возникает множество микрогальванических элементов. При этом анодами являются частицы металлов, катодами – загрязнения, примеси и участки металла, имеющие более положительный потенциал. Механическая обработка изменяет электродный потенциал, поэтому соприкосновение двух участков металла деформированного и недеформированного достаточно для появления разности потенциалов. Корродировать будет деформированный участок. Разность потенциалов возникает и там где соприкасаются обнаженный и покрытый пленкой участки.
Поскольку ионы и молекулы, связывающие электроны в катодном процессе, называют деполяризаторами, то часто говорят о водородной деполяризации в кислой и кислородной деполяризации в нейтральной и скабощелочной средах.
Поскольку электрохимическая коррозия обусловлена деятельностью гальванических элементов, можно сделать вывод, что факторы способствующие деятельности гальванических элементов усиливают коррозию. Скорость коррозии тем больше, чем дальше отстоят в ряду напряжений металлы, из которых образовалась гальваническая пара. Скорость коррозии возрастает с ростом температуры и с увеличением концентрации окислителя в растворе.
Нередко продукты коррозии оказываются малорастворимыми в данной среде и своим присутствием защищают металл от дальнейшего разрушения. Например, железо в щелочных растворах, свинец в разбавленной серной кислоте коррозионно стойки вследствие образования пленок Fe(OH)2, PbSO4.
Большое значение в процессах коррозии имеют поляризация электродов, образование пленок на металлах, пернапряжение водорода. Если бы в коррозионных процессах не происходило поляризации электродов (см. поляризация), то процессы коррозии протекали бы с такой скоростью, что железо и ряд других металлов потеряли бы свое значение в технике.
Подземная коррозия
Под влиянием веществ, растворимых в почве или под действием блуждающих токов, происходит разрушение газо- и нефтепроводов, оболочек кабелей, металлических конструкций, свай (почвенная коррозия). Интенсивность почвенной коррозии зависит от агрессивно действующих кислот, органических соединений и от деятельности бактерий. Наиболее активными считаются торфянистые и болотистые почвы. Под действием блуждающих токов, исходящих от электроустановок, работающих на постоянном токе, трамваев, метро, электрических железных дорог. Блуждающие токи вызывают появление на металлических предметах (трубопроводах, кабелях, рельсах участков входа и выхода постоянного тока, т.е. образование катодных и анодных зон на металле (анодные зоны – места выхода тока подвергаются коррозии. Блуждающие токи от источников переменного тока вызывают слабую коррозию изделий из стали и сильную – у изделий из цветных металлов.
Резко увеличивают коррозию ионы хлора, брома, йода.
6.4 . Методы защиты от коррозии
Широко применяются следующие методы защиты металлических конструкций от коррозии:
1. Защитные покрытия.
2. Антикоррозионное легирование металла.
3. Электрохимическая защита.
4. Обработка коррозионной среды.
5. Разработка и производство новых металлических конструкционных материалов повышенной коррозионной устойчивости.



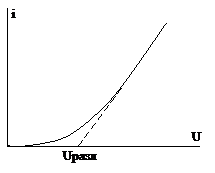 Рассмотрим электролиз 0,1М раствора HCl. Если к электродам приложить небольшую разность потенциалов от внешнего источника тока, а затем постепенно ее увеличивать, то можно зафиксировать изменение силы тока в цепи в зависимости от приложенного напряжения (рис. 6). Лишь при определенном напряжении (1,3 В) происходит резкое увеличение тока в цепи и одновременно начинается видимое разложение электролита.
Рассмотрим электролиз 0,1М раствора HCl. Если к электродам приложить небольшую разность потенциалов от внешнего источника тока, а затем постепенно ее увеличивать, то можно зафиксировать изменение силы тока в цепи в зависимости от приложенного напряжения (рис. 6). Лишь при определенном напряжении (1,3 В) происходит резкое увеличение тока в цепи и одновременно начинается видимое разложение электролита.
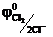 -
- 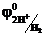 = 1,36 – 0,000 = 1,36 В и имеет направление противоположное внешней ЭДС. Возникновение обратной ЭДС при электролизе, называемой ЭДС поляризации, составляет сущность явления поляризации при электролизе. Поэтому электролиз возможен при условии компенсации ЭДС поляризации внешним напряжением. Часто реально напряжение разложения оказывается много больше ЭДС поляризации, так как необходимо скомпенсировать еще и водородное перенапряжение на катоде и хлорное перенапряжение на аноде, вызванные замедленностью реакции разряда.
= 1,36 – 0,000 = 1,36 В и имеет направление противоположное внешней ЭДС. Возникновение обратной ЭДС при электролизе, называемой ЭДС поляризации, составляет сущность явления поляризации при электролизе. Поэтому электролиз возможен при условии компенсации ЭДС поляризации внешним напряжением. Часто реально напряжение разложения оказывается много больше ЭДС поляризации, так как необходимо скомпенсировать еще и водородное перенапряжение на катоде и хлорное перенапряжение на аноде, вызванные замедленностью реакции разряда. = 1,06 В) и Cl2 (
= 1,06 В) и Cl2 ( 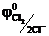 = 1,36 В), а не кислород, хотя в нейтральной и кислой средах соответственно равновесный потенциал кислородного электрода ниже, чем у брома и хлора (0,81 В и 1,23 В).
= 1,36 В), а не кислород, хотя в нейтральной и кислой средах соответственно равновесный потенциал кислородного электрода ниже, чем у брома и хлора (0,81 В и 1,23 В).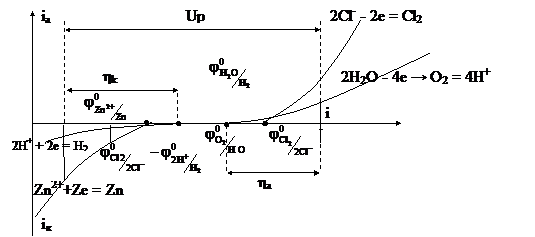
 m =
m =  , где
, где
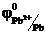 = -0,36 В
= -0,36 В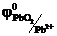

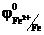 = - 0,44 В
= - 0,44 В 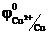 = 0,34 В
= 0,34 В