

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...
Топ:
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Определение места расположения распределительного центра: Фирма реализует продукцию на рынках сбыта и имеет постоянных поставщиков в разных регионах. Увеличение объема продаж...
Комплексной системы оценки состояния охраны труда на производственном объекте (КСОТ-П): Цели и задачи Комплексной системы оценки состояния охраны труда и определению факторов рисков по охране труда...
Интересное:
Как мы говорим и как мы слушаем: общение можно сравнить с огромным зонтиком, под которым скрыто все...
Уполаживание и террасирование склонов: Если глубина оврага более 5 м необходимо устройство берм. Варианты использования оврагов для градостроительных целей...
Средства для ингаляционного наркоза: Наркоз наступает в результате вдыхания (ингаляции) средств, которое осуществляют или с помощью маски...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Измерить абсолютное значение электродного потенциала, возникающего на границе металл – раствор, невозможно, так как для подключения измерительного прибора необходим второй металлический электрод. В таком случае измеряют только относительную величину потенциала по отношению к электроду, принятому за стандарт. Согласно международному соглашению таким стандартным электродом является водородный электрод, потенциал которого принят равным нулю.
Водородный электрод состоит из платиновой пластины, покрытой тонким слоем платиной черни и опущенной в водный раствор серной кислоты с активной концентрацией а(Н+), равной 1 моль · л-1. Через этот раствор пропускается ток чистого водорода под давлением 101,3 кПа, который омывает платиновую пластину. Избыток водорода удаляется через верхнюю трубку (рис. 2). Платина, как и многие другие металлы этой группы, способна насыщаться водородом, в результате чего вся поверхность платиновой пластинки оказывается покрытой слоем водорода. В результате адсорбции на платине в газовой форме уста вливается равновесие
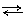 Н2 2Н
Н2 2Н
Таким образом, водородный электрод, подобно металлическому, представляет собой восстановительную форму Н0, погруженную в раствор, содержащий окисленную форму Н+.
 |
Рис. 2. Строение водородного электрода
Между поверхностным слоем водорода на платине и раствором устанавливается равновесие
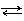 Н+ + е- Н
Н+ + е- Н
и возникает разность потенциалов, которая, как указано выше, принята равной нулю.
Для измерения величины стандартного электродного потенциала металлического электрода, данный электрод соединяют с водородным электродом проводником первого рода. При замыкании электрической цепи вследствие разности электродных потенциалов начнется движение электронов от электрода с меньшим потенциалом (обладающие избытком электронов) к электроду с большим потенциалом (обладающим меньшим количеством электронов). Так, если в качестве измеряемого электрода выступает цинк, то движение электронов будет направлено от цинка к платине. Уменьшение электронов на цинковой пластине будет смещать равновесие в сторону выхода катионов цинка в раствор, а следовательно на цинковом электроде будет протекать процесс окисления.
|
|
Zn0 → Zn2+ + 2e
На водородном электроде катионы Н+ принимают электроны и восстанавливаются.
2Н+ + е → Н2
Принято считать электрод, на котором протекает процесс окисления – анодом, а на котором процесс восстановления – катодом.
Зная величину ЭДС, измеренную в такой системе, можно легко вычислить потенциал электрода (метод измерения ЭДС разобран в разделе 3).
Так как в рассматриваемом процессе катодом является водородный электрод, а 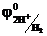 = 0
= 0
- φА = ЭДС
Если потенциал измеряемого электрода больше водородного, то движение электронов будет направлено от платины к металлу и величина потенциала электрода будет положительной.
|
|
|

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!