Цели и задачи работы: получить экспериментальные данные, характеризующие периодический процесс роста дрожжей на конкретном углеродном субстрате (глюкоза, этанол, глюкозо-спиртовая смесь (1:1)) и провести их анализ.
Периодическое культивирование микроорганизмов представляет с точки зрения техники наиболее простой метод культивирования. В этом случае в качалочную колбу или ферментатор помещается питательная среда, в которую вносится активная культура микроорганизмов – инокулят (от лат. inoculatio - прививка). Инокулят иначе называют посевным материалом, а инокуляцию называют посевом. В дальнейшем наблюдают за ростом и накоплением микроорганизмов в питательной среде.
Рост микроорганизмов наблюдается до тех пор, пока концентрации питательных компонентов не станут лимитирующими, или пока в культуральной жидкости концентрация продуктов метаболизма не достигнет критического уровня, подавляющего (ингибирующего) микроорганизмы. Культуральная жидкость представляет собой жидкую фазу по окончании культивирования микроорганизмов, содержащую продукты ферментации, биомассу и/или ферменты, неиспользованный субстрат и другие компоненты питательной среды.
Под культивированием микроорганизмов понимают их выращивание в наиболее благоприятных (оптимальных) условиях (от этого ключевого понятия возникают определение культуры микроорганизмов, культуральной жидкости и т.п.).
Для феноменологического описания роста микроорганизмов в периодическом режиме обычно используют кривую роста (рис. 2.4). Она имеет S-образный характер. Различают несколько стадий роста.

lg N
I II III IV V VI
τ
Рис. 2.4 – Кривая роста периодической культуры микроорганизмов
Сразу после посева (инокуляции) наблюдается лаг-фаза (I). В этой фазе число клеток не возрастает, однако идут интенсивные приспособительные процессы. После окончания лаг-фазы скорость роста возрастает. Эта фаза носит название фазы ускорения роста (II) и занимает весьма небольшое время. Экспоненциальная (логарифмическая) фаза (III) характеризуется постоянной максимальной скоростью деления клеток. Логарифмическая фаза роста сменяется фазой замедления роста (IV), когда наблюдается еще относительно интенсивный рост клеток, однако скорость роста замедляется. За ней у многих микроорганизмов наступает стационарная фаза (V), когда концентрация биомассы не меняется во времени. Далее следует фаза отмирания и выживания (VI), в ходе которой число жизнеспособных клеток снижается.
Количественное описание роста микроорганизмов осуществляется c помощью удельной скорости роста.
В каждый момент времени µ =  , (2.8)
, (2.8)
где µ – удельная скорость роста, ч -1 ;
х – концентрация биомассы в момент времени τ.
Интегрирование этой зависимости дает возможность определить удельную скорость роста за определенные промежутки времени
µср = 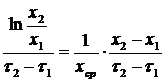 , (2.9)
, (2.9)
где х 1 и х 2 – концентрация биомассы в начальный и конечный момент времени;
х ср – средняя концентрация биомассы.
Изменение в процессе ферментации метаболического коэффициента q, дает возможность судить о кинетике потребления субстрата
q = 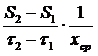 , (2.10)
, (2.10)
где S 1 и S 2 – концентрация субстрата в момент времени τ1 и τ2.
В общем случае он характеризует долю субстрата, используемого для роста определенного количества биомассы за определенный промежуток времени. Надо отметить, что метаболический коэффициент может быть рассчитан для любого субстрата: органического (этанол и др.), минерального (азот, фосфор, и т.д.).
Рассмотренные показатели µ и q представляют кинетические характеристики роста культуры. Однако при целостном рассмотрении процесса, важное значение имеют стехиометрические показатели – выходы по массе и энергии.
Под выходом по массе (или экономическим коэффициентом) понимается весовое отношение прироста абсолютно сухой биомассы (АСБ) к потребленному субстрату (г АСБ/г субстрата)
Y = ∆х/∆ S (2.11)
Однако этот показатель имеет существенный недостаток: массовый выход не характеризует эффективность процесса роста с точки зрения энергии. Так при росте микроорганизмов на глюкозе и уксусной кислоте могут быть получены одинаковые значения Y, хотя энергия, содержащаяся в этих соединениях различна. Энергетический выход η характеризует долю энергии субстрата, перешедшую в биомассу. Универсальной единицей восстановленности является редоксон. Количество редоксонов в расчете на
грамм-атом углерода характеризует восстановленность вещества γ. Для вещества состава CHpOnNq она рассчитывается по формуле
γ = 4 + р – 2 n – 3 q (2.12)
Связь энергетического выхода и выхода по массе имеет вид
 , (2.13)
, (2.13)
где σ в, σ s – весовая доля углерода в биомассе и субстрате соответственно;
γв, γ s – степень восстановленности биомассы и субстрата.
Степень восстановленности углерода в биомассе мало меняется в зависимости от вида микроорганизма и равна γв = 4,2. Средняя весовая доля углерода в биомассе σ в = 0,46.
Приведем уравнение количественной связи энергетического выхода и выхода по кислороду Y  :
:
Y  = 0,75
= 0,75  (2.14)
(2.14)
При выращивании дрожжей на этаноле в качестве конечного продукта получают микробную биомассу – продуцент белка. В практическом отношении представляет интерес значение выхода белка из потребленного субстрата
Y X / S =  , (2.15)
, (2.15)
где: Б – содержание белка, % вес.;
S о, S – начальная и конечная концентрация субстрата г/л, соответственно.
Объекты исследования, оборудование, реактивы и посуда:
- музейная культура дрожжей – 2-3 пробирки;
- суспензия дрожжей (р. Candida илир. Saccharomyces) – 20-50 мл;
- микроскопы – 5 шт.;
- газовый хроматограф;
- спектрофотометр;
- фотоэлектроколориметр – 2 шт. и кюветы на 5 мл;
- центрифуга (8000 мин-1);
- водяная баня – 2 шт.;
- электроплитка – 2 шт.;
- весы – 2 шт.;
- перемешивающее устройство (качалка) – 2 шт.;
- качалочные колбы (9 шт. на одну качалку) объемом 100 мл;
- NH4H2PO4 – 50-100 г;
- (NH4)2SO4 – 5-10 г;
- MgSO4 . 7 H2O – 7-10 г;
- Na2HPO4·12H2O – 7-10 г;
- KH2PO4 – 30-40 г;
- K2HPO4 – 1 г;
- FeSO4 – 10-20 г;
- MnSO4 – 10-20 г;
- ZnSO4 – 10-20 г;
- NaCl – 5-10 г;
- СаCl2 × 4 H2O – 1 г
- H2SO4 (конц.) – 100 мл;
- этанол как субстрат – 20-50 мл;
- глюкоза как субстрат 20-50 г
- дрожжевой автолизат – 20-50 мл;
- K2Cr2O7 – 50-100 г;
- раствор соли Мора FeSO4×(NH4)2SO4 – 92 г и H2SO4 в 1 л Н2О;
- раствор феррицианида K3Fe(CN)6 – 0,2 г/л;
- 0,5 н раствор NаОН – 500 мл;
- физиологический раствор (0,85 г NaCl на 10 мл Н2О);
- раствор Люголя;
- медный купорос, оксид меди СuSO4 × 5H2O – 35 г;
- сегнетова соль COOK-CHOH-CHOH-COONa× 4H2O – 175 г;
- 40% раствор KJ;
- 0,1 н раствор гипосульфита натрия Na2S2O3;
- 0,5% раствор крахмала;
- пипетки мерные объемом 1 мл – 5-10 шт.;
- пипетки мерные объемом 2 мл – 5-10 шт.;
- конические колбы объемом 250 мл – 5 шт.;
- пробирки со штативом (на 1 опыт, на 1 бригаду) – 8-10 шт.;
- мерные колбы объемом 50 или 100 мл (на бригаду) – 4-5 шт.;
- мерные колбы объемом 500 мл (1000 мл) – 2 шт.;
- бюретки объемом на 50 мл (100 мл) – 2 шт.;
- круглодонная колба с резиновой пробкой и газоотводной трубкой объемом 50-75 мл – 1-2 шт.;
- трехшариковая колба (приемная) – 1-2 шт.;
- предметные стекла – 10 шт.;
- покровные стекла – 10 шт.;
- марлевые салфетки;
- фильтровальная бумага.
Экспериментальная часть
1. Подготовить посевной материал.
2. Приготовить питательные среды с различными источниками углерода.
3. Осуществить процесс культивирования дрожжей. Предварительно построить калибровочный график зависимости оптической плотности D от концентрации биомассы дрожжей X (г/л).
4. Выполнить аналитические исследования: определить содержание биомассы в культуральной жидкости, количества белка в биомассе, содержание остаточного субстрата. С целью выявления запасного вещества – гликогена приготовить препарат дрожжевой суспензии «раздавленная капля» и микроскопировать его с объективом 40×.
Подготовка посевного материала
Дрожжи стерильно пересевают с музейного косяка на свежий косяк сусло-агара. Затем пересеянные косяки помещают в термостат при температуре 36о С и выдерживают их там в течение 24 часов. Выращенную культуру дрожжей смывают с косяка в стерильных условиях стерильным физиологическим раствором из расчета 5 мл физраствора на 1 косяк. Полученную суспензию дрожжей стерильно переносят в начальные колбы со стерильной питательной средой, куда вносят 2 мл суспензии дрожжей.




 , (2.8)
, (2.8)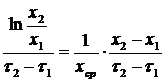 , (2.9)
, (2.9)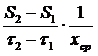 , (2.10)
, (2.10) , (2.13)
, (2.13) :
: (2.14)
(2.14) , (2.15)
, (2.15)


