А.С. Сироткин, В.Б. Жукова
Теоретические основы биотехнологии
Учебно-методическое пособие

 Методические разработки
Методические разработки
кафедры промышленной
биотехнологии
Казань, 2009
УДК 577.15:663/664(075.8)
Теоретические основы биотехнологии: Учебно-методическое пособие /А.С. Сироткин, В.Б. Жукова; Казан. гос. технол. ун-т, Казань, 2009. 50 с.
Учебно-методическое пособие по дисциплине «Теоретические основы биотехнологии» предназначено для студентов, обучающихся по специальности 24090165 – Биотехнология, а также по направлению подготовки бакалавров и магистров 550800 – Химическая технология и биотехнология.
Пособие содержит теоретические сведения из соответствующего лекционного курса, читаемого на кафедре промышленной биотехнологии по очной и очно-заочной формам обучения. Лекционный материал поддерживает осознанное выполнение заданий к лабораторным работам, а также помогает студентам успешно подготовиться к сдаче коллоквиумов по тематическим разделам учебной дисциплины, итоговых зачета и экзамена.
В части лабораторного практикума изучаются кинетические закономерности гибели микроорганизмов в процессе термического воздействия на микробные суспензии; роста микробных популяций на различных субстратах и рассматриваются аналитические методы определения параметров процесса культивирования клеток; исследуется влияние ингибиторов на рост микроорганизмов при различных способах культивирования.
В оформлении методического пособия принимала участие ведущий программист И.П. Мужиковская.
 Подготовлено на кафедре промышленной биотехнологии.
Подготовлено на кафедре промышленной биотехнологии.
Табл. 8, Ил. 10. Библиогр. 24 ист.
Печатается по решению редакционно-издательского совета Казанского государственного технологического университета.
| Рецензенты:
| заведующий кафедрой «Водные ресурсы и аквакультура» Казанского государственного энергетического университета, д.б.н., профессор М.Л. Калайда
профессор кафедры технологии пищевых производств Казанского государственного технологического университета, д.б.н., профессор Ежкова Г.О.
|
© Казанский государственный технологический университет, 2009 г.
Оглавление
| Введение
| 4
|
| Тема 1. Асептика в биотехнологических процессах.
Стерилизация оборудования, питательных сред и воздуха
Лабораторная работа 1. Изучение кинетики гибели микроорганизмов
Контрольные вопросы
Литература
|
5
11
17
17
|
| Тема 2. Метаболизм углеродсодержащего субстрата. Периодическое культивирование дрожжей на различных углеродных субстратах
Лабораторная работа 2. Кинетика и стехиометрия роста микроорганизмов
Контрольные вопросы
Литература
|
18
25
36
36
|
| Тема 3. Ингибирование роста микроорганизмов в условиях периодического культивирования
Лабораторная работа 3. Изучение влияния ингибиторов на рост микробной культуры методом острых опытов
Контрольные вопросы
Литература
|
37
44
48
48
|
| Примерные темы самостоятельных работ к семинарским занятиям
| 49
|
Введение
В настоящий момент вряд ли у кого-нибудь может возникнуть сомнение в том, что современная биология представляет собой наиболее разнообразную область естественных наук. Действительно, она включает казалось бы совершенно не связанные между собой разделы научных знаний: микробиологию, анатомию растений и животных, биохимию, иммунологию, клеточную биологию, физиологию растений и животных, различные систематики, экологию, генетику, биофизику, математику и много других областей естествознания.
Именно существенные успехи в фундаментальных исследованиях в области биохимии, молекулярной генетики и молекулярной биологии, достигнутые во второй половине текущего столетия, создали реальные предпосылки управления различными (пусть, возможно и не самыми главными) механизмами жизнедеятельности клетки. Сложившаяся благоприятная ситуация в биологии явилась мощным толчком в развитии современной биотехнологии, весьма важной области практического приложения результатов фундаментальных наук.
Можно с уверенностью утверждать, что биотехнология является наиболее разительным примером того, как результаты, казалось бы "чистой науки", находят применение в практической деятельности человека. Основой, обеспечивающей благоприятную ситуацию для бурного развития биотехнологии, явились революционизирующие открытия и разработки:
• доказательства роли нуклеиновых кислот в хранении и передаче наследственной информации в биологических системах (имеются в виду индивидуальные клетки и отдельные организмы, а не их популяции);
• расшифровка универсального для всех живых организмов генетического кода;
• раскрытие механизмов регуляции функционирования генов в процессе жизни одного поколения организмов;
• совершенствование существовавших и разработка новых технологий культивирования микроорганизмов, клеток растений и животных;
• как логическое следствие из вышесказанного, явилось создание (возникновение) и бурное развитие методов генетической и клеточной инженерии, с помощью которых искусственно создаются новые высокопродуктивные формы организмов, пригодные для использования в промышленных масштабах.
Все эти достижения вывели биотехнологию на новый уровень ее развития, позволяющий сознательно и целенаправленно управлять сложными клеточными процессами. Данная новая область биологических знаний и ее последние достижения стали крайне важными для здоровья и благополучия человека.
Экспериментальная часть
1. Разлить исходную суспензию микроорганизмов по 3-5 мл в пробирки.
Примечание: в качестве точки отсчета оставить нулевую пробу.
2. Каждой бригаде поместить 4 пробирки в термостат (или в водяную баню) и установить заданную температуру эксперимента (t = 65о C, 85о С и 100о С).
3. Через определенные промежутки времени (15 минут) отобрать пробы.
4. Проанализировать количество клеток в объеме среды методом простого окрашивания и подсчета в счетных камерах Горяева-Тома.
Подсчет клеток в счетных камерах
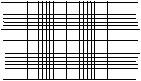
Этот метод рекомендуется использовать для подсчета крупных объектов – дрожжей, одноклеточных водорослей, конидий грибов и некоторых относительно крупных бактерий. Обычно используют камеру Горяева-Тома (рис. 1.2), хотя можно применять и другие.
Эта камера представляет собой толстое предметное стекло, разделенное бороздками. На центральную часть стекла нанесена сетка. Площадь квадрата сетки указана на одной из сторон предметного стекла и соответствует 1/25 мм2 (большой квадрат) или 1/400 мм2 (малый квадрат). Часть предметного стекла, на 0,1 мм ниже двух других сторон. Это глубина камеры, она всегда указывается на предметном стекле.

а
 h в
h в
б
а – вид сверху; б – вид сбоку;
в – вид сетки камеры при малом увеличении микроскопа
Рис. 1.2 – Камера Горяева-Тома
При работе с камерой необходимо соблюдать определенный порядок ее заполнения. Вначале углубление с сеткой покрывают специальным шлифованным покровным стеклом и, слегка прижимая, смещают покровное стекло в противоположные стороны до появления колец Ньютона. Это указывает на то, что покровное стекло притерто к сторонам камеры. Только при таком условии объем взвеси микроорганизмов, находящихся в камере, соответствует расчетному. Суспензию вносят через бороздку камеры капилляром или пипеткой.
Подсчет клеток рекомендуется начинать через 3-5 минут после заполнения камеры, чтобы клетки осели и при микроскопировании были видны в водной плоскости. Подвижные клетки перед заполнением камеры убивают нагреванием или суспендированием в 0,5 % -ном водном растворе формалина. Число клеток подсчитывают с объективом 8× или 40×. С иммерсионным объективом работать нельзя, так как его фокусное расстояние меньше толщины стекла камеры. Обычно подсчитывают клетки микроорганизмов в 10 больших или 20 маленьких квадратах сетки, перемещая последние по диагонали. Учитывают все клетки, лежащие в квадрате сетки, а также клетки, пересекающие верхнюю и правую сторону квадрата. При подсчете количество клеток в большом квадрате не должно превышать 20, а в малом – 10, в противном случае исходную суспензию разводят водопроводной водой. Для получения достоверного результата общее число подсчитанных клеток микроорганизмов должно быть не менее 600.
Точность определения зависит от того, насколько плотно пришлифовано покровное стекло к поверхности камеры, поэтому подсчет клеток повторяют 3-4 раза, каждый раз заново монтируя камеру и заполняя ее исследуемой взвесью микроорганизмов. Это обеспечивает большую точность, чем подсчет 600 клеток при однократном монтаже камеры. Количество клеток в 1 мл исследуемой суспензии вычисляют по формуле:
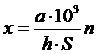 ,
,
где х – число клеток в 1 мл суспензии;
а – среднее число клеток в квадрате сетки;
h – глубина камеры в мм;
S – площадь квадрата сетки в мм2;
103 – коэффициент перевода см3 в мм3;
n – разведение исследуемой суспензии.
Сетка Горяева состоит из 225 больших квадратов, из которых 25 разделены на 16 малых квадратов, 100 – на прямоугольники и 100 остаются чистыми.
Каждая их 15 вертикальных и горизонтальных полос сетки Горяева имеет ширину, равную 1/5 мм, причем каждая третья полоса разделена в свою очередь на 4 узкие полоски шириной 1/20 мм, при пересечении которых образуются маленькие квадратики площадью 1/400 мм2. Они составляют 25 групп из 16 квадратиков. Для подсчета используются большие квадраты, разделенные на 16 маленьких.
Расчетная часть
Оценить эффективность термической стерилизации. Для этого:
1. Вычислить х – число клеток в 1 мл суспензии микроорганизмов и построить графическую зависимость х = f(τ);
2. Вычислить критерий стерилизации ln  ;
;
3. Определить удельную скорость гибели (k) микроорганизмов при заданной температуре (Т = 65о, 85о, 100оС) по уравнению (1.1);
Результаты экспериментальных данных и расчетов представить в виде таблицы 1.3.
Таблица 1.3 – Экспериментальные данные и показатели термической стерилизации
| №
пробы
| τ, мин.
| а
| х
| ln 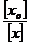 ; ;
| k, мин -1
|
| 0
| 0
|
|
|
|
|
| 1
| 15
|
|
|
|
|
| 2
| 30
|
|
|
|
|
| 3
| 45
|
|
|
|
|
| 4
| 60
|
|
|
|
|
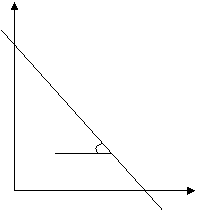
4. Построить графическую зависимость в координатах ln k = f (1/ T) (Т приводится в градусах Кельвина).
 ln k
ln k
ln A
α
1/ T
Рис. 1.3 – Графическая зависимость k от 1/ Т
Из графика (рис. 3.1) найти tgα и точку пересечения с осью ординат. В линеаризованном виде уравнение Аррениуса может быть записано как
ln k = ln A - E / RT (1.3)
Здесь ln A определяется из графика как величина, численно равная величине отрезка, отсекаемого прямой на оси ординат, а 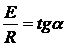 .
.
Таким образом, значение удельной скорости гибели определяется из уравнения Аррениуса с найденными константами: А и Е/ R.
Эффективность стерилизации может быть оценена для любой температуры: так как А, Е, R – постоянные величины, подставив в уравнение Аррениуса (1.3) любое значение Т, рассчитывается k.
5. Определитьтемпературу, которая гарантирует заданную степень асептики;
6. Рассчитать время, за которое концентрация выживших клеток снижается в 10 раз.
Сделать обобщающие выводы по полученным экспериментальным данным и результатам расчетов.
Контрольные вопросы
1. Асептика, асептические условия, стерильность.
2. Какое влияние оказывает посторонняя микрофлора на эффективность микробиологических производств? Приведите примеры.
3. Каким образом обеспечивается достижение и поддержание асептических условий на стадии ферментации?
4. Термическая стерилизация.
5. Химическая стерилизация.
6. Стерилизация ионизирующим излучением.
7. Фильтрующая стерилизация.
8. Проанализируйте существующие способы и режимы стерилизации. Какие пути повышения эффективности режимов стерилизации жидкостей вы знаете?
9. Методы и режимы получения стерильного воздуха.
Литература
1. Бирюков В.В. Основы промышленной биотехнологии. – М.: КолосС, 2004. – 296 с.
2. Елинов Н.П. Основы биотехнологии. – С-Пб.: Наука, 1995. – 600 с.
3. Кантере В.М. Теоретические основы технологии микробиологических производств. – М.: Агропромиздат, 1990. – 271 с.
4. Манаков М.Н., Победимский Д.Г. Теоретические основы технологии микробиологических производств. – М.: Агропромиздат, 1990. – с. 210-213.
5. Матвеев В.Е. Научные основы микробиологической технологии. – М.: Агропромиздат, 1985. – 224 с.
6. Матвеев В.Е. Основы асептики в технологии чистых микробиологических препаратов. – М.: Легкая и пищевая пром-сть, 1981. – 312 с.
7. Биотехнология: уч. пособие для вузов. В 8 кн. / Под ред. Н.С. Егорова; В.Д. Самуилова. Кн. 1. – М.: Высшая школа, 1987. – 159 с.
8. Беккер М.Е., Лиепиньш Г.К., Райпулис Е.П. Биотехнология. – М.: Агропромиздат, 1990. – 334 с.
9. Промышленная микробиология / Под ред. Н.С. Егорова. – М.: Высшая школа, 1989. – 688 с.
Метаболизм этанола
Первичное окисление этанола осуществляется последовательно двумя ферментами: НАД-зависимой алкогольдегидрогеназой и НАД-зависимой дегидрогеназой. Первый фермент локализован в митохондриях и ответственен за проведение реакций окисления этанола в ацетальдегид.
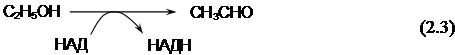
В цитоплазме обнаружен еще один тип дегидрогеназы (растворимый). Однако этот фермент участвует в проведении обратной реакции превращения ацетальдегида в этанол. Этот процесс обычно наблюдается при спиртовом брожении, в то время как реакция (1) доминирует при росте дрожжей на этаноле.
Ацетальдегид, в свою очередь, под действием НАД-зависимой алкогольдегидрогеназы превращается в ацетилкофермент А (СН3СОКоА, ацетил-КоА).
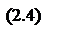

В результате двухступенчатого окисления этанола образуется 2 моля НАДН из 1 моля этанола. При недостатке кислорода клетка может выделять в окружающую среду уксусную кислоту. Она образуется за счет конверсии ацетилкофермента А с участием неорганического фосфата под действием фосфатацетилтрансферазы до фосфоацетилфосфата и дальнейшего превращения последнего в уксусную кислоту под действием ацетаткиназы.


В этом случае затрачивается 1 моль кислорода на 1 моль этанола, клетка продуцирует 5 молей АТФ. Ацетилкофермент А включается в ЦТК при конденсации с оксокислотами. Часть ацетил-КоА сразу включается в глиоксилатный шунт. Глиоксилатный шунт представляет собой обходной путь реакций превращения изолимонной кислоты в яблочную (рис. 2.2). Если в цикле Кребса изолимонная кислота путем двух стадий декарбоксилирования превращается через α-кетоглутаровую и янтарную кислоты в яблочную, то здесь эти две стадии декарбоксилирования отсутствуют. Изолимонная кислота путем альдольного расщепления превращается в янтарную и глиоксиловую кислоты. Эту реакцию катализирует изоцитратлиаза. Глиоксиловая кислота путем конденсации с ацетил-КоА образует яблочную кислоту под действием малатсинтазы. Таким образом, при каждом обороте цикла за счет включения второй молекулы ацетил-КоА синтезируются дополнительные молекулы янтарной кислоты. Она используется клеткой для биосинтеза.
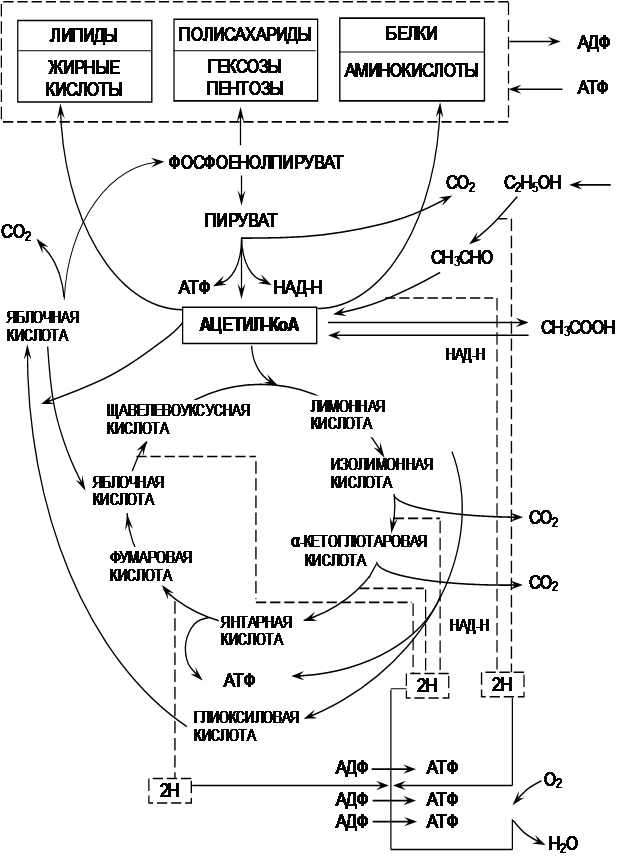 Рис. 2.2 – Биохимическая схема ассимиляции
Рис. 2.2 – Биохимическая схема ассимиляции
углеродных субстратов дрожжами
На рис. 2.2 отмечена передача пяти пар протонов (2Н), высвобождающихся в цикле ЦТК, в электронтранспортную дыхательную цепь с их окислением до Н2О. Сопряженный с этим процесс регенерации АТФ в дыхательной цепи с накоплением внутриклеточной энергии называется окислительным фосфорилированием.
Экспериментальная часть
1. Подготовить посевной материал.
2. Приготовить питательные среды с различными источниками углерода.
3. Осуществить процесс культивирования дрожжей. Предварительно построить калибровочный график зависимости оптической плотности D от концентрации биомассы дрожжей X (г/л).
4. Выполнить аналитические исследования: определить содержание биомассы в культуральной жидкости, количества белка в биомассе, содержание остаточного субстрата. С целью выявления запасного вещества – гликогена приготовить препарат дрожжевой суспензии «раздавленная капля» и микроскопировать его с объективом 40×.
Подготовка посевного материала
Дрожжи стерильно пересевают с музейного косяка на свежий косяк сусло-агара. Затем пересеянные косяки помещают в термостат при температуре 36о С и выдерживают их там в течение 24 часов. Выращенную культуру дрожжей смывают с косяка в стерильных условиях стерильным физиологическим раствором из расчета 5 мл физраствора на 1 косяк. Полученную суспензию дрожжей стерильно переносят в начальные колбы со стерильной питательной средой, куда вносят 2 мл суспензии дрожжей.
Условия культивирования
Культивирование ведут на перемешивающем устройстве (качалке). В процессе ферментации поддерживают следующие условия: температура 36о С, число оборотов качалки 200-220 мин -1. Длительность ферментации составляет 24 часа. Отбор проб в первые 6-8 часов производят через каждые 1,5-2 часа, причем первая проба отбирается сразу после посева культуры в питательную среду. Последняя проба отбирается по истечении 24 часов культивирования.
В каждой пробе определяют оптическую плотность и, пользуясь калибровочным графиком, определяют концентрацию биомассы дрожжей. Далее рассчитывают содержание белка в биомассе, а также определяют концентрацию этанола и глюкозы по методикам, указанным ниже.
Пользуясь препаратом дрожжевой суспензии «раздавленная капля», в рабочих тетрадях изображают морфологическую картину для каждой отобранной пробы и анализируют наличие гликогена в клетках дрожжей.
Расчетная часть
1. Построить и проанализировать график зависимости концентрации углеродного субстрата в среде в зависимости от времени.
2. Используя экспериментальные данные, построить логарифмическую кривую роста и определить длительность фаз.
3. Вычислить значения удельной скорости роста μ по фазам роста и представить эти данные в графическом виде.
4. Рассчитать значения экономического коэффициента и метаболического коэффициента по фазам роста.
5. Вычислить выход по энергии, кислороду и белку для дрожжей.
Результаты экспериментальных исследований и расчетов свести в табл. 2.3 и 2.4.
Таблица 2.3 – Экспериментальные данные, полученные при культивировании дрожжей
| № пробы
| τ, час
| Х, г/л
| S, г/л
| Наличие гликогена
|
| 0
| 0
|
|
|
|
| 1
| 2
|
|
|
|
| 2
| 4
|
|
|
|
| 3
| 6
|
|
|
|
| 4
| 8
|
|
|
|
| 5
| 24
|
|
|
|
Таблица 2.4 – Расчетные показатели культивирования дрожжей по фазам роста
| Фазы роста
| Продолжительность фаз роста, час
| µ, час-1
| q, 
| Yx/s,
г АСБ/г субстрата
| Б,%
|
| лаг-фаза
|
|
|
|
|
|
| фаза ускорения роста
|
|
|
|
|
|
| логарифмическая фаза
|
|
|
|
|
|
| фаза замедления роста
|
|
|
|
|
|
| стационарная фаза
|
|
|
|
|
|
| фаза отмирания
|
|
|
|
|
|
Контрольные вопросы
1. Проведите сравнительный анализ роста дрожжей на глюкозе и этаноле. Объясните биохимические особенности утилизации того или иного субстрата, используя рис. 2.2.
2. Почему клетке, способной ассимилировать С2-соединения, необходим глиоксилатный шунт?
3. В каких условиях клетки дрожжей образуют уксусную кислоту?
4. Объясните роль источников минерального питания и факторов роста, которые вносятся в питательную среду для культивирования дрожжей.
5. Перечислите основные контролируемые и регулируемые параметры процесса культивирования дрожжей.
6. Каков критерий окончания процесса культивирования?
7. Каковы характерные признаки различных фаз роста?
8. Увеличиваются ли затраты на поддержание жизнедеятельности дрожжей в стационарной фазе роста?
9. На какой фазе роста содержание белка в клетках максимально?
10. Существует ли прямая корреляция между удельной скоростью роста и содержанием белка в биомассе?
11. Какие показатели представляют кинетические характеристики роста культуры?
12. Какие показатели отражают стехиометрию роста микроорганизмов?
Литература
1. Бирюков В.В. Основы промышленной биотехнологии. – М.: Высшая шк., 2004. – 356 с.
2. Манаков М.Н., Победимский Д.Г. Теоретические основы технологии микробиологических производств. – М.: Агропромиздат, 1990. – с. 97-99, 173-205.
3. Еникеев Ш.Г., Белялова З.М., Валеев Р.И. и др. Получение микробной биомассы на основе этилового спирта. – Казань: КХТИ, 1988. – 32 с.
4. Кантере В.М. Теоретические основы технологии микробиологических производств. – М.: Агропромиздат, 1990. – 271 с.
5. Решетник О.А. Общая микробиология. – Казань: КХТИ, 1984. – с. 59-66.
6. Егоров Т.А., Клунова С.М., Живухина Е.А. Основы биотехнологии. – М.: Академия, 2003. – 208 с.
7. Микробная биотехнология / Лещинская И.Б. Куриненко Б.М., Вершинина В.И. и др. – Казань: Унипресс: ДАС, 2000. – 368 с.
8. Елинов Н.П. Основы биотехнологии. – С-Пб.: Наука, 1995. – 600 с.
9. Беккер М.Е., Лиепиныш Г.К., Райпулис Е.П. Биотехнология. – М.: Агропромиздат, 1990. – 334 с.
10. Промышленная микробиология / Под ред. Н.С. Егорова. – М.: Высшая школа, 1989. – 688 с.
Экспериментальная часть
1. Провести короткое (до 12 часов) культивирование дрожжей р. Candida на питательной среде (ПС) с различными начальными концентрациями субстрата (этанола): 0,1 %; 0,3 %; 0,5 %. Внесение остальных компонентов питательной среды проводить согласно указаниям в лабораторной работе 2.
Условия периодического культивирования с использованием перемешивающего устройства («качалки»): t = 36o С, n = 220 об/мин.
По окончании лаг-фазы в начале экспоненциальной фазы роста (обычно через 1,5 часа для данных условий культивирования) добавить в среду ингибитор – 1 % раствор CuSO4×5Н2О. Провести 12 часовые контрольные (без ингибитора) и опытные (с ингибитором) ферментации.
Схема ферментации представлена ниже:
а) Без ингибитора (контроль):
ПС(V = 200 мл) + 0,2 мл + 0,2 мл + этанол + 20 мл →
раствор раствор 2 мл
микро- витаминов S=0,1 % посевной
элементов S=0,3 % материал
S=0,5 %
внести в 9 качалочных колб по 20 мл в каждую колбу.
б) С ингибитором (опыт) аналогично а)+0,5 мл 1% раствора CuSO4×5Н2О:
ПС(V = 200 мл) + 0,2 мл + 0,2 мл + этанол + 20 мл + 0,5 мл →
раствор раствор 2 мл
микро- витаминов S=0,1 % посевной раствор
элементов S=0,3 % материал CuSO4×5Н2О
S=0,5 %
внести в 9 качалочных колб по 20 мл в каждую колбу.
Расчетная часть
1. По экспериментальным данным, полученным в опытных и контрольных ферментациях, построить кривые роста дрожжевой культуры D = f(τ) и определить из них µmax.
Результаты представить в виде обобщающей таблицы 3.1. (Значения концентрации субстрата (этанола) для построения зависимостей Лайнуивера-Берка следует пересчитать в г/л).
Таблица 3.1 – Экспериментальные данные и расчетные показатели серии ферментаций в методе острых опытов
| №
пробы
| τ, час.
| D
| µ, час -1
| S,
г/л
| 1/ S
| 1/µmax
|
| без ингибитора
| с ингибитором
| без ингибитора
| с ингибитором
|
| Начальная концентрация субстрата 0,1 % вес.
|
| 1
| 0
|
|
|
|
|
|
|
|
| 2
| 3
|
|
|
|
|
|
|
|
| 3
| 6
|
|
|
|
|
|
|
|
| 4
| 9
|
|
|
|
|
|
|
|
| 5
| 12
|
|
|
|
|
|
|
|
| Начальная концентрация субстрата 0,3 % вес.
|
| 1
| 0
|
|
|
|
|
|
|
|
| 2
| 3
|
|
|
|
|
|
|
|
| 3
| 6
|
|
|
|
|
|
|
|
| 4
| 9
|
|
|
|
|
|
|
|
| 5
| 12
|
|
|
|
|
|
|
|
| Начальная концентрация субстрата 0,5 % вес.
|
| 1
| 0
|
|
|
|
|
|
|
|
| 2
| 3
|
|
|
|
|
|
|
|
| 3
| 6
|
|
|
|
|
|
|
|
| 4
| 9
|
|
|
|
|
|
|
|
| 5
| 12
|
|
|
|
|
|
|
|
2. Далее определить тип ингибирования графически с использованием зависимостей Лайнуивера-Берка (1/µ = f (1/ S)).
 1/µ 1/µ
1/µ 1/µ

 1/µmax 1/µmax
1/µmax 1/µmax

 1/µmax
1/µmax
K 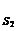 K
K 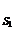 1/ S K
1/ S K  1/ S
1/ S
конкурентное неконкурентное
ингибирование ингибирование
1/µ
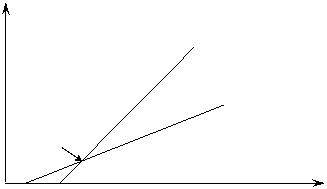
1/µmax
K 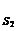 K
K  1/ S
1/ S
смешанное
ингибирование
Контрольные вопросы
1. Для каких исследовательских целей применяется метод острых опытов?
2. Какие условия должны соблюдаться при использовании метода острых опытов для изучения экспоненциально растущей культуры?
3. Приведите пример механизма действия неспецифического ингибитора.
4. Приведите пример механизма действия специфического ингибитора.
5. Как вы понимаете термин «степень токсичности»?
6. Для каких целей используются ингибиторы неспецифического действия?
7. Каким образом ионы Cu2+ поступают в клетки культуры р. Candida?
8. Опишите физиологическое состояние культуры р. Candida при воздействии на нее ионов меди?
9. При каком способе культивирования (периодическом или непрерывном) клетки могут выдержать более высокую концентрацию ингибитора?
Литература
1. Роботнова И.Л., Позмогова И.Н. Хемостатное культивирование и ингибирование роста микроорганизмов. М.: Наука, 1979. – 208 с.
2. Печуркин Н.С. и др. Популяционные аспекты биотехнологии / Н.С. Печуркин, А.В. Брильков, Т.В. Марченкова. Новосибирск: Наука, 1990. – 112 с.
3. Ашмарин И.П., Ключарёв Л.А. Ингибиторы синтеза белка. – Л.: Медицина, 1975. – 208 с.
4. Кантере В.М. Теоретические основы технологии микробиологических производств. – М.: Агропромиздат, 1990. – 271 с.
5. Манаков М.Н., Победимский Д.Г. Теоретические основы технологии микробиологических производств. – М.: Агропромиздат, 1990. – с. 144-172, 144-270.
Примерные темы самостоятельных работ к семинарским занятиям
1. Основные принципы регуляции обмена веществ у микроорганизмов
2. Особенности регуляции метаболизма в клетках эукариотных микроорганизмов
3. Внеклеточные ферменты микроорганизмов.
4. Основные положения термодинамики в приложении к биохимическим реакциям
5. Влияние температуры на скорость ферментативных реакций
6. Иммобилизация клеток микроорганизмов
7. Биопленки: характеристика развития, структуры и функций.
8. Иммобилизация ферментов
9. Диффузионные ограничения в процессах культивирования микроорганизмов
10. Генная инженерия: принципы и перспективы.
А.С. Сироткин, В.Б. Жукова
Теоретические основы биотехнологии
Учебно-методическое пособие

 Методические разработки
Методические разработки
кафедры промышленной
биотехнологии
Казань, 2009
УДК 577.15:663/664(075.8)
Теоретические основы биотехнологии: Учебно-методическое пособие /А.С. Сироткин, В.Б. Жукова; Казан. гос. технол. ун-т, Казань, 2009. 50 с.
Учебно-методическое пособие по дисциплине «Теоретические основы биотехнологии» предназначено для студентов, обучающихся по специальности 24090165 – Биотехнология, а также по направлению подготовки бакалавров и магистров 550800 – Химическая технология и биотехнология.
Пособие содержит теоретические сведения из соответствующего лекционного курса, читаемого на кафедре промышленной биотехнологии по очной и очно-заочной формам обучения. Лекционный материал поддерживает осознанное выполнение заданий к лабораторным работам, а также помогает студентам успешно подготовиться к сдаче коллоквиумов по тематическим разделам учебной дисциплины, итоговых зачета и экзамена.
В части лабораторного практикума изучаются кинетические закономерности гибели микроорганизмов в процессе термического воздействия на микробные суспензии; роста микробных популяций на различных субстратах и рассматриваются аналитические методы определения параметров процесса культивирования клеток; исследуется влияние ингибиторов на рост микроорганизмов при различных способах культивирования.
В оформлении методического пособия принимала участие ведущий программист И.П. Мужиковская.
 Подготовлено на кафедре промышленной биотехнологии.
Подготовлено на кафедре промышленной биотехнологии.
Табл. 8, Ил. 10. Библиогр. 24 ист.
Печатается по решению редакционно-издательского совета Казанского государственного технологического университета.
| Рецензенты:
| заведующий кафедрой «Водные ресурсы и аквакультура» Казанского государственного энергетического университета, д.б.н., профессор М.Л. Калайда
профессор кафедры технологии пищевых производств Казанского государственного технологического университета, д.б.н., профессор Ежкова Г.О.
|
© Казанский государственный технологический университет, 2009 г.
Оглавление
| Введение
| 4
|
| Тема 1. Асептика в биотехнологических процессах.
Стерилизация оборудования, питательных сред и воздуха
Лабораторная работа 1. Изучение кинетики гибели микроорганизмов
Контрольные вопросы
Литература
|
5
11
17
17
|
| Тема 2. Метаболизм углеродсодержащего субстрата. Периодическое культивирование дрожжей на различных углеродных субстратах
Лабораторная работа 2. Кинетика и стехиометрия роста микроорганизмов
Контрольные вопросы
Литература
|
18
25
36
36
|
| Тема 3. Ингибирование роста микроорганизмов в условиях периодического культивирования
Лабораторная работа 3. Изучение влияния ингибиторов на рост микробной культуры методом острых опытов
Контрольные вопросы
Литература
|
37
44
48
48
|
| Примерные темы самостоятельных работ к семинарским занятиям
|
|
|
|




 Методические разработки
Методические разработки Подготовлено на кафедре промышленной биотехнологии.
Подготовлено на кафедре промышленной биотехнологии.

 h в
h в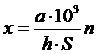 ,
, ;
;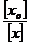 ;
;
 ln k
ln k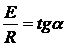 .
.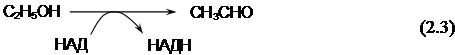



 Рис. 2.2 – Биохимическая схема ассимиляции
Рис. 2.2 – Биохимическая схема ассимиляции
 1/µ 1/µ
1/µ 1/µ


 1/µmax 1/µmax
1/µmax 1/µmax

 1/µmax
1/µmax K
K  1/ S K
1/ S K  1/ S
1/ S



