Эпштейна – Барр вирусная инфекция как манифестная форма болезни встречается редко, хотя около 90 % взрослого населения мира заражены вирусом Эпштейна – Барр (ВЭБ), будучи пожизненными его носителями. В развитых странах около 50 % детей в возрасте до пяти лет являются бессимптомными носителями ВЭБ или его носителями с показателями умеренного повышения активности печеночных ферментов. Заражение в подростковом возрасте, кроме бессимптомного течения, может манифестировать в виде остро протекающей нозологической формы – инфекционного мононуклеоза (в 30 % случаев). В развивающихся странах практически каждый ребенок в возрасте до 5 лет инфицирован этим вирусом, в развитых странах в возрасте до 20 лет инфицировано около 50 % населения. С более поздним инфицированием связаны различия в течении инфекции в различных странах. В 2/3 случаев заболевание протекает бессимптомно, а у 1/3 в виде инфекционного мононуклеоза («поцелуйная болезнь», «болезнь женихов», «болезнь студентов»).
Вирус Эпштейна – Барр, помимо инфекционного мононуклеоза, является этиологическим фактором лимфомы Беркитта, носоглоточной карциномы, лимфогранулематоза, а у больных с иммунодефицитом – В‑клеточной лимфомы. В некоторых случаях развиваются заболевания центральной нервной системы (энцефалиты, параличи некоторых нервов, в частности, лицевого). Возможно, что с ВЭБ связан синдром хронической усталости.
Механизм передачи Эпштейна – Барр вирусной инфекции главным образом контактный (при оральном сексе и поцелуях) и воздушно‑капельный. Инфицируются в основном дети и молодежь. От 50 до 85 % детей развивающихся стран инфицированы ВЭБ, заражение происходит от матерей.
Инфекционный мононуклеоз (син.: болезнь Филатова, железистая лихорадка, моноцитарная ангина, болезнь Пфейфера и др.) характеризуется лихорадкой, генерализованной лимфаденопатией, тонзиллитом, увеличением печени и селезенки, характерными изменениями гемограммы, в ряде случаев может принимать хроническое течение.
Исторические сведения. Н. Ф. Филатов в 1885 г. первым обратил внимание на лихорадочное заболевание с увеличением лимфатических узлов и назвал его идиопатическим воспалением лимфатических желез. Описанное Н. Ф. Филатовым заболевание долгие годы носило его имя – болезнь Филатова. В 1889 г. немецкий ученый Е. Пфейфер описал аналогичную клиническую картину заболевания, определив его как железистую лихорадку с развитием у больных лимфополиаденита и поражения зева.
Этиология. ВЭБ впервые выделен из клеток злокачественной лимфомы Беркитта в 1964 г. британским вирусологом M. A. Epstein и канадским вирусологом Y. M. Barr (совместно с B. G. Achong) и назван именем этих ученых, которые его культивировали. Возбудитель относится к ДНК‑содержащим лимфопролиферативным вирусам семейства Herpesviridae. Особенностью его является способность реплицироваться только в В‑лимфоцитах приматов, не вызывая при этом лизиса пораженных клеток, в отличие от других вирусов герпетической группы, которые способны репродуцироваться в культурах многих клеток, лизируя их. Другие важные особенности возбудителя инфекционного мононуклеоза состоят в его способности персистировать в культуре клеток, оставаясь в репрессированном состоянии, и к интеграции в определенных условиях с ДНК клетки хозяина.
Эпидемиология. Источником инфекции является больной человек и вирусоноситель. От больного человека к здоровому возбудитель передается воздушно‑капельным путем. Допускается возможность контактного, алиментарного и трансфузионного пути распространения инфекции, что на практике реализуется крайне редко. Заболевание отличается низкой контагиозностью. Заражению способствует скученность и тесное общение больных и здоровых людей.
Инфекционный мононуклеоз регистрируется преимущественно у детей и лиц молодого возраста, после 35 – 40 лет встречается как исключение. Заболевание выявляется повсеместно в виде спорадических случаев с максимумом заболеваемости в холодное время года. Возможны семейные и локальные групповые вспышки инфекционного мононуклеоза.
Патогенез и патологоанатомическая картина. Возбудитель проникает в организм через слизистые оболочки ротоглотки и верхних дыхательных путей. В месте внедрения возбудителя наблюдаются гиперемия и отечность слизистых оболочек.
В патогенезе инфекционного мононуклеоза выделяют 5 фаз. За I фазой – внедрением возбудителя – следуют II – лимфогенный занос вируса в регионарные лимфатические узлы и их гиперплазия, затем III – вирусемия с рассеиванием возбудителя и системной реакцией лимфоидной ткани, IV – инфекционно‑аллергическая и V – выздоровление с развитием иммунитета.
В основе патологоанатомических изменений при инфекционном мононуклеозе лежит пролиферация элементов системы мононуклеарных фагоцитов, диффузная или очаговая инфильтрация тканей атипичными мононуклеарами. Реже при гистологическом исследовании выявляются очаговые некрозы в печени, селезенке, почках.
Иммунитет после перенесенного заболевания стойкий.
Клиническая картина. Инкубационный период составляет 5 – 12 дней, иногда до 30 – 45 дней. В некоторых случаях заболевание начинается с продромального периода продолжительностью 2 – 3 дня, когда наблюдаются повышенная утомляемость, слабость, понижение аппетита, мышечные боли, сухой кашель. Обычно же начало болезни острое, отмечаются высокая температура тела, головная боль, недомогание, потливость, боли в горле.
Кардинальными признаками инфекционного мононуклеоза являются лихорадка, поражение зева, гиперплазия лимфатических узлов, увеличение печени, селезенки.
Лихорадка чаще неправильного или ремиттирующего типа, возможны и другие варианты. Температура тела повышается до 38 – 39 °C, у некоторых больных заболевание протекает при субфебрильной или нормальной температуре. Продолжительность лихорадочного периода колеблется от 4 дней до 1 мес. и более.
Лимфаденопатия (вирусный лимфаденит) – наиболее постоянный симптом заболевания. Раньше других и наиболее отчетливо увеличиваются лимфатические узлы, находящиеся под углом нижней челюсти, за ухом и сосцевидным отростком (т. е. по заднему краю грудино‑ключично‑сосцевидной мышцы), шейные и затылочные лимфатические узлы. Обычно они увеличены с обеих сторон, но встречаются и односторонние поражения (чаще слева). С меньшим постоянством в процесс вовлекаются подмышечные, паховые, локтевые, медиастинальные и мезентериальные лимфатические узлы. Они увеличиваются до 1 – 3 см в диаметре, плотноватой консистенции, мало болезненны при пальпации, не спаяны между собой и подлежащими тканями. Обратное развитие лимфатических узлов наблюдается к 15 – 20‑му дню болезни, однако некоторая припухлость и болезненность могут держаться длительное время. Иногда вокруг лимфатических узлов отмечается небольшая отечность тканей, кожа над ними не изменена.
С первых дней заболевания, реже в более поздние сроки развивается самый яркий и характерный признак инфекционного мононуклеоза – поражение зева, которое отличается своеобразием и клиническим полиморфизмом. Ангина может быть катаральной, фолликулярной, лакунарной, язвенно‑некротической с образованием в ряде случаев фибринозных пленок, напоминающих дифтерийные. При осмотре зева видны умеренная гиперемия и отечность миндалин, языка, задней стенки глотки, на миндалинах в большинстве случаев выявляются различные по величине беловато‑желтоватые, рыхлые, шероховатые, легко снимающиеся налеты. Нередко в процесс вовлекается носоглоточная миндалина, в связи с чем у больных появляется затруднение носового дыхания, гнусавость, храп во сне.
Гепато– и спленомегалия – закономерные проявления болезни. Печень и селезенка выступают из‑под края реберной дуги на 2 – 3 см, но могут увеличиваться и более значительно. У части больных отмечается нарушение функций печени: легкая иктеричность кожи, склер, небольшое увеличение активности аминотрансфераз, содержания билирубина, активности щелочной фосфатазы, повышение тимоловой пробы.
У 3 – 25 % больных появляется сыпь – пятнисто‑папулезная, геморрагическая, розеолезная, типа потницы. Сроки высыпаний различны.
При инфекционном мононуклеозе наблюдаются характерные изменения гемограммы. В разгар заболевания появляется умеренный лейкоцитоз (9 – 25 % 109/л), относительная нейтропения с более или менее выраженным палочкоядерным сдвигом, встречаются и миелоциты. Значительно увеличивается содержание лимфоцитов и моноцитов. Особенно характерно появление в крови атипичных мононуклеаров (до 10 – 70 %) – одноядерных клеток среднего и крупного размера с резко базофильной широкой протоплазмой и разнообразной конфигурацией ядра. СОЭ нормальная или несколько повышенная. Атипичные клетки крови обычно появляются на 2 – 3‑й день болезни и держатся 3 – 4 нед., иногда несколько месяцев.
Единой классификации клинических форм инфекционного мононуклеоза нет. Заболевание может протекать как в типичной, так и в атипичной форме. Последняя форма характеризуется отсутствием или, напротив, чрезмерной выраженностью какого‑либо из основных симптомов инфекции. В зависимости от тяжести клинических проявлений различают легкую, средней тяжести и тяжелую формы болезни.
Осложнения. Встречаются редко. Наибольшее значение среди них имеют отиты, паратонзиллиты, синуситы, пневмония. В единичных случаях встречаются разрывы селезенки, острая печеночная недостаточность, острая гемолитическая анемия, миокардит, менингоэнцефалит, неврит, полирадикулоневрит.
Прогноз благоприятный.
Диагностика. Хотя инфекционный мононуклеоз самостоятельная нозологическая форма, необходимо обратить внимание на тот факт, что диагноз «инфекционный мононуклеоз» следует считать синдромальным до этиологической верификации, так как симптомосходные с вирусом Эпштейна – Барр заболевания вызывают ЦМВ, HHV‑6, ВИЧ, возможно, и другие вирусы.
Клиническая диагностика инфекционного мононуклеоза основывается на совокупности характерных признаков заболевания – лихорадки, поражения зева, лимфаденопатии, гепатоспленомегалии и данных клинического анализа крови – наличии атипичных мононуклеаров не менее 10 % при двойном исследовании с интервалом 5 – 7 дней.
Инфекционный мононуклеоз дифференцируют от ангин, дифтерии, краснухи, острых респираторных заболеваний (аденовирусная инфекция), псевдотуберкулеза, туляремии, листериоза, вирусного гепатита, острого лейкоза, лимфогранулематоза.
Из лабораторных методов исследования применяют ИФА и НРИФ для обнаружения специфических антител (уже в первые дни выявляются антитела класса IgM к капсидному антигену, а позже антитела к раннему антигенному комплексу). С помощью иммуноблотинга определяют антитела к определенным белкам вируса. ПЦР позволяет выявить инфицированность ВЭБ, но не отвечает на вопрос о характере инфекционного процесса, в частности дифференциации первичной инфекции от латентной. К тому же ПЦР выявляет вирус только в период репликации, поэтому так высок удельный вес ложноотрицательных результатов при этой инфекции.
Лечение. На стационарное лечение госпитализируются дети с среднетяжелым и тяжелым течением болезни.
Из этиотропных препаратов используют ацикловир, который назначают в дозе 400 – 800 мг внутрь 5 раз в сутки в течение 7 – 10 дней. Правда, он эффективен при волосатой лейкоплакии рта, иногда при хронической форме в активной фазе, поражении ЦНС и не эффективен при лимфопролиферативном синдроме. Из новых методов лечения используют переливание донорских Т‑лимфоцитов, специфических цитотоксических Т‑лимфоцитов. Разработаны методы лечения иммуноглобулинами человека против ВЭБ, содержащими специфические IgG.
Проводится гипосенсибилизирующее, симптоматическое и общеукрепляющее лечение, включающее введение витаминов С, Р и группы В. Антибиотики при неосложненном течении инфекции не показаны, их назначают только в случае присоединения вторичной микрофлоры. При тяжелом течении инфекционного мононуклеоза используют глюкокортикостероидные гормоны коротким курсом (7 – 8 дней по 1 – 1,5 мг/кг/сут), проводят дезинтоксикационную терапию. Во всех случаях необходимы полоскание зева растворами йодинола, фурацилина и других антисептиков, согревающие компрессы на шею.
Профилактика. Госпитализация больных осуществляется по клиническим показаниям. Наблюдение за контактными людьми не устанавливается, дезинфекционные мероприятия не проводятся. Специфическая профилактика не разработана.
Лимфома Беркитта. Среди злокачествнных форм поражения лимфоидной ткани выделяются лимфогранулематоз (син. болезнь Ходжкина) и неходжкинские лимфомы (син. лимфосаркомы). Под лимфомой понимают опухоли, исходящие из лимфоидной ткани, а по типу роста – нодулярные и диффузные, причем первые часто трансформируются во вторые. По клеточному составу диффузные лимфомы дифференцируются на небластные, включающие лимфоцитарные, пролимфоцитарные, лимфоплазмоцитарные клетки, и бластные, представленные лимфобластами. В последней группе при ВИЧ‑инфекции наибольший интерес представляют лимфома Беркитта (африканская лимфома), этиологически связанная с ВЭБ. Как все бластные лимфомы, она характеризуется злокачественным течением и быстрой генерализацией.
Патогенез лимфомы Беркитта у большинства больных нашего региона тесно связан с ВИЧ‑инфекцией. В результате иммуносупрессии развивается суперинфекция, обусловленная ВЭБ. В этих условиях возможны также генетические «ошибки», что ведет к моноклональной В‑клеточной лимфоме.
К кофакторам быстрого прогрессирования лимфомы относятся: число CD4+‑клеток < 100 в мкл; возраст старше 35 лет; анамнез инъекционного наркопотребителя; III или IV стадия ВИЧ‑инфекции. Средняя продолжительность жизни больных с 2 или 3 такими факторами в среднем составляет 45 нед. против 18 нед. у больных с 3 и более плохими прогностическими факторами. Развития лимфомы у больных ВИЧ‑инфекцией в стадии СПИДа в 100 раз выше, чем в популяции в целом.
Клиническая картина. Выделяют 4 стадии лимфомы, у больных ВИЧ‑инфекцией чаще выявляют стадию 4 с различной локализацией онкопроцесса (табл. 27). Причем первичная лимфома ЦНС встречается у 1 – 3 % больных ВИЧ/СПИДом и обычно развивается при количестве CD4+‑лимфоцитов менее 50 в мкл.
Таблица 27
Клинические проявления СПИД‑ассоциированной лимфомы Беркитта

На Африканском континенте до эпидемии ВИЧ‑инфекции лимфома чаще развивалась у больных малярией, способствующей активизации ВЭБ.
Клинически при лимфоме Беркитта у половины больных выявляется первичное поражение периферических, внутригрудных, забрюшинных лимфатических узлов. Процесс развивается в миндалинах, желудочно‑кишечном тракте, коже, костях или других органах.
Заболевание протекает с явлениями интоксикации, лихорадкой, исхуданием, ночными потами, локальным зудом, для клинической картины характерны также аутоиммунная гемолитическая анемия, тромбоцитопения, экзантема.
В случаях поражения лимфатических узлов чаще на шее или надключичной области лимфатические узлы увеличены в размерах (см. цветную вклейку, рис. 19), плотноэластической консистенции, подвижны, так как не спаяны с окружающей клетчаткой.
При поражении лимфатических узлов средостения развивается синдром верхней полой вены (расширение вен передней грудной стенки). При поражении миндалин появляется ощущение инородного тела в горле, миндалина быстро увеличивается в размерах. При локализации лимфомы в желудке, чаще в его теле или антральной области клиника напоминает рак или язвенную болезнь. Поражение толстой кишки напоминает также клинику рака. Возможны поражения и паренхиматозных органов.
Лечение системной СПИД‑связанной лимфомы включает поливалентную химиотерапию даже при относительно локализованной лимфоме. Первоначально использовали стандартную интенсивно‑дозовую схему химиотерапии, но полная ремиссия достигалась редко, а наслоение суперинфекции – часто. Применение низкодозовой модификации с дополнительным использованием цитозин‑арабинозы для защиты ЦНС позволило добиться ремиссии в половине случаев. Другая схема с использованием инфузии циклофосфамида (750 мг/кв. м), доксорубицина (50 мг/кв. м) и этопозида (240 мг/кг) в течение 4 дней, с повторными курсами каждые 28 дней (всего 6 курсов), позволила добиться ремиссии в 60 %. Комбинированное применение поливалентной химиотерапии и активной антиретровирусной терапии (циклофосфамид + диксорубиин + этопозид + саквинавир + ставудин + диданозин) повышает частоту побочных эффектов: в 3 – 4 раза увеличивается уровень мукозидов. Летальность снижается до 13 % против 83 % у не получавших активной антиретровирусной терапии.
10.1.5. HHV‑8 инфекция – саркома Капоши
Саркома Капоши (cин. ангиосаркома Капоши или множественный геморрагический саркоматоз) – множественные злокачественные новообразования кожи вирусной этиологии. Впервые описана венгерским дерматологом М. Капоши в 1872 г. как «идиопатическая, множественная пигментная саркома кожи», названа его именем. Занимает первое место среди злокачественных новообразований у больных ВИЧ‑инфекцией.
Этиология. В 1995 г. Y. Chang и P. S. Moore описали новый человеческий вирус, отнесенный к группе Herpesviridae, первоначально названный «с саркомой Капоши ассоциированный герпесвирус», позже получивший название человеческий герпесвирус, тип 8 (HHV‑8). ДНК этого вируса постоянно обнаруживается в ткани СПИД‑ассоциированной саркомы Капоши, в то время как в нормальной ткани соседних участков она не выявляется. В последующие годы было установлено, что HHV‑8 связан со всеми типами саркомы Капоши, включая эндемическую у африканцев, классическую у пожилых людей Средиземноморья и трансплантатсвязанную. Показано, что развитию саркомы Капоши предшествует перенесенная за 3 – 10 лет инфекция, вызванная HHV‑8.
Герпесвирус‑8 встречается примерно у 30 % ВИЧ‑положительных геев и бисексуалов и только у 2 – 3 % ВИЧ‑положительных гетеросексуалов, у гетеросексуальных женщин герпесвирус‑8 встречается в 3 – 4 % случаев.
Эпидемиология. Заболеваемость саркомой Капоши интенсивно нарастала в первое десятилетие пандемии ВИЧ‑инфекции, главным образом у мужчин‑гомосексуалистов. В последующие годы она стала встречаться значительно реже (табл. 28). Снижение ее совпадает с ростом применения комбинации антиретровирусной терапии, в частности внедрения в практику ингибиторов протеаз.
Таблица 28
Число больных СПИДом с предполагаемым или точным наличием саркомы Капоши по годам (CDC) на декабрь 1992 г.

В исследованиях, проведенных в Сан‑Франциско при обследовании 60 704 мужчин‑гомосексуалистов S. Buchbinder [et al.]. (1997) показано, что с внедрением комбинированной высокоактивной антиретровирусной терапии встречаемость саркомы Капоши снизилась с 3 на 100 инфицированных до 0 в 1996 г.
Механизм передачи HHV‑8 неизвестен. С помощью ПЦР одни авторы вирус обнаруживали в семенной жидкости и сперме, хотя другие этого не подтвердили. HHV‑8 был выявлен в эндотелиальных клетках, циркулирующих в CD20+‑лимфоцитах (В‑клетки), носовом секрете, бронхоальвеолярной лаважной жидкости у больных с легочной локализацией саркомы Капоши.
В последний год появились сообщения, что HHV‑8 может передаваться вертикально от матери к плоду и от матери к ребенку через слюну, гемоконтактно среди потребителей инъекционных наркотиков, использующих общие иглы.
Патогенез и патологоанатомическая картина. Существует несколько теорий патогенеза саркомы Капоши, в настоящее время считается, что ведущими патогенетическими факторами служат наличие вирусной инфекции, нарушение иммунитета и неоваскуляризация за счет пролиферации эндотелия кровеносных и лимфатических сосудов. Большинство ученых сейчас придерживаются мнения, что саркому Капоши вызывает герпесвирус‑8, тем не менее сам по себе этот вирус не может ее вызвать, заболевание может развиться у людей только при значительном иммунодефиците, таком как ВИЧ‑инфекция в стадии СПИДа, у лиц, получающих иммуносупрессанты, что создает условия для репликации вируса с развитием онкологического заболевания.
Хотя установлена связь между развитием саркомы Капоши и инфекцией, вызываемой HHV‑8, но при эпидемическом типе саркомы Капоши у больных находят человеческий Т‑лимфоцитарный вирус III типа, а при эндемическом – ЦМВ. Длительная персистенция указанных вирусов в организме может приводить к развитию вторичного иммунодефицита, однако пока неясно, служит ли снижение иммунитета фактором, способствующим реактивации вирусов.
Первоначально предполагалось, что иммунодефицит является предпосылкой развития саркомы Капоши. Так, еще до пандемии ВИЧ‑инфекции выявили, что у рецепиентов почек формируется иммуносупрессия и чаще развивается ятрогенная форма саркомы Капоши. После отмены иммуносупрессантов клиническая картина регрессирует. Пандемия, казалось, укрепила эту точку зрения. Но через несколько лет после начала пандемии выявили, что у ряда ВИЧ‑инфицированных лиц саркома развивается при отсутствии иммуносупрессии, при нормальной функции иммунной системы. Стало очевидным, что ВИЧ‑инфекция может сопровождаться развитием саркомы Капоши без нарушения функции иммунной системы. Следовательно, механизм ее развития не коррелирует с иммунодефицитом. Дальше было установлено, что активация (а не депрессия!) иммунной системы играет существенную роль в патогенезе саркомы Капоши. Это положение первоначально трактовалось справедливым только для классического, эндемического и ятрогенного вариантов саркомы Капоши. Исследования показали, что у больных с классическим вариантом саркомы Капоши высок уровень анти‑ЦМВ. Это было расценено как стимулирующий эффект ЦМВ для развития саркомы. В африканском варианте саркомы Капоши широко распространенные паразитарные и инфекционные заболевания также расценивались как постоянный источник антигенного стимула, обеспечивающего развитие саркомы. В случаях ятрогенной саркомы Капоши постоянное инфицирование рецепиентов почек ЦМВ, ВЭБ, HSV также является источником постоянного антигенного стимула, обеспечивающего развитие саркомы. Этому же способствует действие аллотрансплантата. Затем было установлено, что СПИД‑ассоциируемую саркому Капоши стимулируют глюкокортикостероиды и такие иммуносупрессоры, как циклоспорин. Следовательно, лекарственные средства, обусловливающие снижение уровня CD8‑цитотоксических лимфоцитов и вследствие этого активацию иммунной системы, также способствуют развитию саркомы Капоши.
Гомо/бисексуалисты подвержены хроническому антигенному стимулу за счет постоянного инфицирования половым путем различными грибами, простейшими, бактериями и вирусами. Антигенным стимулом служит и сперма. Постоянное травмирование слизистой оболочки кишечника облегчает проникновение антигенов с развитием ответной иммунной реакции. Поэтому у больных ВИЧ‑инфекцией гомо/бисексуалистов выше уровень встречаемости саркомы Капоши, причем вместо иммуносупрессии, наоборот, выявляются признаки иммунной активности. Очевидно, этим объясняется то обстоятельство, что ВИЧ‑инфицированные с ранним развитием саркомы Капоши живут дольше, чем те, у кого имеет место иммунодефицит с развитием прочих вторичных инфекций.
Вопрос о генетической предрасположенности к саркоме Капоши также изучался всесторонне. Так, было установлено, что у молодых итальянцев и евреев со СПИД‑ассоциированной саркомой Капоши и в определенных регионах Африки при эндемической ее форме имеет место кластерное распределение болезни, что свидетельствует о генетической предрасположенности. Также было показано, что частота саркомы коррелирует с HLA DR5 у итальянцев и евреев и HLA DR2 у других европейцев. Но число случаев саркомы Капоши среди членов одной семьи не велико и нет менделевского принципа ее наследования на популяционном уровне. Нет на популяционном уровне и зависимости распространения саркомы Капоши с принадлежностью HLA.
Гистологическая структура опухоли при саркоме Капоши характеризуется множеством хаотично расположенных тонкостенных новообразованных сосудов и пучков веретенообразных клеток. Характерна инфильтрация опухоли лимфоцитами и макрофагами. Сосудистый характер опухоли резко увеличивает риск кровотечений.
Саркома Капоши – особый вид опухоли, который часто не требует не только верификации диагноза, но и его лечения, так как поставить безошибочный диагноз можно и без биопсии, а изолированное лечение саркомы Капоши крайне редко дает полное исцеление. Более того, лечение саркомы Капоши (в силу своей связи с причинными факторами основного заболевания) обычно является паллиативным, т. е. направленным лишь на уменьшение симптомов заболевания. Множественные опухоли в основном локализуются на коже, но могут быть найдены на слизистой оболочке рта, гортани, легких, пищеварительного тракта или лимфатических узлов.
Саркома встречается реже у пожилых людей из Восточной Европы и Средиземноморья и является эндемичной для ряда регионов Африки. У этих больных она характеризуется медленным и безболезненным течением. Саркому Капоши чаще обнаруживают в трансплантированных органах в тех случаях, когда реципиент получает иммуносупрессивное лечение; она может самопроизвольно исчезать при уменьшении интенсивности иммуносупрессии.
Клиническая картина. Выделяют 4 типа саркомы Капоши:
– классический (спорадический, европейский);
– эндемический (африканский; встречается в странах Экваториальной Африки);
– эпидемический (возникает у лиц с синдромом приобретенного иммунодефицита);
– иммуносупрессивный (табл. 29).
По течению различают острую, подострую и хроническую формы.
Типичная локализация саркомы Капоши классического типа – стопы, боковые поверхности голени, поверхности кистей, редко на слизистых оболочках и веках. Границы очагов обычно четкие. Очаги поражения обычно симметричны, но редко могут быть зуд и жжение. По характеру очагов различают 3 клинические стадии: пятнистая, папулезная, опухолевая. На ранней, пятнистой стадии пятна красновато‑синюшного или красновато‑бурого цвета диаметром от 1 до 5 мм, неправильной формы, поверхность их гладкая. На папулезной стадии элементы сферической или полусферической формы, плотноэластической консистенции, от 2 мм до 1 см в диаметре. Обычно они изолированные, при слиянии образуют бляшки уплощенной или полушаровидной формы. Поверхность бляшек гладкая или шероховатая. На опухолевой стадии происходит образование единичных или множественных узлов диаметром 1 – 5 см, красно‑синюшного или синюшно‑бурого цвета.
Таблица 29
Сравнительная характеристика вариантов саркомы Капоши
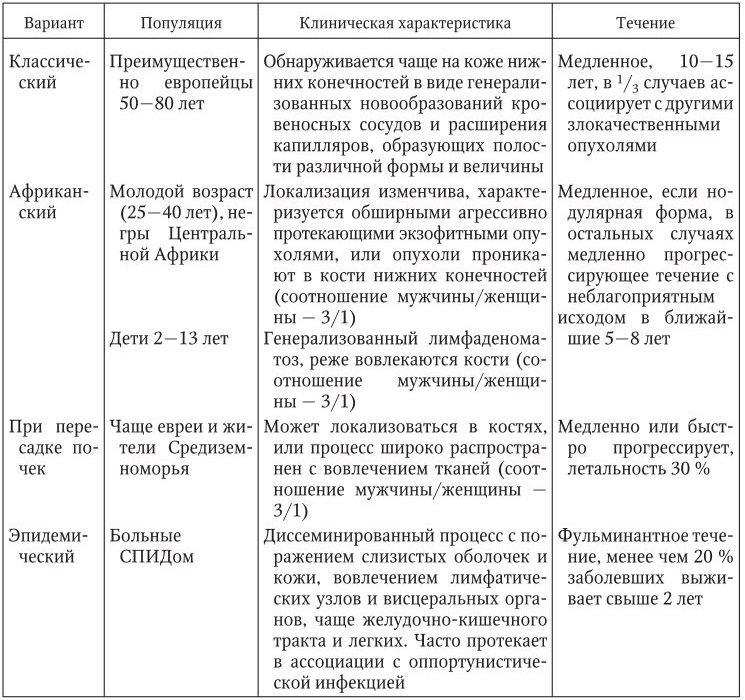
Эндемический вариант начинается преимущественно в детском возрасте, пик заболеваемости приходится на первый год жизни ребенка. Поражаются внутренние органы и главные лимфатические узлы, а кожные поражения редки и минимальны. Эпидемический тип саркомы Капоши, ассоциированный со СПИДом у больных молодого возраста, является наиболее достоверным симптомом ВИЧ‑инфекции. Характерна яркость окраски и «сочность» высыпных элементов, необычна их локализация – на кончике носа и слизистых оболочках, на твердом небе и верхних конечностях в сочетании с обязательным вовлечением лимфатических узлов и внутренних органов.
Иммуносупрессивный тип протекает, как правило, хронически и доброкачественно. Заболевание развивается после пересадки почки и назначения особых типов иммуносупрессоров. При отмене препаратов наступает регресс заболевания. Внутренние органы вовлекаются редко.
Течение саркомы Капоши подразделяется на несколько стадий (табл. 30). В 92 % случаев саркома Капоши проявляется локализацией патологического процесса на коже. Патологический процесс при саркоме Капоши у больных ВИЧ‑инфекцией в начальной фазе локализован, но по мере прогрессирования СПИД приобретает генерализованный характер.
Таблица 30









