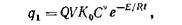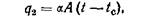Горением называют физико-химический процесс взаимодействия горючего вещества с окислителем (кислородом воздуха), в результате которого выделяется теплота и излучается свет. Это определение процесса горения характеризует обычные условия строительства.
Из химии известно, что в особых условиях окислителем в процессе горения может служить не только кислород, но и азотная кислота, хлор и др вещества. Кроме того, некоторые в-ва (например, сжатый ацетилен) могут взрываться (быстрое горение) без кислорода-с образованием теплоты и света. При этом происходит реакция разложения, а не соединения.
В общем случае процесс горения можно охарактеризовать так: горение быстро протекающая хим реакция окисления, сопровождающаяся выделением теплоты и излучением света.
Согласно теории окисления, в реакции с горючим веществом участвуют лишь те молекулы кислорода, запас энергии которых достигает энергии активации или превышает ее. Под энергией активации понимают тот минимум энергии, которым должны обладать взаимодействующие частицы, чтобы между ними произошла реакция.
Молекулы кислорода, обладающие энергией активации, приобретают активное состояние, т. е. такое, при котором одна из двух связей в молекуле О2 разорвана:
о=о-> — о—о—
Наличие свободных связей у атомов кислорода обеспечивает группе —О—О— высокую реакционную способность. Группа —О—О—, вступив в реакцию, образует перекись R—О—О—R или гидроперекись R—О—О—Н. Такие соединения нестойки — при нагревании, ударе или трении они распадаются. В результате распада образуются атомарный кислород, свободные радикалы и атомы, способствующие окислению новых порций горючего в-ва.
Перекисная теория получила развитие и дополнение в теории цепных реакций. Согласно этой теории, при воздействии на молекулы вещества избыточным кол-ом энергии (теплоты, лучистой энергии, эл. разряда) они поглощают некоторое количество теплоты и распадаются на атомы и радикалы (Н, С1, О, ОН, СН2, C2H5 и Др.). Возникшие промежуточные продукты, обладая повышенной хим. активностью, во вторичных реакциях восстанавливаются и могут продолжать реакцию. Продолжение первичной реакции создает цепную реакцию.
При эксплуатации строит машин кислород воздуха может соединяться с горючим веществом (например, сжигание топлива в топке асфальтосмесителя). Горение возможно и при отсутствии воздушной среды, если кислород входит в состав окислителей (например, горение порошка термита при сварочном процессе).
Процесс горения может возникнуть при наличии импульса, вызывающего воспламенение. Такими импульсами могут служить открытые, или светящиеся, источники — пламя, накаленная поверхность, лучистая энергия, искра и скрытые, или несвятящиеся,— трение, удар, адиабатическое сжатие, экзотермическая реакция. Некоторые источники воспламенения имеют следующую t° пламени, тления и нагрева, °С: пламя спички — 750...860,
тление папиросы —700...750, пламя древесной лучины-—850...1000.
На процесс горения сильно влияет продолжительность импульса воспламенения. Так, известно, что древесная доска загорается от пламени с t° 1200°С, воздействующего в течение 15...20 с. Но этот же материал не воспламеняется от горящего термита с t° 3000°С, а в доске лишь прожигается отверстие, если контакт с термитом длится 2...3 с.
При нормальном атмосферном давлении в-ва в воздушной среде могут гореть при содержании кислорода более 14%- При недостатке его в воздухе происходит неполное горение. Таким образом, процесс горения может возникнуть и протекать при наличии трех факторов: горючего вещества, окислителя и источника воспламенения. Процесс горения может быть диффузионным и кинетическим. При диффузионном горении горючее в-во и воздух не перемешаны друг с другом. В этом случае воздух соприкасается с поверхностью горючего вещества (как твердого, так и жидкого) и поступает к нему через продукты горения. Скорость горения будет зависеть от скорости диффузии кислорода воздуха в зону реакции. Диффузия — медленно протекающий процесс.
При кинетическом горении горючее в-во и воздух перемешаны между собой и представляют чаще всего смесь газов. Скорость горения в этом случае не зависит от диффузии воздуха, а определяется скоростью хим реакции и проявляется как взрыв или детонация.
Кол-во воздуха V°в, необходимого для горения горючего в-ва, зависит от его хим состава. Например, объем воздуха, потребный для горения 1 кг в-ва, составляет, м3: для древесины — 4,18, бензина—10,25, пропана — 23,8. В действительности в условиях пожара воздуха Vв расходуется в 2...10 раз больше против теоретической потребности.
Отношение Vв: V°в=cc называют коэффициентом избытка воздуха.
В результате горения образуются продукты сгорания в газообразном, жидком и твердом состоянии. При сгорании таких органических веществ, как древесина и бензин, образуются СО2, СО, H2O, N2. Дым содержит частицы углерода — сажу.
Для горючих в-тв характерно выделение теплоты при их сгорании (с единицы массы или объема), называемой теплотой сгорания. Теплоту сгорания делят на высшую и низшую. Низшая теплота сгорания отличается от высшей на величину теплоты испарения влаги, имеющейся в продуктах сгорания. Теплота, выделяющаяся из зоны горения, нагревает продукты сгорания; t°, достигнутая ими при этом, называется t° горения.
t° горения различают: калориметрическую, если продукты сгорания приобретают t° от всей выделяемой теплоты (допускается, что потери теплоты отсутствуют); теоретическую, когда учитывают потери теплоты на диссоциацию продуктов
сгорания при t° горения более 1700°; действительную, т. e. t° пожара с учетом потерь теплоты на нагревание здания, излучение и др.
Процесс нагревания горючей смеси в сосуде можно представить графически (рис. 133,а), когда по оси абсцисс откладывают t° стенки сосуда и горючей смеси t, а по оси ординат — скорости тепловыделения q1 и теплоотвода q 2 сосуда. При t 0, когда t° недостаточна, кислород воздуха в реакцию с горючим не вступает из-за отсутствия активных молекул. При нагревании смеси до t° t }. и выше в ней появляются активные молекулы и начинается реакция окисления с выделением теплоты. Скорость тепловыделения характеризуется кривой, уравнение которой

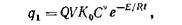
где Q —теплота сгорания горючей системы; V —объем горючей смеси; Ко — предэкспоненциальный множитель; С —концентрация горючего в системе; v—суммарный порядок реакции; Е — энергия активации; R — газовая постоянная; t — t° горючей смеси.
С повышением t° горючей системы t° стенок сосуда и окружающего воздуха также повышается, и при t°, например, t 2 начинается теплоотвод в окружающую среду. Скорость теплоотвода можно выразить графически прямой линией q 2, уравнение которой имеет вид
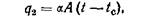
где а - коэффициент теплоотвода от горючей системы к стенкам сосуда; А — поверхность стенок сосуда; t и tc — t°горючей смеси и стенок сосуда. Линия теплоотвода пересекается с кривой тепловыделения в точке А. До этой точки соблюдалось условие q 1 > q 2, т. е. происходило самонагревание системы. В точке А при состоянии, характеризуемом q1=q2, окисление будет продолжаться и t° стенки сосуда повысится до tc1.
При дальнейшем нагревании сосуда, например до t° t3, t° стенки сосуда составит tc3, линия теплоотвода не пересечется с кривой тепловыделения, горючая система будет самонагреваться и при q 1 > q 2 начнется самовоспламенение.
При t° t2, промежуточной между t 1 и t 3, когда линия теплоотвода будет касаться кривой тепловыделения в точке В, наступает тепловое равновесие. Но как только наступит состояние q 1 > q 2, начнется самонагрев вещества, приводящий к его самовоспламенению.
Следовательно, t° самовоспламенения горючего вещества нужно считать наименьшую t° горючего вещества, при которой наступает самонагревание и начало горения.
Зависимость t° нагрева в-ва от времени показана на рис. 133,6. Точкой t н обозначено начало нагрева горючей системы. На отрезке t н — 10 затрачиваемая теплота расходуется на плавление, разложение и испарение горючего в-ва. В точке t 0 начинается окисление, и за счет теплоты реакции окисления t° в-ва возрастает быстрее. Когда тепловыделение из горючего вещества превысит теплоотдачу в окружающую среду, это в-во самовоспламенится в точке tc. Пламя появится в точке tп. Точкой tг обозначена t° горения.
Температура самовоспламенения некоторых веществ и материалов следующая, °С: бензина — 255...300, древесины сосновой — 399, линолеума резинового — 410, плит древесноволокнистых — 345, войлока строительного — 370°С.
Исходя из t° самовоспламенения, горючие в-ва подразделяют на два вида: с t° самовоспламенения выше t° окружающей их среды. Они самовоспламеняются лишь при нагреве их выше t° окружающей среды; такие в-ва, t° воспламенения которых ниже t° окружающей среды. Они воспламеняются без нагревания, т.к. окружающей их средой бывают нагреты до t° самовоспламенения; их называют самовозгорающимися в-ми, а появление горения — самовозгоранием.
В свою очередь, самовозгорающиеся в-ва делят на три группы: самовозгорающиеся от воздействия на них воздуха (например, опилки, торф, каменные угли, промасленные обтирочные материалы и спецодежда); вызывающие горение при контакте с водой (карбид кальция, негашеная известь); самовозгорающиеся в результате смешения друг с другом (минеральное масло в среде сжатого кислорода, смоченные азотной кислотой).
Горение, возникшее в результате воспламенения лишь части общего количества горючего вещества, называется воспламенением. При этом горит весь объем горючего вещества, тогда как при воспламенении части его другая часть горючего не воспламеняется. Таким образом, в основе процесса горения лежит самовоспламенение; самовозгорание и воспламенение являются частными явлениями самовоспламенения.
При горении твердых веществ они плавятся, образуя жидкий слой, или разлагаются, превращаясь в газы, пары, уголь. Твердые вещества горят сами и распространяют горение, характеризуемое массовой скоростью выгорания. На единицу площади, например, для изделий из древесины она составляет 0,84 кг/(м2-мин).
Скорость выгорания жидких горючих в-в подразделяют на массовую скорость выгорания (масса жидкости, выгоревшая с единицы пов-ти за единицу времени) и линейную скорость выгорания (высота слоя жидкости, выгоревшая за единицу времени). Например, массовая скорость выгорания бензина составляет 2,7...3,2 кг/(м2-мин), линейная — 3,8...4,5 мм/мин.