Таблица 4
Варианты контрольной работы №2 – Молекулярная физика.
Термодинамика
| Вариант
|
Номера задач
| |
| 1
| 1
| 16
| 31
| 46
| 61
| 76
| 91
| 106
| 121
| 136
|
| 2
| 2
| 17
| 32
| 47
| 62
| 77
| 92
| 107
| 122
| 137
|
| 3
| 3
| 18
| 33
| 48
| 63
| 78
| 93
| 108
| 123
| 138
|
| 4
| 4
| 19
| 34
| 49
| 64
| 79
| 94
| 109
| 124
| 139
|
| 5
| 5
| 20
| 35
| 50
| 65
| 80
| 95
| 110
| 125
| 140
|
| 6
| 6
| 21
| 36
| 51
| 66
| 81
| 96
| 111
| 126
| 141
|
| 7
| 7
| 22
| 37
| 52
| 67
| 82
| 97
| 112
| 127
| 142
|
| 8
| 8
| 23
| 38
| 53
| 68
| 83
| 98
| 113
| 128
| 143
|
| 9
| 9
| 24
| 39
| 54
| 69
| 84
| 99
| 114
| 129
| 144
|
| 10
| 10
| 25
| 40
| 55
| 70
| 85
| 100
| 115
| 130
| 145
|
| 11
| 11
| 26
| 41
| 56
| 71
| 86
| 101
| 116
| 131
| 146
|
| 12
| 12
| 27
| 42
| 57
| 72
| 87
| 102
| 117
| 132
| 147
|
| 13
| 13
| 28
| 43
| 58
| 73
| 88
| 103
| 118
| 133
| 148
|
| 14
| 14
| 29
| 44
| 59
| 74
| 89
| 104
| 119
| 134
| 149
|
| 15
| 15
| 30
| 45
| 60
| 75
| 90
| 105
| 120
| 135
| 150
|
| | | | | | | | | | | | |
1. Определить давление, оказываемое газом на стенки сосуда, если его плотность r=0,01 кг/м3, а средняя квадратичная скорость молекул газа составляет 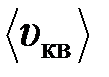 = 480 м/с.
= 480 м/с.
2. Средняя квадратичная скорость некоторого газа при нормальных условиях 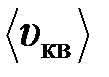 = 500 м/с. Сколько молекул содержит 1 г этого газа?
= 500 м/с. Сколько молекул содержит 1 г этого газа?
3. Давление газа р =1 мПа, концентрация его молекул п = 1010 см-3. Определить: 1) температуру Т газа; 2) среднюю кинетическую энергию  поступательного движения молекул газа.
поступательного движения молекул газа.
4. Найти концентрацию молекул n водорода при давлении
p =266,6 Па, если средняя квадратичная скорость его молекул
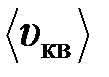 = 2,4 км/с.
= 2,4 км/с.
5. Найти импульс молекулы водорода при температуре t =20 °C. Скорость молекулы считать равной средней квадратичной скорости.
6. Определить давление p идеального газа при двух значениях температуры газа: 1) T = 3 К; 2) T = 1 кК. Принять концентрацию п молекул газа равной»1019 см-3.
7. Во сколько раз средняя квадратичная скорость 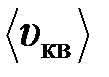 молекул кислорода больше средней квадратичной скорости пылинки
молекул кислорода больше средней квадратичной скорости пылинки 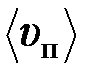 массой m =10-8 г, находящейся среди молекул кислорода?
массой m =10-8 г, находящейся среди молекул кислорода?
8. Плотность некоторого газа r = 0,082 кг/м3 при давлении
p =100 кПа и температуре t =17 0C. Найти среднюю квадратичную скорость 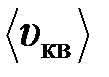 молекул газа. Какова молярная масса m этого газа?
молекул газа. Какова молярная масса m этого газа?
9. Сколько молекул газа N содержится в баллоне вместимостью
V =30 л при температуре Т =300 К и давлении р =5 МПа?
10. Колба вместимостью V =4 л содержит некоторый газ массой
m =0,6 г под давлением p =200 кПа. Определить среднюю квадратичную скорость 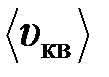 молекул газа.
молекул газа.
11. Определить количество веществаn водорода, заполняющего сосуд вместимостью V =3 л, если плотность газа r=6,65×10-3 кг/м3.
12. В сосуде вместимостью V =1,12 л находится азот при нормальных условиях. Часть молекул газа при нагревании до некоторой температуры оказалась диссоциированной на атомы. Степень диссоциации a = 0,3. Определить количество вещества: 1) всего азота до нагревания; 2) молекулярного азота после нагревания; 3) атомарного азота после нагревания: 4) всего азота после нагревания.
13. Чему равна энергия вращательного движения молекул, содержащихся в 1 кг азота при температуре 27 °С?
14. Определить число молекул аргона, занимающего объем 10 л и находящегося под давлением р = 1,01×105 Па, если средняя квадратичная скорость поступательного движения его молекул равна 500м/c.
15. При какой температуре средняя кинетическая энергия теплового движения атомов гелия будет достаточна для того, чтобы атомы гелия преодолели земное тяготение, навсегда покинули земную атмосферу?
16. В баллоне вместимостью V =15 л находится азот под давлением p 1 =100 кПа при температуре t 1=27 °C. После того как из баллона выпустили азот массой m =14 г, температура газа стала равной
t 2=17 °C. Определить давление азота p 2, оставшегося в баллоне.
17. Определить плотность смеси газов водорода массой m 1=8г и кислорода массой m 2=64 г при температуре Т =290 К и при давлении
p =0,1 МПа. Газы считать идеальными.
18. В сосуде вместимостью V =1 л находится кислород массой
m =1 г. Определить концентрацию молекул кислорода в сосуде.
19. В баллоне вместимостью V =2 л находится кислород массой
m =1,17г. Концентрация молекул в сосуде п =1,1×1025 м-3. Определить по этим данным постоянную Авогадро N A.
20. Полый шар вместимостью V =10 см3, заполненный воздухом при температуре T 1=573 К, соединили трубкой с чашкой, заполненной ртутью. Определить массу m ртути, вошедшей в шар при остывании воздуха в нем до температуры Т 2=293 К. Изменением вместимости шара пренебречь.
21. В закрытом сосуде при температуре 300 К и давлении 0,1 МПа находятся m 1 =10 г водорода и m 2 =16 г гелия. Считая газы идеальными, определить удельный объем смеси. Удельным объемом смеси называется величина, равная отношению объема смеси к её массе.
22. Котел вместимостью V =2 м3 содержит перегретый водяной пар массой m =10кг при температуре T =500 К. Определить давление p пара в котле.
23. Оболочка аэростата вместимостью V =1600 м3, находящегося на поверхности Земли, на k =7/8 наполнена водородом при давлении
p 1=100 кПа и температуре T 1=290 К. Аэростат подняли на некоторую высоту, где давление p 2=80 кПа и температура Т 2=280 К. Определить массу D m водорода, вышедшего из оболочки при его подъеме.
24. Масса m =10 г кислорода находится при давлении p =304 кПа и температуре t =10°С. После расширения вследствие нагревания при постоянном давлении кислород занял объем V 2=10 л. Найти объем V 1 газа до расширения, температуру t газа после расширения, плотности r1 и r2 газа до и после расширения.
25. Посередине откачанного и запаянного с обоих концов капилляра, расположенного горизонтально, находится столбик ртути длиной
l = 20 см. Если капилляр поставить вертикально, то столбик ртути переместится на D l =10 см. Определить начальное давление р 0 в капилляре. Длина капилляра l =1 м.
26. Состояние постоянной массы идеального газа меняется по закону РТ 2= const. Определить во сколько раз изменится объем газа, если его давление увеличилось в 2 раза.
27. Оболочка воздушного шара вместимостью V = 800 м3 целиком заполнена гелием при температуре T 1 = 273К. На сколько изменится подъемная сила шара при повышении температуры до T 2 = 303 К? Считать вместимость V оболочки неизменной и внешнее давление нормальным. В нижней части оболочки имеется отверстие, через которое газ может выходить в окружающее пространство.
28. Когда из сосуда выпустили некоторое количество идеального газа, его давление уменьшилось на 80%, а температура на 60%. Определить долю оставшегося в сосуде газа.
29. В горизонтальный цилиндрический сосуд длиной 60 см, заполненный идеальным газом, помещают легкую теплонепроницаемую перегородку. Объемы образовавшихся частей одинаковы. В одной части повышают температуру в два раза, в другой поддерживают ее постоянной и равной начальной. Определить смещение перегородки. Трением при движении пренебречь.
30. Газовая смесь, состоящая из кислорода и азота, находится в баллоне под давлением р =0,1 МПа. Определить парциальные давления р 1 кислорода и р 2 азота, если массовая доля w1 кислорода в смеси равна 0,2.
31. Давление газа равно 13 мПа, концентрация его молекул равна 1,2 1012 см-3. Определить: 1) температуру Т газа; 2) среднюю кинетическую энергию 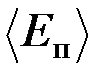 поступательного движения молекул газа.
поступательного движения молекул газа.
32. Определить среднюю кинетическую энергию 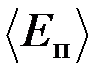 поступательного движения и среднее значение
поступательного движения и среднее значение 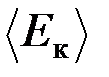 полной кинетической энергии молекулы водяного пара при температуре Т = 600 К. Найти также кинетическую энергию W поступательного движения всех молекул пара, содержащего количество вещества n = 1 кмоль.
полной кинетической энергии молекулы водяного пара при температуре Т = 600 К. Найти также кинетическую энергию W поступательного движения всех молекул пара, содержащего количество вещества n = 1 кмоль.
33. Определить кинетическую энергию 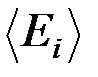 , приходящуюся в среднем на одну степень свободы молекулы азота, при температуре
, приходящуюся в среднем на одну степень свободы молекулы азота, при температуре
T = 1 кК, а также среднюю кинетическую энергию 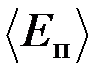 поступательного движения,
поступательного движения, 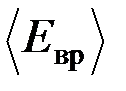 вращательного движения и среднее значение полной кинетической энергии
вращательного движения и среднее значение полной кинетической энергии 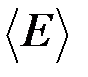 молекулы.
молекулы.
34. Для получения высокого вакуума в стеклянном сосуде необходимо прогревать его при откачке с целью удалить адсорбированные газы. Определить, насколько повысится давление в сферическом сосуде радиусом r = 10 см, если все адсорбированные молекулы перейдут со стенок в сосуд. Слой молекул на стенках считать мономолекулярным, сечение s одной молекулы равно 10-15 см2. Температура T, при которой производится откачка, равна 600 К.
35. При какой температуре Т средняя квадратичная скорость атомов гелия станет равной второй космической скорости 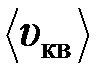 = 11,2 км/с?
= 11,2 км/с?
36. При какой температуре Т молекулы кислорода имеют такую же среднюю квадратичную скорость 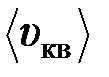 как молекулы водорода при температуре T =100К?
как молекулы водорода при температуре T =100К?
37. В момент взрыва атомной бомбы развивается температура, равная примерно 107 градусов. Считая, что при такой температуре все молекулы полностью диссоциированы на атомы, а атомы ионизированы, найти среднюю квадратичную скорость иона водорода.
38. Найти число молекул водорода в 1 см3, если давление равно 200мм рт.ст., а средняя квадратичная скорость его молекул при данных
условиях равна 2400 м/сек.
39. Плотность некоторого газа равна r=0,06 кг/м3, средняя квадратичная скорость молекул этого газа равна 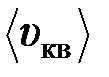 = 500 м/с. Найти давление, которое газ оказывает на стенки сосуда.
= 500 м/с. Найти давление, которое газ оказывает на стенки сосуда.
40. Во сколько раз средняя квадратичная скорость пылинки, взвешенной в воздухе, меньше средней квадратичной скорости молекул воздуха? Масса пылинок m =10-8 г. Воздух считать однородным газом, масса одного киломоля которого равна 29 кг/кмоль.
40. Найти импульс молекулы водорода при температуре 20°С. Скорость молекулы считать равной средней квадратичной скорости.
41. В сосуде объемом 2 л находится 10 г кислорода под давлением р =90,6 кПа. Найти: 1) среднюю квадратичную скорость молекул газа, 2) число молекул, находящихся в сосуде, 3) плотность газа.
42. Средняя квадратичная скорость молекул некоторого газа равна 450 м/с. Давление газа равно 5×104 Па. Найти плотность газа при этих условиях.
43. Чему равна энергия теплового движения20 гкислорода при температуре 10°С? Какая энергия приходится на долю поступательного движения и какая на долю вращательного?
44. Чему равна энергия вращательного движения молекул, содержащихся в 1 кг азота при температуре 7°С?
45. Кинетическая энергия поступательного движения молекул азота, находящегося в баллоне объемом 0,02 м3 равна 5×103 Дж, а средняя квадратичная скорость его молекул раина 2×103 м/с. Найти: 1) количество азота в баллоне, 2) давление, под которым находится азот.
46.Пылинки, взвешенные в воздухе, имеют массу m = 10-18 г. Восколько раз уменьшится их концентрация n при увеличении высоты на
D h =10 м? Температура воздуха Т =300 К.
47. Найти среднюю потенциальную энергию молекулы гелия, находящегося в центрифуге радиусом R =1м, вращающейся с угловой скоростью w= 200 мин-1.
48. Одинаковые частицы массой m =10-12 г каждая распределены в однородном гравитационном поле напряженностью g =0,2 мкН/кг. Определить отношение n 1/ n 2 концентраций частиц, находящихся на эквипотенциальных уровнях, отстоящих друг от друга на D z =10 м. Температура Т во всех слоях считается одинаковой и равной 290 К.
49. Масса m 0 каждой из пылинок, взвешенных в воздухе, равна
10-18г. Отношение концентрации n1 пылинок на высоте h 1=1 м к концентрации n0 их на высоте h 0=0 равно 0,787. Температура воздуха
T =300 К. Найти по этим данным значение постоянной Авогадро N А.
50. Определить силу, действующую на частицу, находящуюся во внешнем однородном поле силы тяжести, если отношение n 1/ n 2 концентраций частиц на двух уровнях, отстоящих друг от друга на D r =1 м, равно е. Температуру Т считать везде одинаковой и равной 300 К.
51. На сколько уменьшится атмосферное давление при подъеме наблюдателя над поверхностью Земли на высоту h =100 м? Считать, что температура воздуха на поверхности Земли равна 290 К и не изменяется с высотой, давление р = 100кПа.
52. На какой высоте Н над поверхностью Земли атмосферное давление вдвое меньше, чем на ее поверхности? Считать, что температура Т воздуха равна 290 К и не изменяется с высотой.
53. Барометр в кабине летящего вертолета показывает давление
p =90 кПа. На какой высоте Н летит вертолет, если на взлетной площадке барометр показывал давление р =100 кПа? Считать, что температура Т воздуха равна 290 К и не изменяется с высотой.
54. Найти изменение высоты D h, соответствующее изменению давления на D p =100 Па, в двух случаях: 1) вблизи поверхности Земли, где температура Т 1=290 К, давление р =100 кПа; 2) на некоторой высоте, где температура Т 2=220К, давление p =25 кПа.
55. Барометр в кабине летящего самолета все время показывает одинаковое давление р =80 кПа, благодаря чему летчик считает высоту Н полета неизменной. Однако температура воздуха изменилась на
D T = 1К. Какую ошибку D h в определении высоты допустил летчик? Считать, что температура не зависит от высоты и что у поверхности Земли давление р 0=100 кПа.
56. Ротор центрифуги вращается с угловой скоростью w. Используя функцию распределения Больцмана, установить распределение концентрации n частиц массой m, находящихся в роторе центрифуги, как функцию расстояния r от оси вращения.
57. В центрифуге с ротором радиусом r, равным0,5 м, при температуре T =300 К находится в газообразном состоянии вещество с молярной массой m=1кг/моль. Определить отношение n а / n 0 концентраций молекул у стенок ротора и в центре его, если ротор вращается с частотой 30 оборотов в секунду.
58. Ротор центрифуги, заполненный радоном, вращается с частотой n =50 с-1. Радиус r ротора равен0,5 м. Определить давление р газа на стенки ротора, если в его центре давление р0 равно нормальному атмосферному. Температуру Т по всему объему считать одинаковой и равной 300 К.
59. В центрифуге находится некоторый газ при температуре
Т = 271 К. Ротор центрифуги радиусом r = 0,4 м вращается с угловой скоростью w = 500 рад/с. Определить молярную массу m газа, если давление р у стенки ротора в 2,1 раза больше давления р 0 в его центре.
60. Ротор ультрацентрифуги радиусом r =0,2 м заполнен атомарным хлором при температуре T =3 кК. Хлор состоит из двух изотопов: 37Сl и 35Сl. Доля w1 атомов изотопа 37Сl в смеси составляет 0,25. Определить доли w1' и w2' атомов того и другого изотопов вблизи стенок ротора, если ротору сообщить угловую скорость вращения w = 104 рад/с.
61.Средняя длина свободного пробега  атомов гелия при нормальных условиях равна 180 нм. Определить коэффициент диффузии D гелия.
атомов гелия при нормальных условиях равна 180 нм. Определить коэффициент диффузии D гелия.
62. Коэффициент диффузии D кислорода при температуре t =0 °С равен 0,19 см2/с. Определить среднюю длину свободного пробега 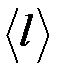 молекул кислорода.
молекул кислорода.
63. Определить, во сколько раз отличается коэффициент диффузии газообразного водорода от коэффициента диффузии газообразного кислорода, если оба газа находятся при одинаковых условиях.
64. Определить зависимость коэффициента диффузии от температуры Т при следующих процессах: 1) изобарном; 2) изохорном.
65. Определить зависимость коэффициента диффузииот давления р при следующих процессах: 1) изотермическом; 2) изохорном.
66. Найти динамический коэффициент вязкости h гелия при нормальных условиях, если коэффициент диффузии D при тех же условиях равен 1,06×10-4 м2/с.
67. Определить зависимость динамического коэффициента вязкости h от температуры Т при следующих процессах: 1) изобарном; 2) изохорном.
68. Определить зависимость коэффициента теплопроводности λ от давления р при следующих процессах: 1) изотермическом;2) изохор-
ном.
69. Цилиндр радиусом R 1=10 см и длиной l =30 см расположен внутри цилиндра радиусом R 2=10,5 см так, что оси обоих цилиндров совпадают. Малый цилиндр неподвижен, большой вращается относительно геометрической оси с частотой n =15с-1. Динамический коэффициент вязкости h газа, в котором находятся цилиндры, равен
8,5 мкПа с. Определить: 1) касательную силу F, действующую на поверхность внутреннего цилиндра площадью S =1 м2; 2) вращающий момент M, действующий на этот цилиндр.
70. Два горизонтальных диска радиусами r =20 см расположены друг над другом так, что оси их совпадают. Расстояние и между плоскостями дисков равно0,5 см. Верхний диск неподвижен, нижний вращается относительно геометрической оси с частотой n =10с-1. Найти вращающий момент M, действующий на верхний диск. Коэффициент динамической вязкости h воздуха, в котором находятся диски, равен
17,2 мкПа с.
71. В ультраразреженном азоте, находящемся под давлением
р = 1 мПа и при температуре Т =300 К, движутся друг относительно друга две параллельные пластины со скоростью u = 1 м/с. Расстояние между пластинами не изменяется и много меньше средней длины свободного пробега молекул. Определить силу F внутреннего трения, действующую на поверхность пластин площадью S =1 м2.
72. Найти зависимость коэффициента теплопроводности l от температуры Т при следующих процессах: 1) изобарном; 2) изохорном.
73.Найти зависимость коэффициента внутреннего трения h от давления р при следующих процессах: 1) изотермическом; 2) изохорном.
74. Пространство между двумя большими параллельными пластинами, расстояние между которыми равно5 мм, заполнено гелием. Температура Т 1 одной пластины 290 К, другой T 2 =310 К. Вычислить плотность теплового потока q. Давление р гелия равно 0,1 МПа.
75. При помощи ионизационного манометра, установленного на третьем советском искусственном спутнике Земли, было обнаружено, что на высоте 300 км от поверхности Земли в 1 см3 атмосферы находится около миллиарда частиц газа. Найти среднюю длину свободного пробега частиц газа на этой высоте. Диаметр частиц принять равным
2×10-10 м.
76.Разность удельных теплоемкостей сР и cV двухатомного газа равна 260 Дж/(кг×К). Найти молярную массу газа и его удельные теплоемкости сР уди cV уд.
77. Каковы удельные теплоемкости сР уди cV удсмеси газов, содержащей кислород массой m 1=10 г и азот массой m 2=20 г?
78. Определить удельную теплоемкость cV удсмеси газов, содержащей 5 л водорода и 3 л гелия. Газы находятся при одинаковых условиях.
79. Определить удельную теплоемкость сР удсмеси кислорода и азота, если количество веществаn1первого компонента равно 2 моль, а количество вещества n2 второго равно 4 моль.
80. В баллоне находятся аргон и азот. Определить удельную теплоемкость cV удсмеси этих газов, если массовые доли аргона (w1) и азота (w2) одинаковы и равны 0,5.
81. Смесь газов состоит из хлора и аргона, взятых при одинаковых условиях и в равных объемах. Определить удельную теплоемкость сР удсмеси.
82. Определить удельную теплоемкость c V смеси ксенона и кислорода, если количества вещества газов в смеси одинаковы и равныn.
83. Найти показатель адиабаты g для смеси газов, содержащей гелий массой 10 г и водород массой 4 г.
84. Смесь газов состоит из аргона и азота, взятых при одинаковых условиях и в одинаковых объемах. Определить показатель адиабаты g такой смеси.
85. Найти показатель адиабаты g смеси водорода и неона, если массовые доли обоих газов в смеси одинаковы и равны 0,5.
86. Найти показатель адиабаты g смеси газов, содержащей кислород и аргон, если количества вещества того и другого газа в смеси одинаковы.
87. При адиабатном сжатии газа его объем уменьшился в 10 раз, а давление увеличилось в 21,4 раза. Определить отношение С P / CV теплоемкостей газов.
88. Удельная теплоемкость при постоянном объеме газовой смеси, состоящей из одного киломоля кислорода и нескольких киломолей аргона,равна 430 Дж/(кг×град). Какое количество аргона находится в газовой смеси?
89. Найти удельную теплоемкость кислорода для: а) V =соnst; б)
p =соnst.
90. Найти удельную теплоемкость сР уд: а) углекислого газа; б) окиси азота.
91. Кислород при неизменном давлении р =80 кПа нагревается. Его объем увеличивается от V 1=l м3 до V 2=3м3. Определить: 1) изменение Δ U внутренней энергии кислорода; 2) работу А, совершенную им при расширении; 3) количество теплоты Q, сообщенное газу.
92. Какая доля ω1 количества теплоты Q, подводимого к идеальному газу при изобарном процессе, расходуется на увеличение Δ U внутренней энергии газа и какая доля ω2 – на работу А расширения? Рассмотреть три случая, если газ: 1) одноатомный; 2) двухатомный; 3) трехатомный.
93. Некоторый газ массой m =5 г расширяется изотермически от объема V 1 до объема V 2 = 2 V 1. Работа расширения А =1 кДж. Определить среднюю квадратичную скорость 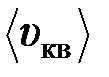 молекул газа.
молекул газа.
94. Кислород объемом 1 л находится под давлением 1 МПа. Определить, количество теплоты, которое необходимо сообщить газу, чтобы: 1) увеличить его объем вдвое в результате изобарного процесса; 2) увеличить его давление вдвое в результате изохорного процесса.
95. Автомобильная шина накачена до давления p 1=220 кПа при температуре T 1=290 К. Во время движения она нагрелась до температуры T 2=330 К и лопнула. Считая процесс, происходящий после повреждения шины, адиабатным, определить изменение температуры Δ T вышедшего из нее воздуха. Внешнее давление р 0воздуха равно 100 кПа.
96. Некоторый газ массой m =1 кг находится при температуре
Т =300 К и под давлением p 1= 0,5 МПа. В результате изотермического сжатия давление газа увеличилось в два раза. Работа, затраченная на сжатие, А = – 432 кДж. Определить: 1) какой это газ; 2) первоначальный удельный объем газа.
97. Горючая смесь в двигателе дизеля воспламеняется при температуре T 2= 1,1 кК. Начальная температура смеси T 1=350 К. Во сколько раз нужно уменьшить объем смеси при сжатии, чтобы она воспламенилась? Сжатие считать адиабатным. Показатель адиабаты γ для смеси принять равным 1,4.
98. При адиабатном сжатии кислорода массой m =20 г его внутренняя энергия увеличилась на Δ U =8 кДж и температура повысилась до T 2=900 К. Найти: 1) повышение температуры Δ T, 2) конечное давление газа р 2, если начальное давление p 1=200кПа.
99.В цилиндре под поршнем находится азот массой m =0,6 кг, занимающий объем V 1 = 1,2 м3 при температуре Т =560 К. В результате подвода теплоты газ расширился и занял объем V 2=4,2 м3, причем температура осталась неизменной. Найти: 1) изменение Δ U внутренней энергии газа; 2) совершенную им работу A; 3) количество теплоты Q, сообщенное газу.
100. Двухатомный идеальный газ нагревали двумя способами: изобарно и изохорно. Определить отношение количеств теплоты
(Q 1/ Q 2), сообщенных газу, если и в том и в другом процессе его количество и изменение температуры одинаково.
101. Водяной пар расширяется при постоянном давлении. Определить работу А расширения, если пару передано количество теплоты
Q =4 кДж.
102. Один моль идеального одноатомного газа сначала изобарно нагрели, а затем изохорно охладили до первоначальной температуры 300 К, уменьшив давление в 3 раза. Какое количество теплоты сообщено газу в первом процессе?
103. Идеальный одноатомный газ расширяется сначала адиабатно, а затем изобарно. Конечная температура газа равна начальной. Общая работа газа за оба процесса равна 5 кДж. Определить работу в каждом процессе.
104. Идеальный двухатомный газ нагревается изобарно. При этом ему сообщается 90 кДж теплоты. Затем его изохорно охлаждают до первоначальной температуры. Определить количество теплоты, отведенное от газа во втором процессе.
105. Некоторое количество гелия расширяется: сначала адиабатно, а затем изобарно. Конечная температура газа равна начальной. При адиабатном расширении газ совершил работу, равную 4,5 кДж. Какова работа газа за весь процесс?
106. Над одноатомным идеальным газом проводится цикл, состоящий из трех процессов. В процессе 1-2 газ совершает работу
А 12 = 1000Дж так, что давление растет прямо пропорционально объему, который увеличивается в два раза. В процессе 2-3, газ изохорно охлаждается. В процессе 3-1, внешние силы адиабатически сжимают газ, совершая работу | A 31| = 370 Дж. Количество вещества газа в ходе процесса не меняется. Найдите количество теплоты Q 2, отданное газом за цикл холодильнику.
107.Идеальный двухатомный газ, содержащий количество вещества ν= l моль, совершает цикл, состоящий из двух изохор и двух изобар. Наименьший объем V min=10 л, наибольший V max=20 л, наименьшее давление p min=246 кПа, наибольшее p max = 410 кПа. Построить график цикла. Определить температуру Т газа для характерных точек цикла и его термический КПД η.
108. Идеальный двухатомный газ, содержащий количество вещества ν=l моль и находящийся под давлением p 1 = 0,1 МПа при температуре T 1=300 К, нагревают при постоянном объеме до давления
p 2=0,2 МПа. После этого газ изотермически расширился до начального давления и затем изобарно был сжат до начального объема V 1. Построить график цикла. Определить температуру Т газа для характерных точек цикла и его термический КПД η.
109. Одноатомный газ, содержащий количество вещества
ν=0,1 кмоль, под давлением p 1=100 кПа занимал объем V 1=5 м3. Газ сжимался изобарно до объема V 2=1 м3, затем сжимался адиабатно и расширялся при постоянной температуре до начальных объема и давления. Построить график процесса. Найти: 1) температуры T 1, T 2, объемы V 1, V 2 и давление p 3, соответствующее характерным точкам цикла; 2) количество теплоты Q 1, полученное газом от нагревателя; 3) количество теплоты Q 2, переданное газом охладителю; 4) работу А, совершенную газом за весь цикл; 5) термический КПД η цикла.
110. Идеальный газ совершает цикл Карно. Работа A 1 изотермического расширения газа равна 5 Дж. Определить работу A 2 изотермического сжатия, если термический КПД η цикла равен 0,2.
111. Наименьший объем V 1 газа, совершающего цикл Карно, равен 153 л. Определить наибольший объем V 3, если объем V 2 в конце изотермического расширения и объем V 4 в конце изотермического сжатия равны соответственно 600 и 189 л.
112. Идеальный газ совершает цикл Карно. Температура охлади-
теля T 2 равна 290 К. Во сколько раз увеличится КПД цикла, если температура нагревателя повысится от 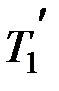 =400 К до
=400 К до 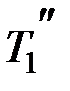 = 600 К?
= 600 К?
113. За счет теплоты Q =1 кДж, получаемого от нагревателя, машина, работающая по циклу Карно, совершает работу A =0,5 кДж. Температура нагревателя T 1 =500 К. Определить температуру охладителя T 2.
114. Определить, на сколько процентов изменится КПД прямого цикла Карно, если температура нагревателя T 1=894 К, а температура охладителя уменьшилась от  = 494 до
= 494 до 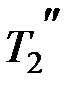 = 394 К.
= 394 К.
115. Идеальный многоатомный газ совершает цикл, состоящий из двух изохор и двух изобар, причем наибольшее давление газа в два раза больше наименьшего, а наибольший объем в четыре раза больше наименьшего. Определить термический КПД ηцикла.
116. Идеальный газ совершает цикл Карно. Температура нагревателя T 1 = 470 К, температура охладителя Т 2 = 280 К. При изотермическом расширении газ совершает работу A =100 Дж. Определить термический КПД η цикла, а также количество теплоты Q 2, которое газ отдает охладителю при изотермическом сжатии.
117. Идеальный газ, совершающий цикл Карно, 70% количества теплоты, полученной от нагревателя, отдает холодильнику. Количество теплоты, получаемое от нагревателя, равно 5 кДж. Определить: 1)термический к.п.д. цикла; 2) работу, совершенную при полном цикле.
118. Идеальный газ совершает цикл Карно. Газ получил от нагревателя количество теплоты 5,5 кДж и совершил работу 1,1 кДж. Определить: 1)термический к.п.д. цикла; 2) отношение температур нагревателя и холодильника.
119. Идеальный газ совершает цикл Карно, термический к.п.д. которого равен 0,4. Определить работу изотермического сжатия газа, если работа изотермического расширения составляет 400 Дж.
120. Идеальный газ совершает цикл Карно. Температура нагревателя Т 1 = 500 К, холодильника Т 2 = 300 К. Работа изотермического расширения газа составляет 2 кДж. Определить: 1)термический к.п.д. цикла; 2) количество теплоты, отданное газом при изотермическом сжатии холодильнику.
121.Водород массой 6,6 г расширяется изобарически до удвоения объема. Найти изменение энтропии при этом расширении.
122. Найти изменение энтропии при изобарическом расширении
8 г гелия от объема V 1=10л до объема V 2=25л.
123. Найти изменение энтропии при изотермическом расширении 6 г водорода от 100 кПа до 50 кПа.
124. Азот массой 10,5 г изотермически расширяется от объема
V 1=2 л до объема V 2=5 л. Найти прирост энтропии при этом процессе.
125. Кислород массой 10 г нагревается от t 1= 50°С до t 2=150°С. Найти изменение энтропии, если нагревание происходит: 1) изохорически; 2) изобарически.
126. При нагревании 1 кмоля двухатомного газа его абсолютная температура увеличивается в 1,5 раза. Найти изменение энтропии, если нагревание происходит: 1) изохорически; 2) изобарически.
127. В результате нагревания 22 г азота его абсолютная температура увеличилась в 1,2 раза, а энтропия увеличилась на 4,19 Дж/град. При каких условиях производилось нагревание (при постоянном объеме или при постоянном давлении)?
128. Один кубический метр воздуха, находящегося при температуре 0°С и давлении 98 кПа, изотермически расширяется от объема
V 1=1 м3 до объема V 2=2 V 1. Найти изменение энтропии при этом процессе.
129. Во сколько раз необходимо увеличить объем 5 молей идеального газа при изотермическом расширении, если его энтропия увеличилась на 57,6 Дж/К?
130.При нагревании идеального двухатомного газа (n= 3 моль) его термодинамическая температура увеличилась в 2 раза. Определить изменение энтропии, если нагревание происходит изохорно.
131.При нагревании идеального двухатомного газа (n= 3 моль) его термодинамическая температура увеличилась в 2 раза. Определить изменение энтропии, если нагревание происходит изобарно.
132. Идеальный газ(n= 2 моль) сначала изобарно нагрели, так что объем газа увеличился в 2 раза, а затем изохорно охладили, так что давление его уменьшилось в 2 раза. Определить приращение энтропии в ходе указанных процессов.
133. Воздух, объемом V 1=1 м3, находящийся при температуре
t 1=0°C и давлении р 1=98 кПа, изотермически расширяется. Найти приращение энтропии в этом процессе, если объем газа увеличился в два раза.
134. Азот массой28 г адиабатически расширили в 2 раза, а затем изобарно сжали до первоначального объема. Определить изменение энтропии газа в ходе указанных процессов.
135. Процесс расширения двух молей аргона происходит так, что давление газа увеличивается прямо пропорционально объему. Найти приращение энтропии газа, если его объем увеличился в два раза.
136. В сосуде вместимостью V =10 л находится азот массой
m =0,25 кг. Определить: 1) внутреннее давление р' газа: 2) собственный объем V ' молекул.
137. Определить давление p, которое будет производить кислород, содержащий количество вещества n=1 моль, если он занимает объем
V =0,5 л при температуре Т =300 К. Сравнить полученный результат с давлением, вычисленным по уравнению Менделеева-Клапейрона.
138. В сосуде вместимостью V =0,3 л находится углекислый газ, содержащий количество вещества n=1 моль при температуре
Т = 300 К. Определить давление р газа: 1) по уравнению Менделеева-Клапейрона; 2) по уравнению Ван-дер-Ваальса.
139. Неон, содержащий количество вещества n=1 моль, находится при температуре Т =300 К (V =2 л). Определить относительную погрешность D p / p, которая будет допущена при вычислении давления, если вместо уравнения Ван-дер-Ваальса воспользоваться уравнением Менделеева-Клапейрона.
140. Внутреннюю полость толстостенного стального баллона наполовину заполнили воздухом при комнатной температуре. После этого баллон герметически закупорили и нагрели до температуры Т = 650 К. Определить давление р водяного пара в баллоне при этой температуре.
141. Давление р кислорода равно 7 МПа, его плотность
r=100 кг/м3. Найти температуру Т кислорода.
142. Определить давление р воздуха массой m =1кг, взятого при температуре T =380 К и объеме V: 1) 1000 л; 2) 10 л; 3) 2 л.
143. Вычислить постоянные а и b в уравнении Ван-дер-Ваальса для азота, если известны критические температуры T кр=126 К и давление p кр= 3,39 МПа.
144. Вычислить критические температуру T кр и давление p кр:1) кислорода; 2) воды.
145. Критическая температура T кр аргона равна 151 К и критическое давление p кр =4,86 МПа. Определить по этим данным критический молярный объем V кр аргона.
146. Жидким п



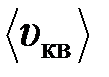 = 480 м/с.
= 480 м/с.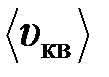 = 500 м/с. Сколько молекул содержит 1 г этого газа?
= 500 м/с. Сколько молекул содержит 1 г этого газа? поступательного движения молекул газа.
поступательного движения молекул газа.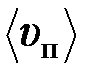 массой m =10-8 г, находящейся среди молекул кислорода?
массой m =10-8 г, находящейся среди молекул кислорода?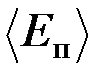 поступательного движения молекул газа.
поступательного движения молекул газа.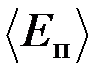 поступательного движения и среднее значение
поступательного движения и среднее значение 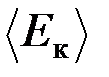 полной кинетической энергии молекулы водяного пара при температуре Т = 600 К. Найти также кинетическую энергию W поступательного движения всех молекул пара, содержащего количество вещества n = 1 кмоль.
полной кинетической энергии молекулы водяного пара при температуре Т = 600 К. Найти также кинетическую энергию W поступательного движения всех молекул пара, содержащего количество вещества n = 1 кмоль.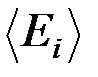 , приходящуюся в среднем на одну степень свободы молекулы азота, при температуре
, приходящуюся в среднем на одну степень свободы молекулы азота, при температуре 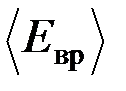 вращательного движения и среднее значение полной кинетической энергии
вращательного движения и среднее значение полной кинетической энергии 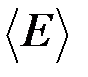 молекулы.
молекулы.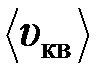 = 11,2 км/с?
= 11,2 км/с?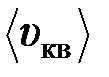 как молекулы водорода при температуре T =100К?
как молекулы водорода при температуре T =100К? атомов гелия при нормальных условиях равна 180 нм. Определить коэффициент диффузии D гелия.
атомов гелия при нормальных условиях равна 180 нм. Определить коэффициент диффузии D гелия.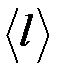 молекул кислорода.
молекул кислорода.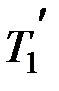 =400 К до
=400 К до 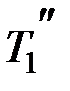 = 600 К?
= 600 К? = 494 до
= 494 до 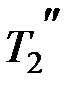 = 394 К.
= 394 К.


