Молекулярная физика. Термодинамика
Основные законы и формулы
1.Уравнение состояния идеального газа (уравнение Менделеева-
Клапейрона)
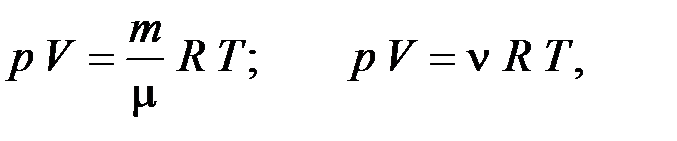
где p, V – давление и объём, занимаемый данной массой газа; m, 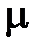 – масса и молярная масса газа; R – универсальная газовая постоянная;
– масса и молярная масса газа; R – универсальная газовая постоянная;
T – абсолютная (термодинамическая) температура 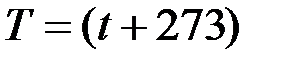 К; t – температура по шкале Цельсия;
К; t – температура по шкале Цельсия;  – количество вещества.
– количество вещества.
2. Для смеси газов справедлив закон Дальтона
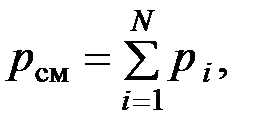
где  – парциальное давление i -ой компоненты смеси (давление, создаваемое одним компонентом смеси в объеме смеси и при её темпера-
– парциальное давление i -ой компоненты смеси (давление, создаваемое одним компонентом смеси в объеме смеси и при её темпера-
туре); N – число компонентов смеси.
3.Основное уравнение молекулярно-кинетической теории газов
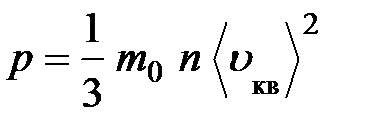 или
или 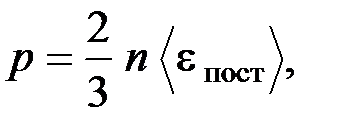
где  – масса одной молекулы; n – концентрация молекул;
– масса одной молекулы; n – концентрация молекул;  – средняя квадратичная скорость молекул;
– средняя квадратичная скорость молекул; 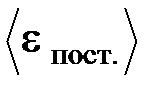 – средняя кинетическая энергия поступательного движения одной молекулы.
– средняя кинетическая энергия поступательного движения одной молекулы.
4. Средняя кинетическая энергия молекулы (с учётом поступательного и вращательного движений)
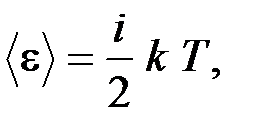
где i – число степеней свободы (для одноатомной молекулы i = 3(пост.); для двухатомной молекулы i = 5 (3 пост. + 2 вращ.); для трех- и более атомной молекулы i = 6 (3 пост.+ 3 вращ.)); k – постоянная Больцмана.
5. Скорость молекул:
 средняя квадратичная
средняя квадратичная
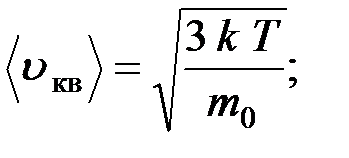
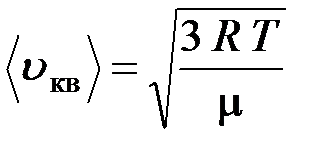 ;
;
 средняя арифметическая
средняя арифметическая
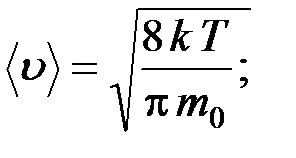
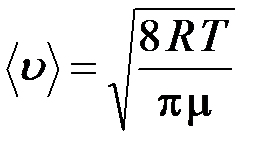 ;
;
 наиболее вероятная
наиболее вероятная
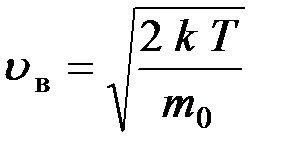 ;
; 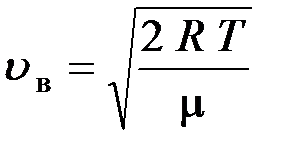 .
.
6. Зависимость давления газа от концентрации молекул n и температуры T
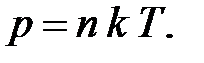
7. Зависимость концентрации молекул газа от высоты во внешнем поле сил тяжести (распределение Больцмана)
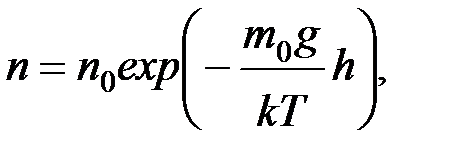
где n и n 0 - концентрации молекул газа, соответственно, на высоте h и на нулевом уровне.
8. Обобщенный вид распределения Больцмана для любого потенциального поля
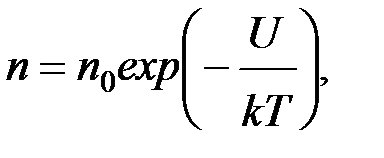
где U – потенциальная энергия молекулы.
9. Барометрическая формула, закон убывания давления газа с высотой
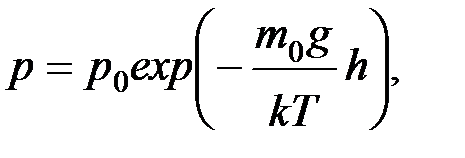 или
или 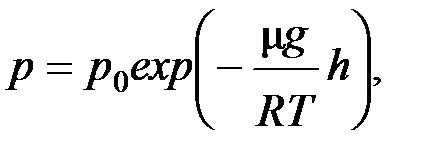
где p, p 0 – давления газа, соответственно, на высоте h и на нулевом уровне.
10. В молекулярно-кинетической теории выделяют три явления переноса:
·перенос массы – диффузия;
·перенос импульса – внутреннее трение;
·перенос энергии – теплопроводность.
Эмпирические законы (для одномерного случая) явлений переноса:
· диффузия – законом Фика
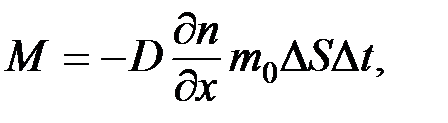
где M – масса диффундирующей компоненты, переносимой через площадь D S за время D t; n – концентрация компоненты; ¶ n /¶ x – градиент концентрации компоненты; m 0 – масса молекулы; D – коэффициент диффузии, для газов, определяемый уравнением:
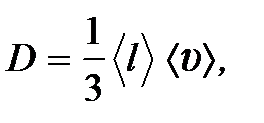
где < l > – средняя длина свободного пробега, расстояние, которое проходит молекула между двумя последовательными столкновениями;
< u > – средняя арифметическая скорость молекул:
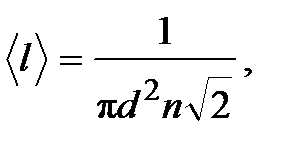
где d – эффективный диаметр молекулы; n – концентрация молекул;
·внутреннее трение (вязкость) – законом Ньютона
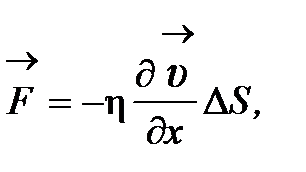
где h- динамический коэффициент вязкости, определяемый по формуле:
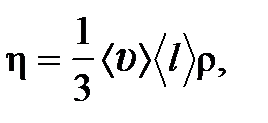
где r – плотность газа;D S – площадь элемента поверхности взаимодействия слоев; ¶ u /¶ x – градиент (поперечный) скорости течения слоев жидкости или газа;
· теплопроводность – законом Фурье
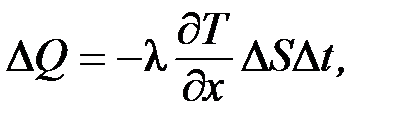
где D S –поверхность, через которую переносится теплота D Q за время D t; l – коэффициент теплопроводности, определяемый по формуле (для газов):
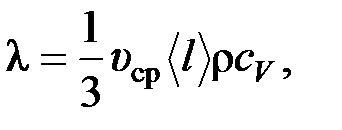
где ¶ T /¶ x – градиент температуры (направление потока теплоты совпадает с направлением падения температуры, чтобы уменьшить существующий градиент температуры); с V – удельная теплоемкость при постоянном объеме; r – плотность газа.
11. Теплоёмкость системы (тела)
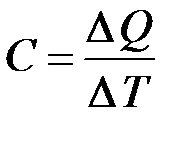 ,
,
где  – количество теплоты, сообщённое системе (телу);
– количество теплоты, сообщённое системе (телу); 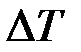 – изменение температуры системы (тела), вызванное сообщением этого количества теплоты.
– изменение температуры системы (тела), вызванное сообщением этого количества теплоты.
12. Молярная и удельная теплоёмкости
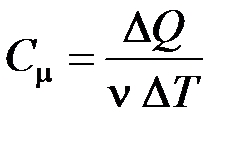 ;
; 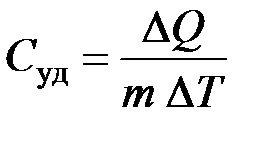 .
.
13. Молярные теплоёмкости идеального газа при постоянном объёме и постоянном давлении
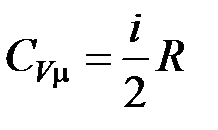 ;
; 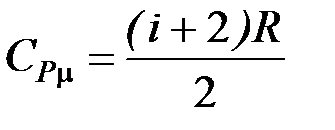 .
.
14. Соотношение между молярной и удельной теплоёмкостями
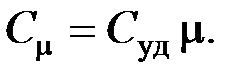
15. Удельные теплоёмкости при постоянном объёме и постоянном давлении
С V уд 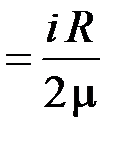 ; С Р уд
; С Р уд 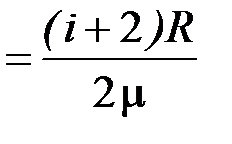 .
.
16. Отношение теплоёмкостей (показатель адиабаты)
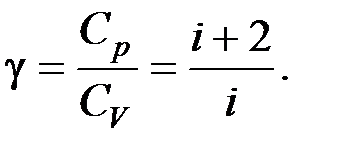
17. Внутренняя энергия идеального газа массой m при некоторой температуре Т
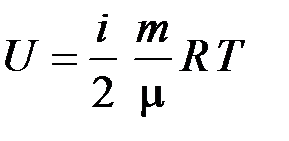 .
.
18. Для любого процесса, происходящего с идеальным газом, изменение внутренней энергии не зависит от процесса и рассчитывается по формуле
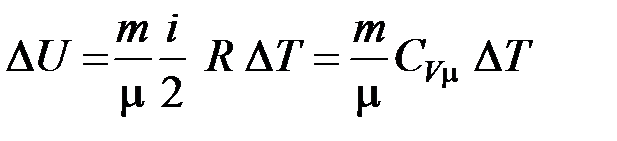 .
.
19. Первое начало термодинамики
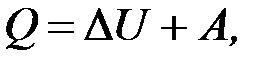
где Q – количество теплоты, сообщённое газу в рассматриваемом процессе; 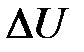 – изменение внутренней энергии в данном процессе; А – работа газа над внешними силами.
– изменение внутренней энергии в данном процессе; А – работа газа над внешними силами.
16. Работа, совершаемая газом при изменении его объёма
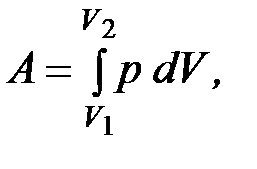
где 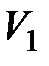 и
и  – начальный и конечный объём соответственно.
– начальный и конечный объём соответственно.
20. Первое начало термодинамики и работа в приложении к изопроцессам.
· Изотермический процесс: T = const;  = 0;
= 0; 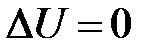 ;
;
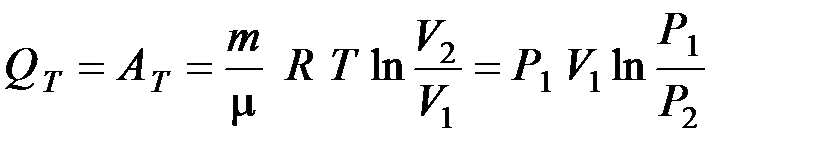 .
.
· Изохорический процесс: V = const;  ;
; 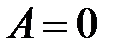 ;
;
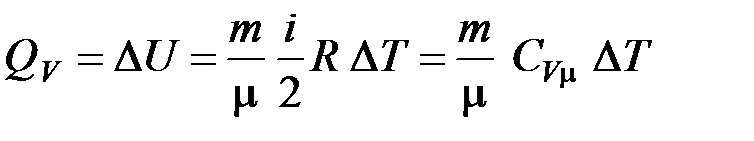 .
.
· Изобарический процесс: Р = const;
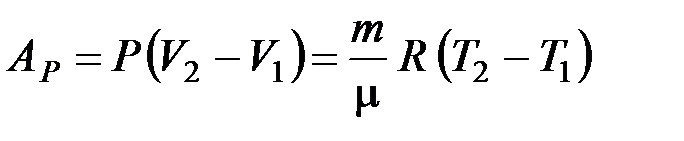 ;
; 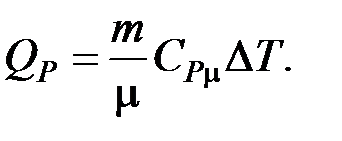
· Адиабатный процесс – процесс, при котором отсутствует теплообмен между системой и окружающей средой:
Q адиаб = 0;
А адиаб = 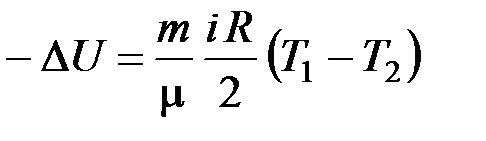 .
.
или
А адиаб = 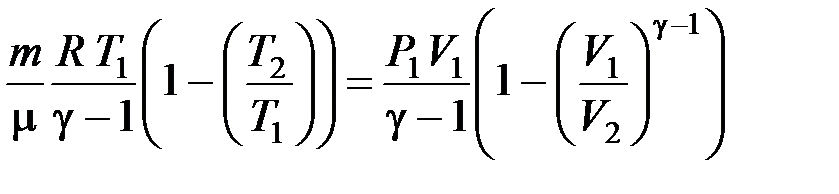 ,
,
где γ– показатель адиабаты.
21. В адиабатном процессе изменяются все параметры идеального газа: P, V и T. Уравнения адиабатного процесса имеют вид уравнений Пуассона
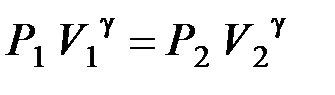 ;
;
 ;
;
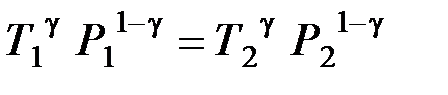 .
.
22. Коэффициент полезного действия для замкнутого процесса тепловой машины:
· идеальной
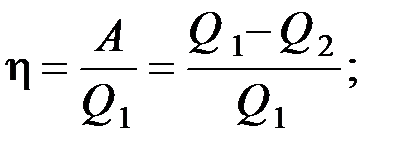
· идеальной, работающей по циклу Карно
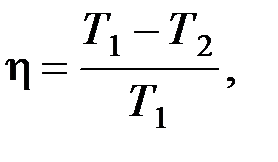
где А – полезная работа; 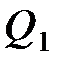 и
и 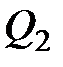 – соответственно количество теплоты, полученное от нагревателя и отданное холодильнику;
– соответственно количество теплоты, полученное от нагревателя и отданное холодильнику;  и
и 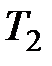 – соответственно температуры нагревателя и холодильника.
– соответственно температуры нагревателя и холодильника.
23. Энтропия системы есть функция ее состояния, определенная с точностью до произвольной постоянной, и численно равная:
 ,
,
где d Q / T - приведенное количество теплоты.
Для адиабатически изолированных систем (d Q =0) d S =0 т.е.
S = const.
Вероятностный характер энтропии определяется выражением, введенным Больцманом:
S = k ln W,
где k – постоянная Больцмана; W – термодинамическая вероятность нахождения системы в том или ином состоянии.
24. Уравнение Ван-дер-Ваальса для реального газа имеет следующий вид:
· для одного моля газа
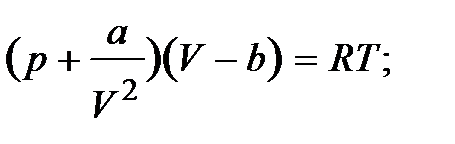
· для произвольного количества вещества
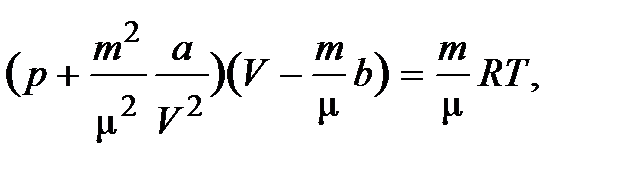
где а / V 2 – поправочный член, учитывающий притяжение между молекулами; b – поправка, учитывающая размеры молекул и в неявном виде силы отталкивания между ними.
Связь между критическими параметрами, с учетом поправок а и b Ван-дер-Ваальса:
- критический объем одного моля газа V кр=3 b;
- критическое давление р кр= а /(27 b 2);
- критическая температура T кр= 8 а /(27 Rb).
Примеры решения задач
Пример 1. В сосуде 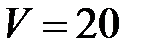 л содержится 10 г азота
л содержится 10 г азота 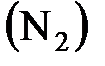 и 20 г углекислого газа
и 20 г углекислого газа 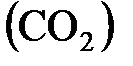 при
при 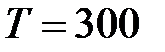 К. Определить молярную массу смеси и давление смеси до и после её нагревания до температуры 400К.
К. Определить молярную массу смеси и давление смеси до и после её нагревания до температуры 400К.
Дано: 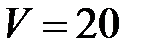 л =
л =  ;
; 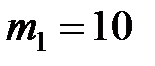 г = 0,01 кг;
г = 0,01 кг; 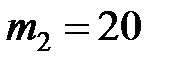 г = 0,02 кг;
г = 0,02 кг; 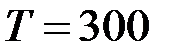 К.
К.
Найти: р; 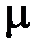 ;
; 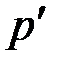 (
(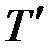 = 400 K).
= 400 K).
Решение. Согласно закону Дальтона давление смеси газов равно сумме парциальных давлений составляющих ее газов
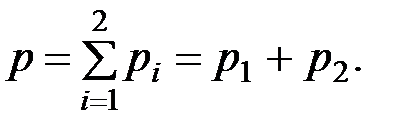 (1)
(1)
Запишем парциальные давления газа азота 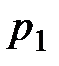 и углекислого газа
и углекислого газа 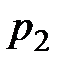 , используя уравнение состояния:
, используя уравнение состояния:
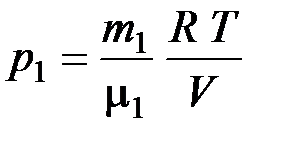 , (2)
, (2)
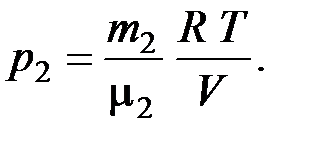 (3)
(3)
Молярные массы газов выбираем по таблице Д.И. Менделеева
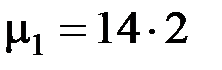 г/моль = 28∙10 –3 кг/моль;
г/моль = 28∙10 –3 кг/моль;
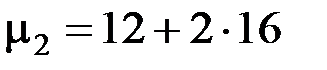 г/моль = 44∙10 –3 кг/моль.
г/моль = 44∙10 –3 кг/моль.
Подставив парциальные давления из уравнений (2) и (3) в (1), получим
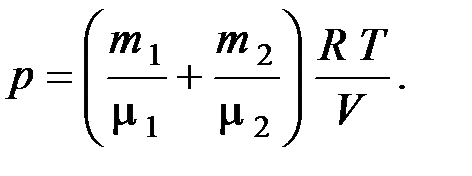
Выполним вычисления давления до нагревания
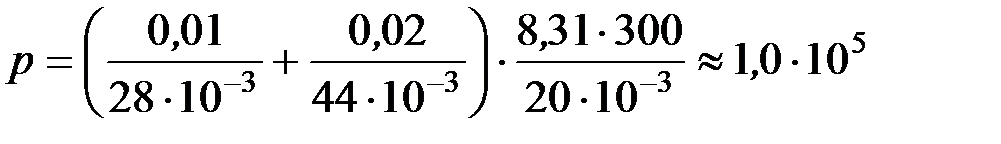 Па.
Па.
Молярная масса смеси
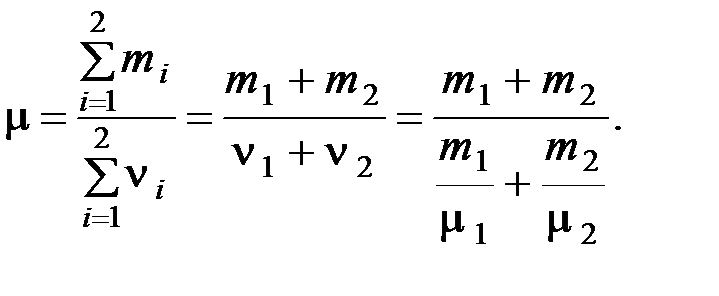
Выполним вычисления молярной массы смеси
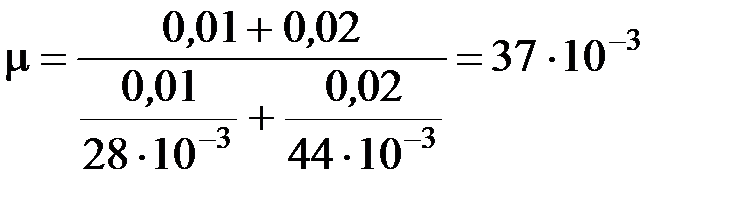 кг/моль.
кг/моль.
Так как объём смеси не изменяется, то уравнение состояния газа можно записать в виде
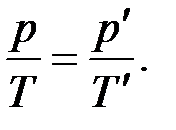
Откуда
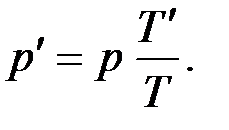
Найдем давление смеси после её нагревания:
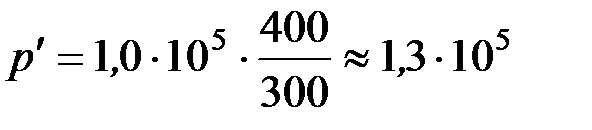 Па.
Па.
Ответ: 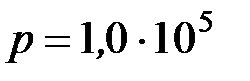 Па;
Па; 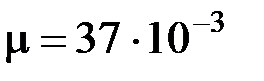 кг/моль;
кг/моль; 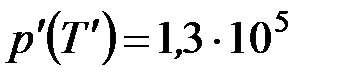 Па.
Па.
Пример 2. Частицы гуммигута диаметром 0,3×10-4см были взвешены в жидкости, плотность которой на 0,2 г/см3 меньше плотности частиц. Температура гуммигута 20°С. Найти по этим данным значение числа Авогадро, если в двух соседних слоях, расстояние между которыми 100 мкм, число частиц различается в два раза.
Дано: d =0,3×10-4см = 0,310- 6 м; ρ – 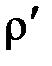 =0,2 г/см3= 200 кг/м3;
=0,2 г/см3= 200 кг/м3;
t = 20°С; h 2 – h 1=100 мкм = 1×10-4м; n 1= 2 n 2.
Найти: NA.
Решение. Проведем расчеты по формуле Больцмана
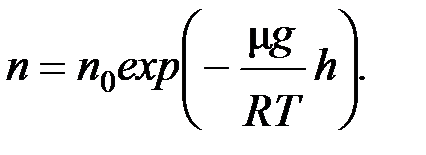
Концентрация молекул на высоте h 1 определяется как
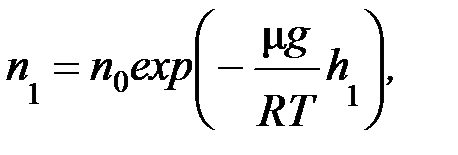
а на высоте h 2
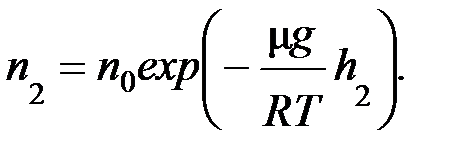
Отсюда, отношение концентраций определим следующей зависимостью
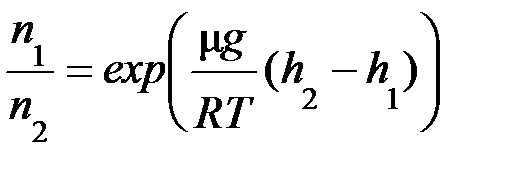 или
или 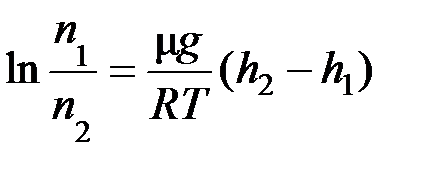 .
.
Т.к. масса частицы определяется выражением m 0 = m/ NA, то можно записать:
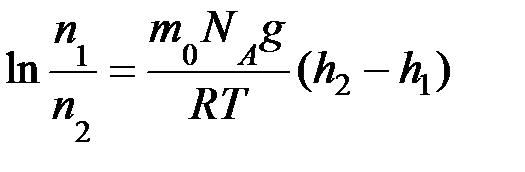 .
.
Из этого выражения, учитывая поправку на силу Архимеда, получим
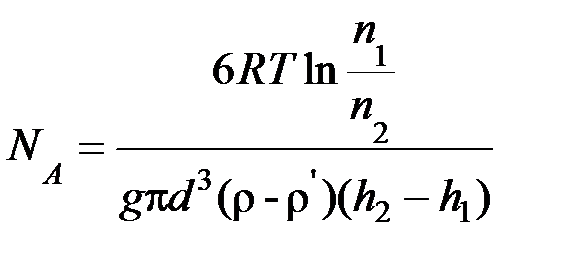 ,
,
где r и 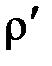 – соответственно плотность гуммигута и жидкости.
– соответственно плотность гуммигута и жидкости.
Выполним вычисления
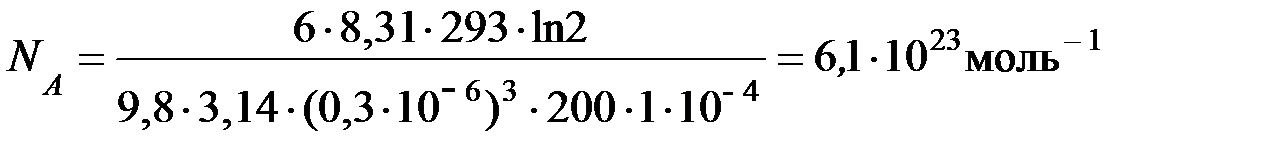
Ответ: 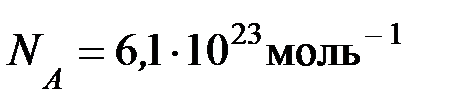
Пример 3. Вычислить удельные теплоемкости cV и с p смеси неона и водорода. Массовые доли газов соответственно равны w1=0,8 и
w2=0,2.
Дано: w1=0,8; w2=0,2; i 1= 3; i 1= 5.
Найти: cV; с p.
Решение. Удельную теплоемкость смеси при постоянном объеме с V найдем из следующих соображений. Теплоту, необходимую для нагревания смеси на D T, выразим двумя соотношениями:
Q = cV (m 1 + m 2)D T,(1)
где c V – удельная теплоемкость смеси; m 1– масса неона; m 2– масса водорода, и
Q = (cV 1 m 1 + cV 2 m 2)D T (2)
где c V 1 и c V 2 – удельные теплоемкости неона и водорода соответственно.
Удельные теплоёмкости при постоянном объёме для неона и водорода соответственно равны
с V 1 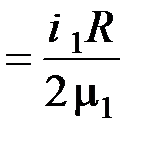 и с V 2
и с V 2 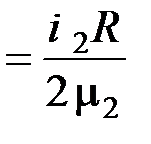 .
.
Приравняв правые части выражений (1) и (2) иразделив обе части полученного равенства на D T, получим
cV (m 1 + m 2) = cV 1 m 1 + cV 2 m 2 ,
откуда
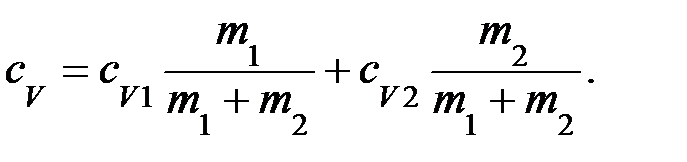 (3)
(3)
Отношения w1 = m 1/(m 1+ m 2) и w2 = m 2/(m 1+ m 2) выражают массовые доли соответственно неона и водорода. С учетом этих значений выражение (3) примет вид
cV = cV 1w1 + cV 2w2.
Выполним вычисления cV 1, cV 2 и cV
с V 1 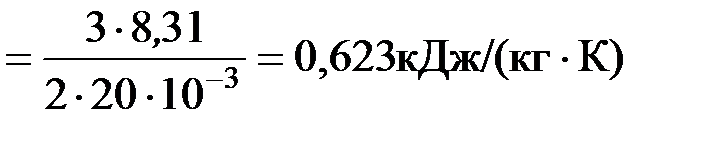 ;
;
с V 2 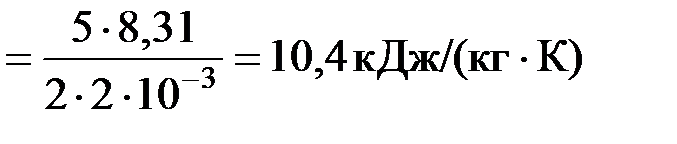 ;
;
cV = 0,623×0,8 + 10,4×0,2 = 2,58 кДж/(кг×К).
Рассуждая таким же образом, получим формулу для вычисления удельной теплоемкости смеси при постоянном давлении:
сР = c Р 1w1 + c Р 2w2,
где c Р 1 и c Р 2 – удельные теплоемкости при постоянном давлении для неона и водорода соответственно.
Удельные теплоёмкости при постоянном давлении для неона и водорода соответственно равны
сР 1 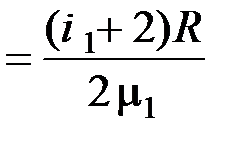 и сР 2
и сР 2  .
.
Выполним вычисления c Р 1, c Р 2 и c Р
сР 1 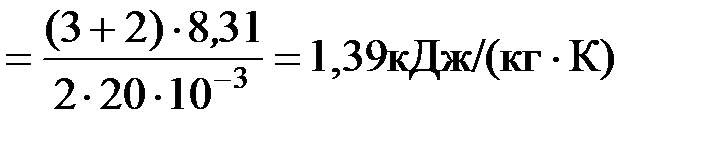 ;
;
сР 2  ;
;
c Р = 1,39×0,8 + 14,54×0,2 = 4,02 кДж/(кг×К).
Ответ: cV =2,58 кДж/(кг×К); c Р = 4,02 кДж/(кг×К).
Пример 4. Кислород занимает объем V 1=1 м3 и находится под давлением р 1 = 200 кПа. Газ нагрели сначала при постоянном давлении до объема V 2=3 м3, а затем при постоянном объеме до давления
p 3= 500 кПа. Найти: 1) изменение D U внутренней энергии газа; 2) совершенную им работу A; 3) количество теплоты Q,переданное газу.
Дано: V 1=1 м3; V 2=3 м3; р 1 = 200 кПа; p 3= 500 кПа; i = 5.
Найти: D U; A; Q.
Решение. 1. Изменение внутренней энергии газа при переходе его из состояния 1 в состояние 3
D U = cVm D T,
где cV – удельная теплоемкость газа при постоянном объеме; m – масса газа; D Т – разность температур, соответствующих конечному 3 и начальному 1 состояниям газа, т. е.D T = T 3- T 1.
Так как
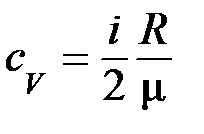
где m — молярная масса газа, то

Температуры T 1 и T 3выразим из уравнения Менделеева-Клапейрона:
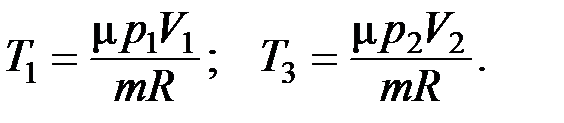
С учетом этого получаем:

Выполним вычисления D U
 МДж.
МДж.
2. Полная работа, совершаемая газом, равна
А = A 1+ A 2,
где А 1– работа на участке 1-2; А 2– работа на участке 2-3.
На участке 1-2 давление постоянно (р =const). Работа в изобарном процессе
A 1= p 1 (V 2 – V 1).
На участке 2-3 объем газа не изменяется (V =const).Следовательно, работа газа на этом участке равна нулю (А 2= 0).
Таким образом, полная работа
A = A 1= р (V 2 – V 1).
Выполним вычисления А
A = 2×105×(3 – 1) = 0,4 МДж.
3. Согласно первому началу термодинамики, количество теплоты Q, переданное газу, равно сумме работы А, совершенной газом, и изменению D U внутренней энергии
Q =D U + A.
Выполним вычисления Q
Q =3,25 + 0,4 = 3,65 МДж.
Ответ: D U = 3,25 МДж; А =0,4 МДж; Q = 3,65 МДж.
Пример 5. Найти КПД тепловой машины, работающей по циклу, состоящему из двух изохор и двух изобар, если известно что 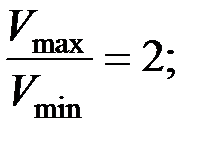
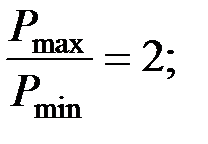
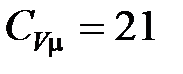 Дж/(К∙моль).
Дж/(К∙моль).
Дано: 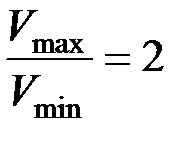 ;
; 
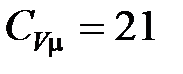 Дж/(К∙моль).
Дж/(К∙моль).
Найти: 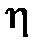 .
.
Решение. Изобразим цикл, по которому работает тепловая машина, в координатах
P - V (рис. 9).
Рис. 9 – Цикл тепловой машины
Как видно из рисунка 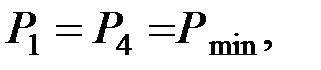
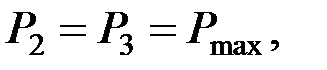
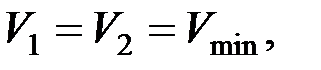
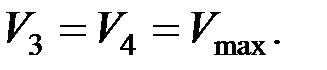
По определению КПД
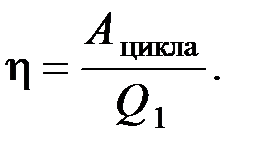
Работа тепловой машины за цикл численно равна площади фигуры, ограниченной кривой цикла. В данной задаче работа численно равна площади прямоугольника
A цикла = (P 2 – P 1) (V 2 – V 1) = (2 P 1 – P 1) (2 V 1 – V 1) = P 1 V 1
так как 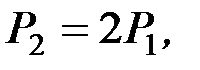
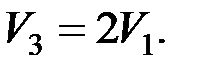
Используя уравнение состояния идеального газа (для состояния 1) 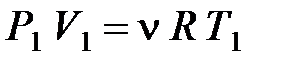 , получаем
, получаем
 (1)
(1)
В процессах 1-2 и 2-3 рабочее тело получает теплоту, так как с газом происходит изохорное нагревание и изобарное расширение (Q 1-2 > 0, Q 2-3 > 0).
Тогда
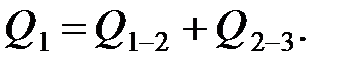
В процессах изохорного охлаждения 3-4 и изобарного сжатия 4-1 рабочее тело машины отдаёт теплоту(Q 1-2 < 0, Q 2-3 < 0).
Количество подведённой теплоты равно
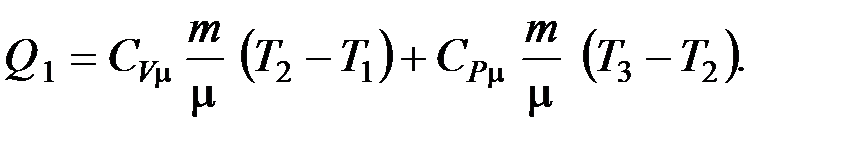 (2)
(2)
Используя уравнение состояния 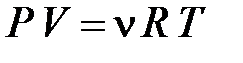 , определим температуры
, определим температуры 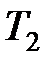 и
и 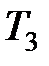 :
:
1) в процессе 1-2 (изохорный процесс)
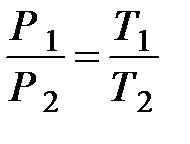 ,
, 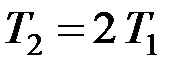 , (3)
, (3)
т. к. Р 2= 2 Р 1;
2) в процессе 2-3 (изобарный процесс)
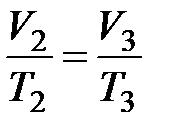 ,
, 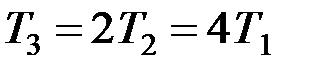 , (4)
, (4)
т. к. V 3 = 2 V 2.
Молярные теплоёмкости в изобарном и изохорном процессах:
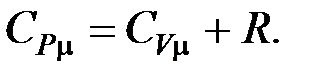 (5)
(5)
Подставим выражения (3), (4), (5) в (2), получим
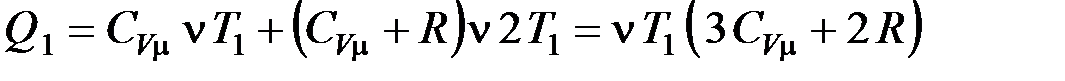 . (6)
. (6)
Подставим уравнения (6) и (1) в выражение для определения 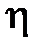 , получим
, получим
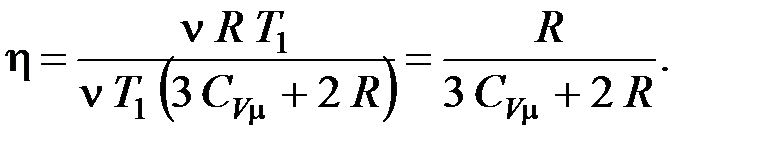
Выполним вычисления КПД идеальной тепловой машины
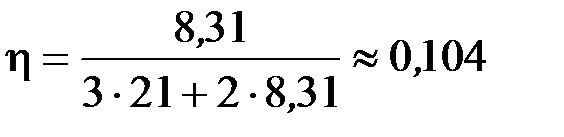 или
или 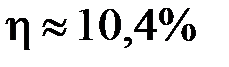 .
.
Ответ: 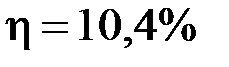 .
.
Пример 6. Определить изменение D S энтропии при изотермическом расширении кислорода массой m =10 г от объема V 1=25 л до объема V 2=100 л.
Дано: V 1=25 л; V 2= 100 л; m = 10 г = 10×10-3 кг.
Найти: D S.
Решение. Так как процесс изотермический, то в общем, выражении энтропии
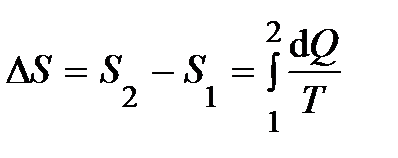
температуру выносим за знак интеграла.
Тогда
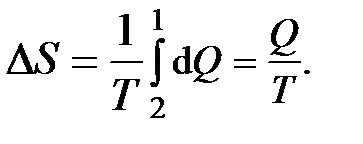 (1)
(1)
Количество теплоты Q, полученное газом, найдем по первому началу термодинамики: Q = А +D U.
Для изотермического процесса D U =0, следовательно,
Q=А, (2)
Работа А в изотермическом процессе
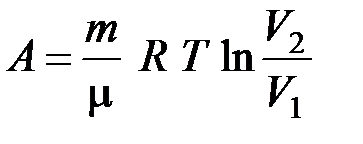 . (3)
. (3)
С учетом (2) и (3) равенство (1) примет вид
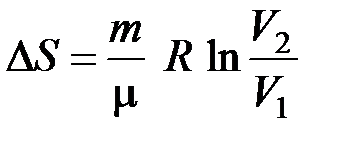 .
.
Выполним вычисления D S
 Дж/К.
Дж/К.
Ответ: D S = 3,60 Дж/К.
Пример 7. В баллоне вместимостью V = 8 л находится кислород массой m = 0,3 кг при температуре Т =300 К. Найти, какую часть вместимости сосуда составляет собственный объем молекул газа. Определить отношение внутреннего давления p' к давлению р газа на стенки сосуда.
Дано: V = 8 л = 8×10-3 м3; m = 0,3 кг; Т =300 К.
Найти: k 1; k 2.
Решение. Для получения ответа на первый вопрос задачи необходимо найти отношение
k 1 = V ' / V (1)
где V ' — собственный объем молекул.
Собственный объем молекул найдем, воспользовавшись постоянной b Ван-дер-Ваальса, равной учетверенному объему молекул, содержащихся в одном моле реального газа. В уравнении Ван-дер-Ваальса
 (2)
(2)
поправка b означает учетверенный объем молекул всего газа, тоесть
n b =4 V '.
Тогда V '= n b /4 или V '= mb /(4m),
где n= m/М –количество вещества; m - молярная масса.
Подставив полученное значение V ' в выражение (1), получим
k 1 = mb /(4m V).
Выполним вычисления k 1
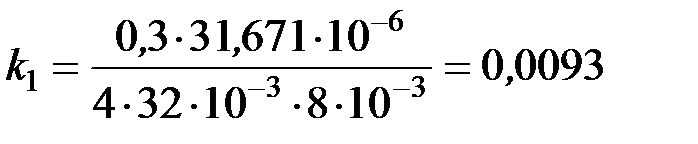 или k 1 = 0,93%.
или k 1 = 0,93%.
Следовательно, собственный объем молекул составляет 0,93% от объема сосуда.
Для ответа на второй вопрос задачи надо найти отношение
k 2 =p' / р. (3)
Согласно уравнению (2)
р' =n2 а / V 2или р'=m 2 а /m2 V 2,
где а -постоянная Ван-дер-Ваальса для одного моля газа.
Выполним вычисления р' по формуле (4)
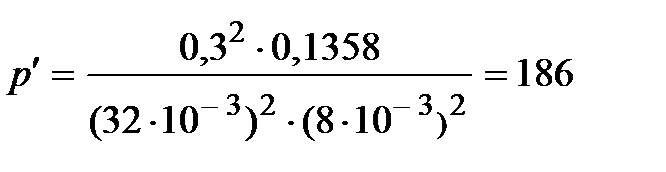 кПа.
кПа.
Давление p, производимое газом на стенки сосуда, найдем из уравнения (2)

Выполним вычисления p
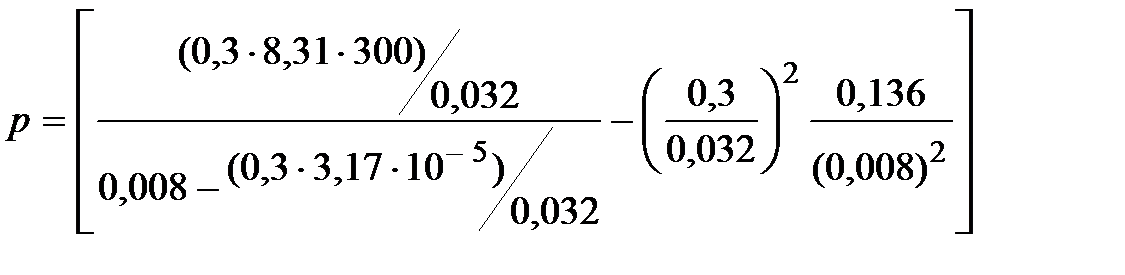 =2,84 МПа.
=2,84 МПа.
Выполним вычисления k 2 согласно выражению (3)
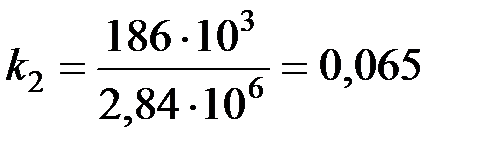 или k 2 = 6,5%.
или k 2 = 6,5%.
Следовательно, давление газа, обусловленное силами притяжения молекул, составляет 6,5% давления газа на стенки сосуда.
Ответ: k 1 = 0,93%, k 2 = 6,5%.



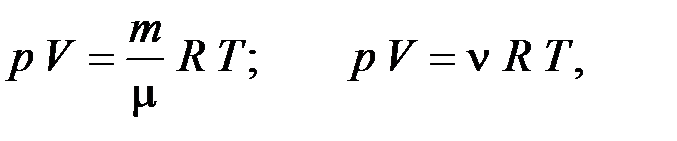
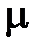 – масса и молярная масса газа; R – универсальная газовая постоянная;
– масса и молярная масса газа; R – универсальная газовая постоянная;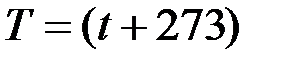 К; t – температура по шкале Цельсия;
К; t – температура по шкале Цельсия;  – количество вещества.
– количество вещества.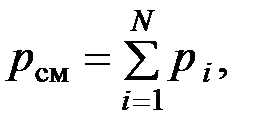
 – парциальное давление i -ой компоненты смеси (давление, создаваемое одним компонентом смеси в объеме смеси и при её темпера-
– парциальное давление i -ой компоненты смеси (давление, создаваемое одним компонентом смеси в объеме смеси и при её темпера-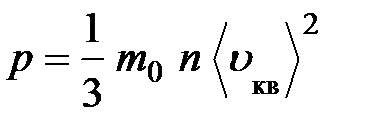 или
или 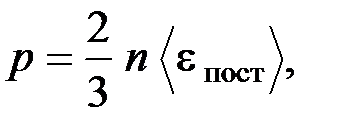
 – масса одной молекулы; n – концентрация молекул;
– масса одной молекулы; n – концентрация молекул;  – средняя квадратичная скорость молекул;
– средняя квадратичная скорость молекул; 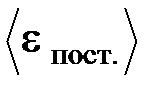 – средняя кинетическая энергия поступательного движения одной молекулы.
– средняя кинетическая энергия поступательного движения одной молекулы.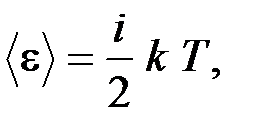
 средняя квадратичная
средняя квадратичная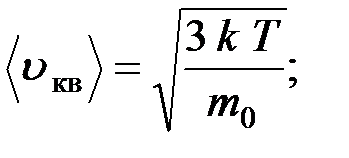
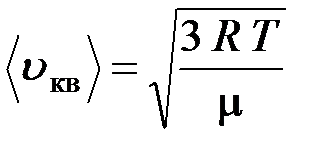 ;
; средняя арифметическая
средняя арифметическая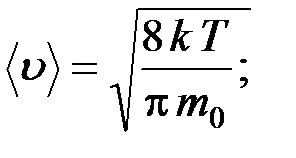
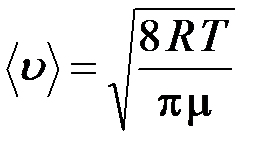 ;
; наиболее вероятная
наиболее вероятная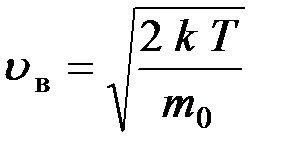 ;
; 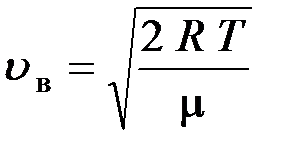 .
.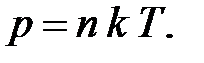
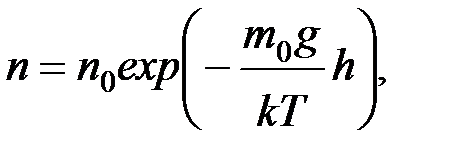
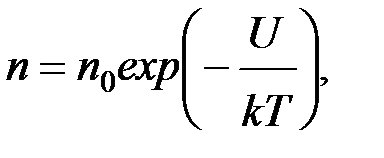
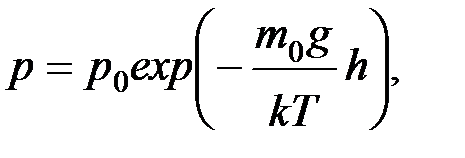 или
или 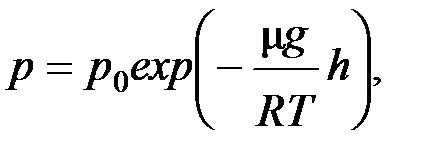
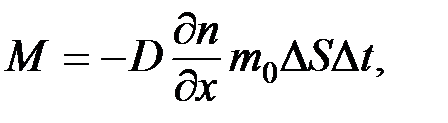
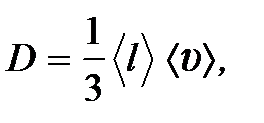
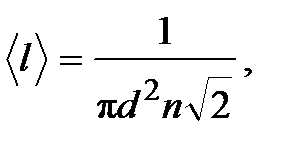
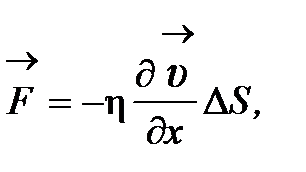
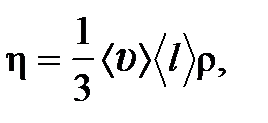
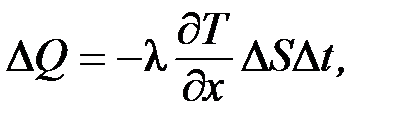
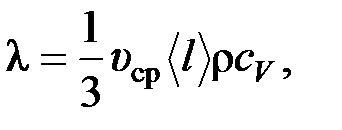
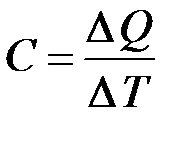 ,
, – количество теплоты, сообщённое системе (телу);
– количество теплоты, сообщённое системе (телу); 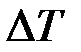 – изменение температуры системы (тела), вызванное сообщением этого количества теплоты.
– изменение температуры системы (тела), вызванное сообщением этого количества теплоты.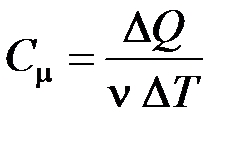 ;
; 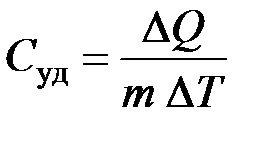 .
.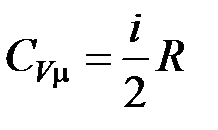 ;
; 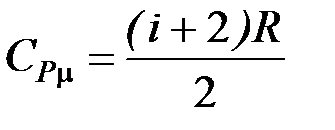 .
.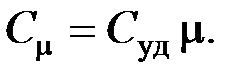
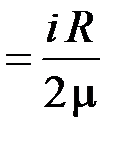 ; С Р уд
; С Р уд 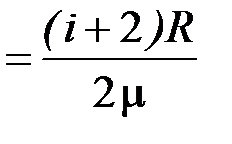 .
.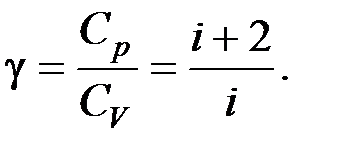
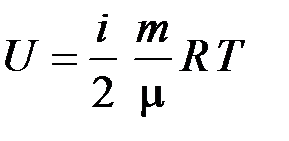 .
.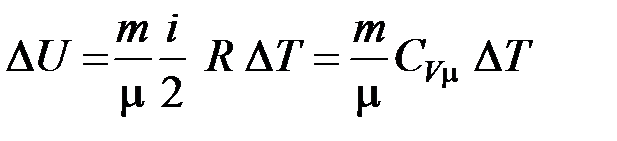 .
.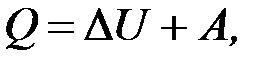
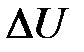 – изменение внутренней энергии в данном процессе; А – работа газа над внешними силами.
– изменение внутренней энергии в данном процессе; А – работа газа над внешними силами.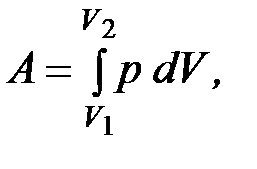
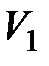 и
и  – начальный и конечный объём соответственно.
– начальный и конечный объём соответственно. = 0;
= 0; 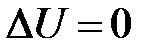 ;
;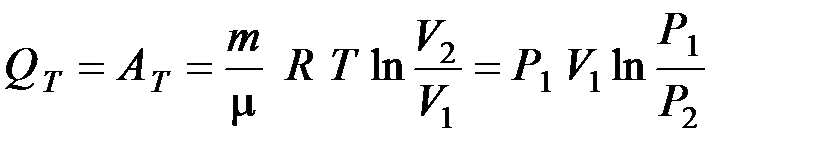 .
. ;
;  ;
;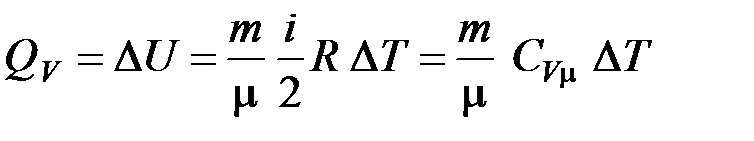 .
.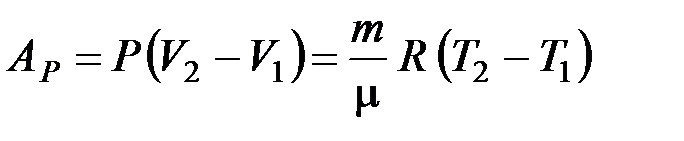 ;
; 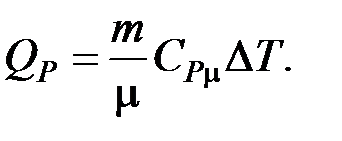
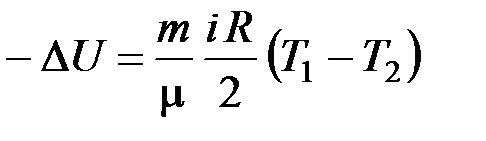 .
.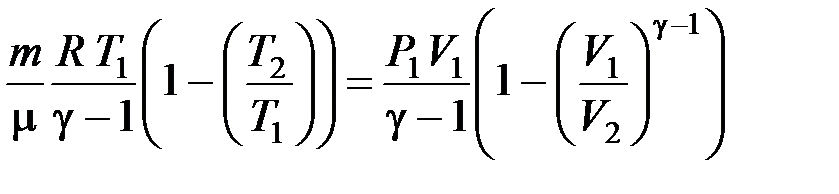 ,
,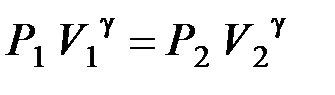 ;
; ;
;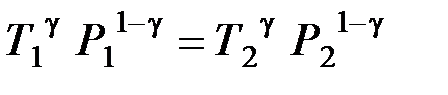 .
.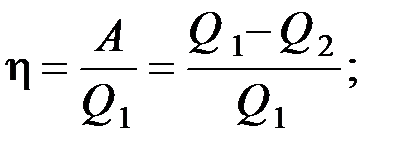
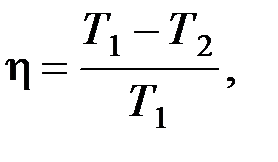
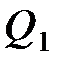 и
и 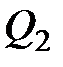 – соответственно количество теплоты, полученное от нагревателя и отданное холодильнику;
– соответственно количество теплоты, полученное от нагревателя и отданное холодильнику;  и
и 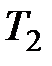 – соответственно температуры нагревателя и холодильника.
– соответственно температуры нагревателя и холодильника. ,
,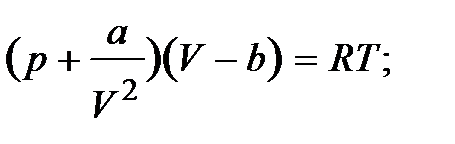
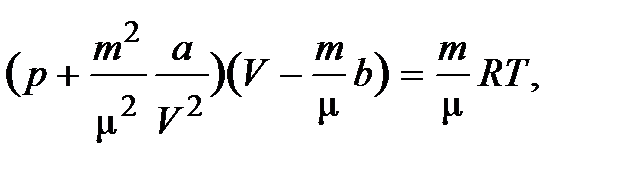
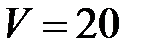 л содержится 10 г азота
л содержится 10 г азота 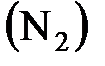 и 20 г углекислого газа
и 20 г углекислого газа 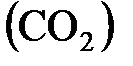 при
при 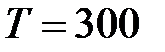 К. Определить молярную массу смеси и давление смеси до и после её нагревания до температуры 400К.
К. Определить молярную массу смеси и давление смеси до и после её нагревания до температуры 400К.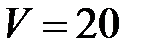 л =
л =  ;
; 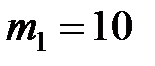 г = 0,01 кг;
г = 0,01 кг; 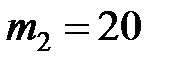 г = 0,02 кг;
г = 0,02 кг; 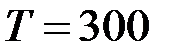 К.
К.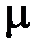 ;
; 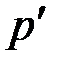 (
(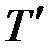 = 400 K).
= 400 K).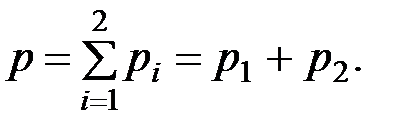 (1)
(1)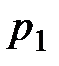 и углекислого газа
и углекислого газа 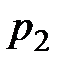 , используя уравнение состояния:
, используя уравнение состояния: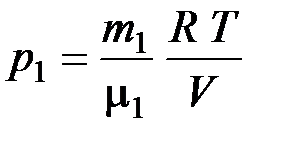 , (2)
, (2)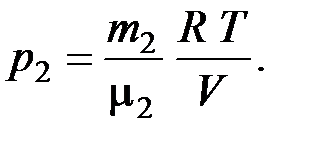 (3)
(3)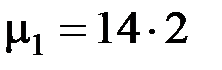 г/моль = 28∙10 –3 кг/моль;
г/моль = 28∙10 –3 кг/моль;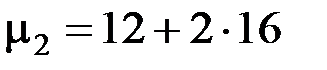 г/моль = 44∙10 –3 кг/моль.
г/моль = 44∙10 –3 кг/моль.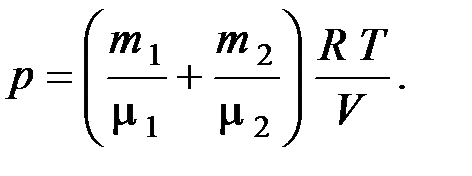
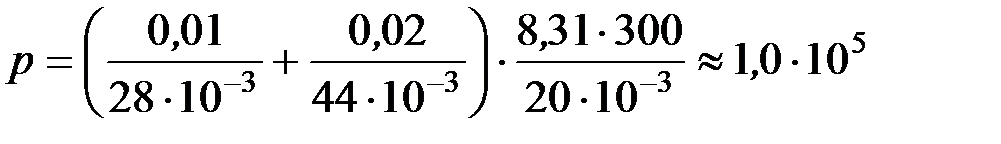 Па.
Па.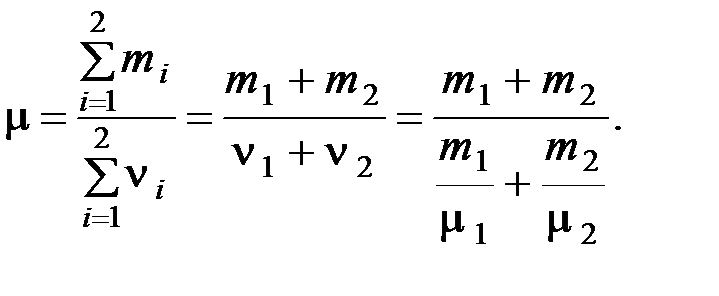
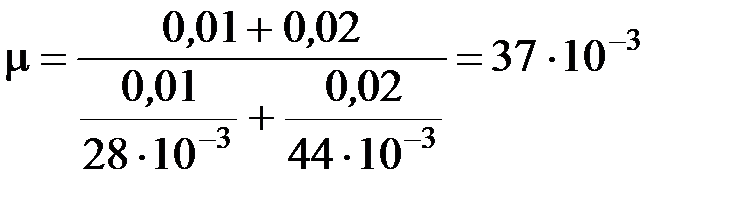 кг/моль.
кг/моль.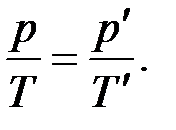
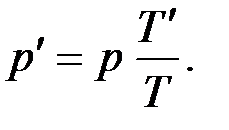
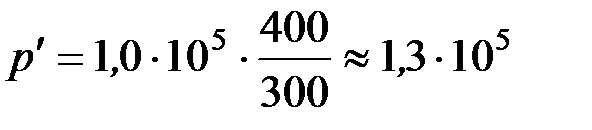 Па.
Па.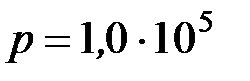 Па;
Па; 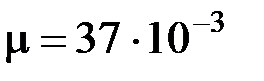 кг/моль;
кг/моль; 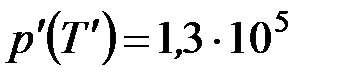 Па.
Па.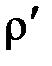 =0,2 г/см3= 200 кг/м3;
=0,2 г/см3= 200 кг/м3; 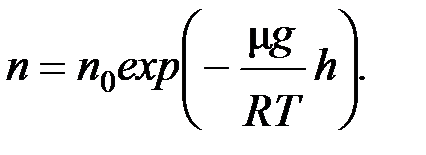
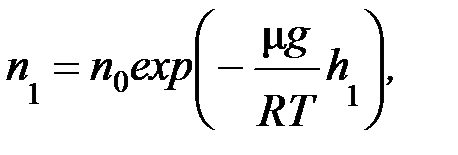
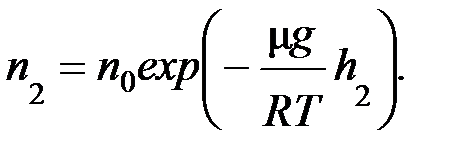
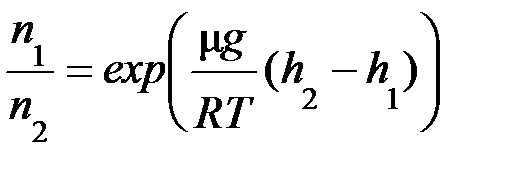 или
или 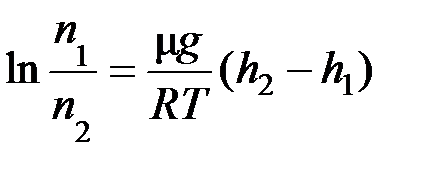 .
.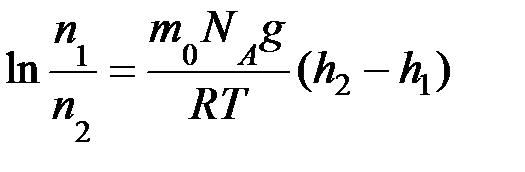 .
.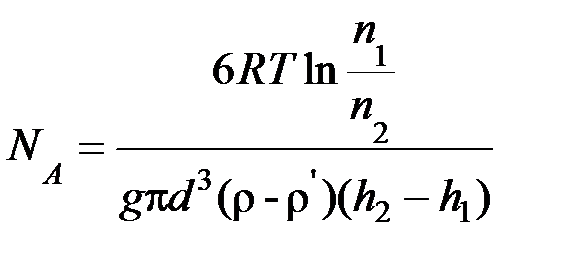 ,
,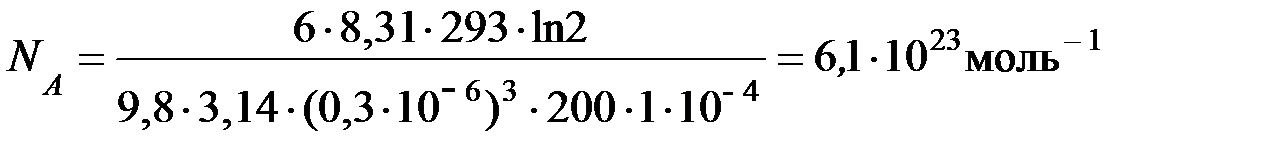
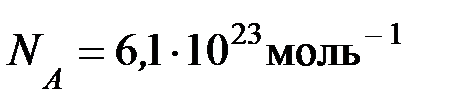
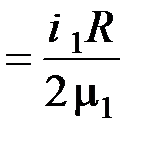 и с V 2
и с V 2 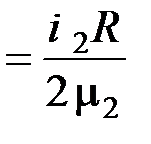 .
.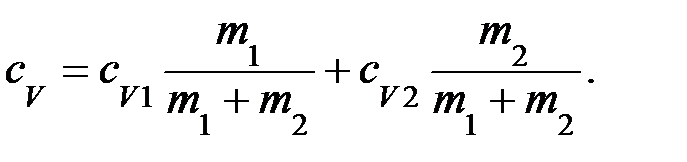 (3)
(3)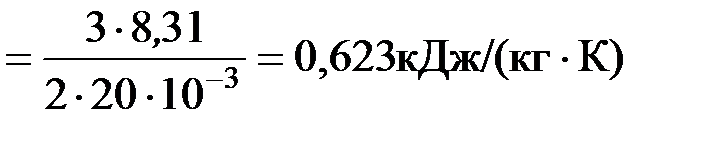 ;
;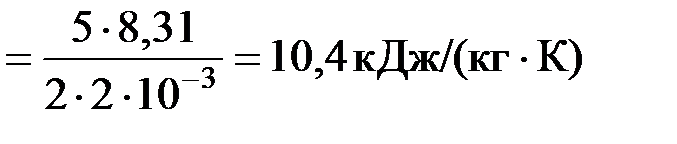 ;
;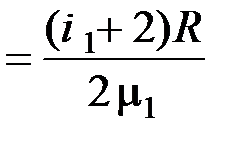 и сР 2
и сР 2  .
.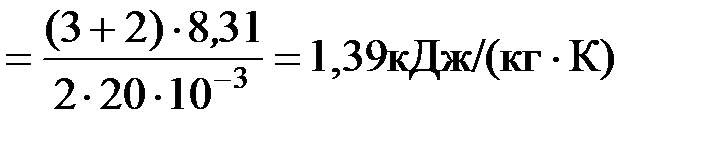 ;
; ;
;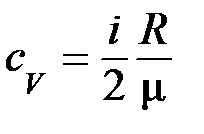

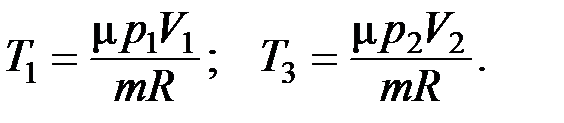

 МДж.
МДж.
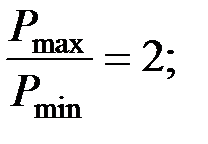
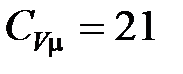 Дж/(К∙моль).
Дж/(К∙моль).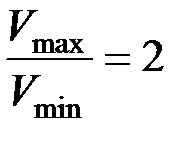 ;
; 
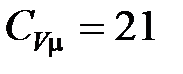 Дж/(К∙моль).
Дж/(К∙моль).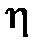 .
.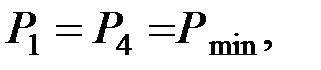
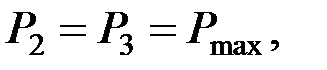
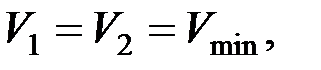
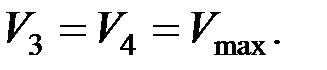
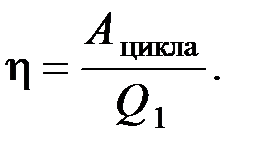
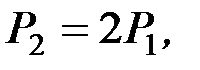
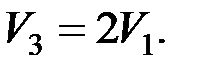
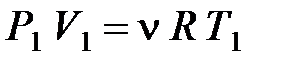 , получаем
, получаем (1)
(1)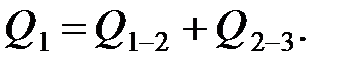
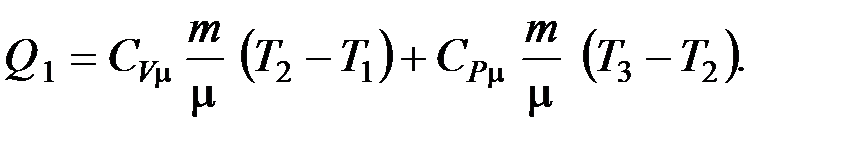 (2)
(2)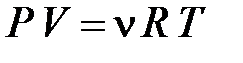 , определим температуры
, определим температуры 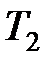 и
и 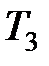 :
: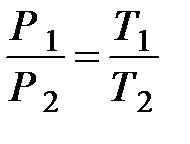 ,
, 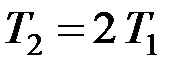 , (3)
, (3)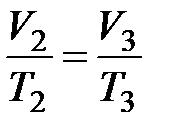 ,
, 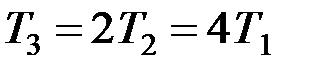 , (4)
, (4)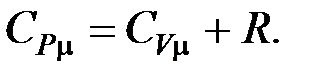 (5)
(5)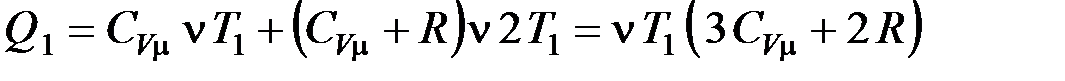 . (6)
. (6)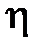 , получим
, получим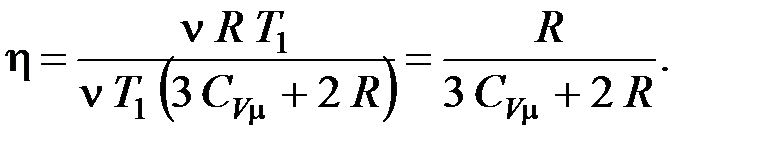
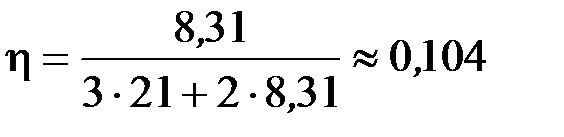 или
или 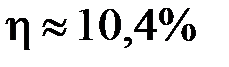 .
.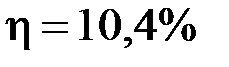 .
.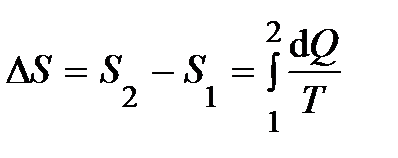
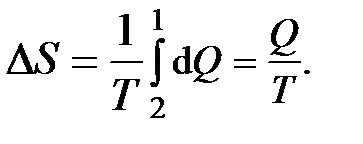 (1)
(1)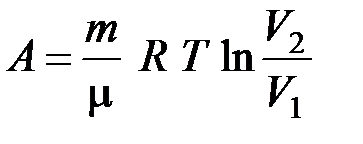 . (3)
. (3)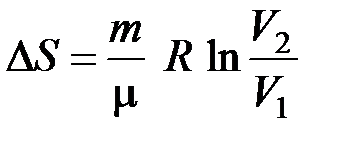 .
. Дж/К.
Дж/К. (2)
(2)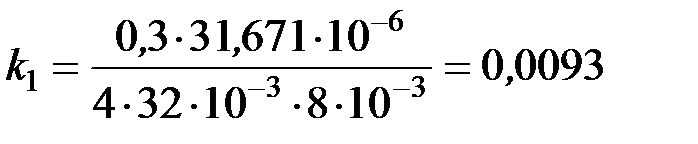 или k 1 = 0,93%.
или k 1 = 0,93%.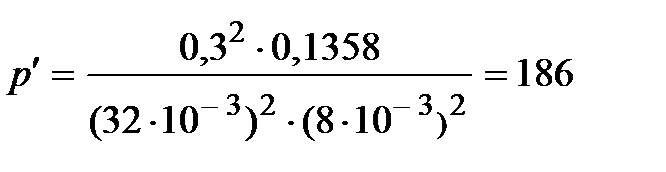 кПа.
кПа.
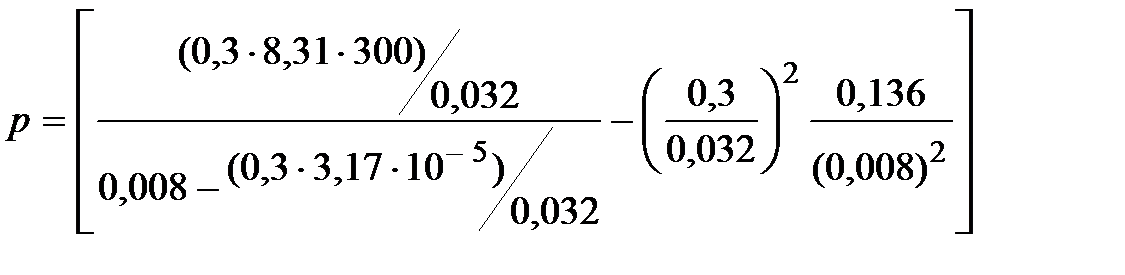 =2,84 МПа.
=2,84 МПа.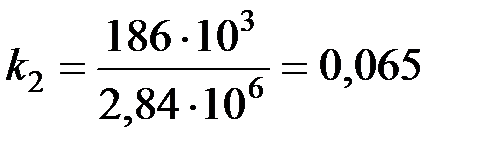 или k 2 = 6,5%.
или k 2 = 6,5%.


