Убиквити́н (от англ. ubiquitous — «вездесущий») — небольшой (8,5 кДа) консервативный белок эукариот, участвующий в регуляции процессов внутриклеточной деградации других белков, а также в модификации их функций. Он присутствует почти во всех тканях многоклеточных эукариот, а также у одноклеточных эукариотических организмов. В геноме человека есть четыре гена, кодирующих убиквитин: UBB, UBC, UBA52 и RPS27A.
Убиквитинирование- это посттрансляционное присоединение ферментами убиквитинлигазами одного или нескольких мономеров убиквитина с помощью ковалентной связи к боковым аминогруппам белка-мишени. Присоединение убиквитина может оказывать различное воздействие на белки-мишени: оно влияет на внутриклеточную локализацию, оказывает воздействие на их активность, способствует или препятствует белок-белковым взаимодействиям. Однако первой открытой функцией убиквитина стала протеолитическая деградация белков, помеченных полиубиквитиновыми цепями (в них последующие убиквитиновые звенья присоединяются к боковым аминогруппам предыдущей молекулы убиквитина), с помощью протеасомы 26S. Убиквитин регулирует и такие важные процессы, как пролиферация, развитие и дифференцировка клеток, реакция на стресс и патогены, репарация ДНК.
Убиквитинлигаза (англ. E3 ubiquitinligase) — фермент-лигаза, ковалентно присоединяющий убиквитин к белку-мишени изопептидной связью. Убиквитинлигазы являются частью системы убиквитинопосредованного распада белка в протеасомах. Известно, что протеасома расщепляет не любые белки, а только те, которые были «помечены» убиквитином. Убиквитинлигазы специфично узнают белки-субстраты и участвуют в их полиубиквитинировании (присоединении цепочек из молекул убиквитина), которое, в конечном счёте, приводит к деградации последних в протеасомах. Кроме этого, убиквитинлигазы осуществляют и другие модификации белков убиквитином, такие как моноубиквитинирование и мультиубиквитинирование, которые имеют регуляторное значение. В геноме человека обнаружено более 500 генов убиквитинлигаз.
За десяток лет выяснились основные этапы этой регуляции, общая схема которой приведена на рис. 2.
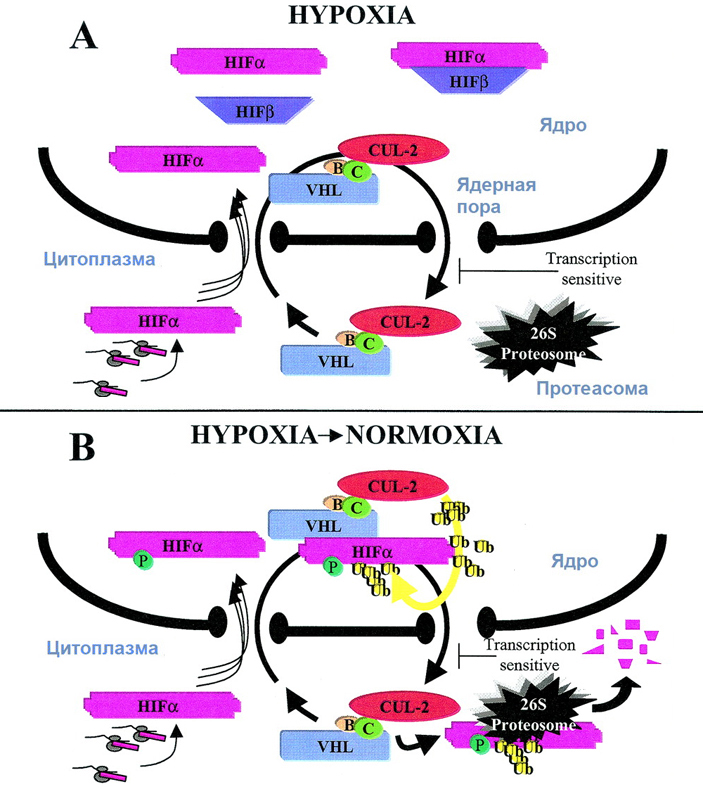
Рис. 2. Общая схема контроля реакции клеток на доступность кислорода. А — при гипоксии белок VHL, курсирующий вместе с другими компонентами убиквитинирующего комплекса (элонгины B и C, CUL-2) между ядром и цитоплазмой, не взаимодействует с HIFα. Субъединицы фактора HIF, поступая в ядро, связываются и направляются к генам-мишеням, активируя их транскрипцию. B — при нормализации доступа кислорода происходит убиквитинирование белка HIFα, опосредованное его взаимодействием с VHL, после чего HIFα экспортируется в цитоплазму и разрушается протеасомами. Рисунокизстатьи I Groulx, S. Lee, 2002. Oxygen-Dependent Ubiquitination and Degradation of Hypoxia-Inducible Factor Requires Nuclear-Cytoplasmic Trafficking of the von Hippel-Lindau Tumor Suppressor Protein
Первоначально в 1991 году Рэтклифф с коллегами обнаружил около 3'-концевого участка гена эритропоэтина регуляторный участок (энхансер), присутствие которого определяет способность гена повышать уровень экспрессии при дефиците кислорода (C. W. Pughet al., 1991. Functional analysis of an oxygen-regulated transcriptional enhancer lying 3' to the mouse erythropoietin gene).
Годом позже в лаборатории, где работал ГреггСеменза был выделен и исследован транскрипционный фактор, связывающийся с ДНК в этой области, — он получил название HIF(Hypoxia-induciblefactor) — фактор, индуцируемый гипоксией)(G. L. Semenza, G. L. Wang, 1992. A nuclear factor induced by hypoxia via de novo protein synthesis binds to the human erythropoietin gene enhancer at a site required for transcriptional activation).
Этот белок формируется из двух субъединиц: одна из них обозначается как HIFα, другая — HIFβ. Вскоре было установлено, что HIF работает не только в почках и печени, но и во всех прочих типах клеток организма (G. L. Wang, G. L. Semenza, 1993. General involvement of hypoxia-inducible factor 1 in transcriptional response to hypoxia).
Здесь можно отметить, что у человека и других позвоночных обе субъединицы фактора HIF представлены семействами, включающими по 3 гена, которые работают в разных типах клеток и регулируют разные наборы генов. Причем белковый продукт гена HIF3α, по-видимому, является ингибитором по отношению к продукту гена HIF1α.Количество мРНК и белка HIFβ в клетках относительно постоянно, оно не зависит от концентрации кислорода, а вот субъединица HIFα является регулируемой. Во-первых, ее количество в клетке держится на низком уровне при нормальном уровне кислорода, но резко возрастает при гипоксии. Во-вторых, при гипоксии он обнаруживается исключительно в ядре, а при нормальном уровне кислорода — преимущественно в цитоплазме, что обеспечивается взаимодействием белка с вспомогательными белками системы переноса белков между ядром и цитоплазмой.
Исследования Кэлина позволили выяснить, что количество белка HIFα регулируется посредством протеолиза — разрушения при помощи протеасом (M. Ivanet al., 2001. HIFα Targeted for VHL-Mediated Destruction by Proline Hydroxylation: Implications for O2 Sensing).
Протеасомы узнают белки-мишени по пришитым убиквитиновым меткам. В случае HIFα убиквитинирование осуществляется при участии того самого белка VHL, который уже упоминался выше. Ген, кодирующий белок VHL, входит в число наиважнейших генов-супрессоров опухолей. И это, по-видимому, напрямую связано с его ролью в регуляции HIF — как минимум, отчасти (W. G. Kaelin, 2005. The von Hippel-Lindau tumor suppressor protein: roles in cancer and oxygen sensing, K. Kondo et al., 2003. Inhibition of HIF2α Is Sufficient to Suppress pVHL-Defective Tumor Growth).
Позднее были установлены новые подробности. Оказалось, что для взаимодействия с VHL требуется появление гидроксильных групп (-OH) на двух остатках пролина в молекуле HIFα. Гидроксилирование осуществляется ферментами PHD (Prolilhydroxylase), которые кодируются тремя генами (PHD1,2,3). Эта реакция происходит при непосредственном участии молекулярного кислорода (O2), а также требует присутствия ионов железа и аскорбиновой кислоты. При недостатке какого-то из этих компонентов реакция гидроксилирования становится невозможной, что приводит к прекращению взаимодействия HIFα с VHL, и количество белка HIFα начинает расти.
Еще одной составляющей изученного механизма оказалось гидроксилирование по остатку аспарагина в молекуле HIFα, которое осуществляется (при тех же условиях, что и гидроксилирование по пролину) другим ферментом, названным FIH1 (Factorinhibiting HIF). Гидроксилирование остатка аспарагина препятствует взаимодействию HIFα с транскрипционным коактиватором (CBP или p300), без которого уровень активации транскрипции генов-мишеней оказывается заметно ниже.Аспарагин-гидроксилаза и пролин-гидроксилазы имеют разный порог активации. Полномасштабный ответ на гипоксию развивается при парциальном давлении кислорода около 1% от нормы или ниже.
При этой концентрации гидроксилазы абсолютно неактивны. По мере повышения концентрации кислорода после гипоксии первым активируется белок FIH-1, который гидроксилирует остатки аспарагина, приводя к частичному подавлению активаторной функции HIF, а при дальнейшем приближении концентрации кислорода к нормальному уровню становится активной и диоксигеназа PHD, гидроксилирующаяостатки пролина, и концентрация HIFα начинает быстро снижаться (рис3). 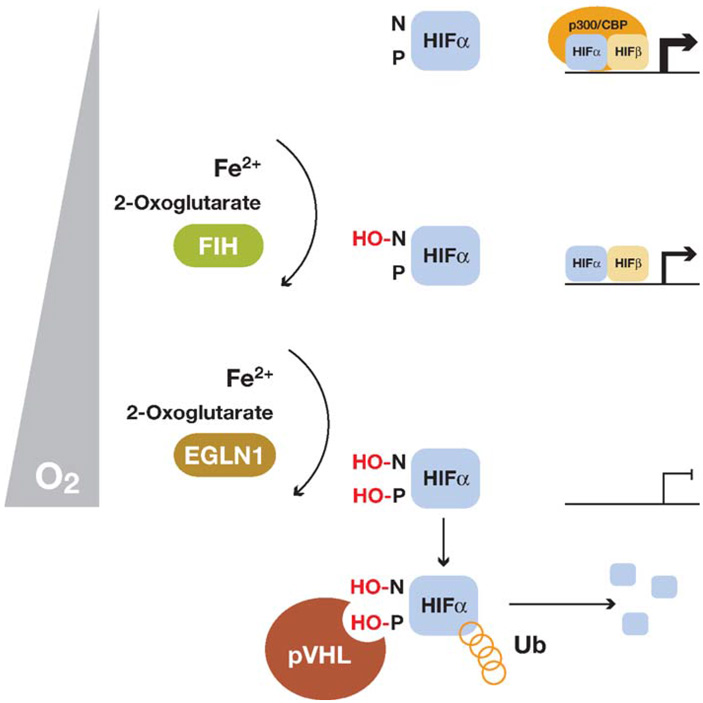
Рис. 3. Схема регулирования функции фактора HIF гидроксилазами. EGLN — альтернативное название фермента PHD, остальные пояснения в тексте. Рисунокизстатьи W. G. Kaelin, 2005. Proline hydroxylation and gene expression
Позже оказалось, что помимо убиквитинирования, VHL способен блокировать работу HIF еще и другим путем — привлекая к нему белки-репрессоры, препятствующие активации транскрипции генов-мишеней, как показано на рис. 4.

Рис. 4. Взаимодействие VHL и HIFα, реализующееся только при нормальном уровне доступа кислорода, но не при гипоксии, влечет за собой два рода событий: во-первых, убиквитинирование и деградацию HIFα в цитоплазме, а во-вторых, привлечение репрессорных белков (на этой схеме — VHLaK, KAP) к области взаимодействия HIFα с ДНК. Рисунокизстатьи Z. Li et al., 2003. The VHL protein recruits a novel KRAB-A domain protein to repress HIF-1α transcriptional activity
Регуляция с участием HIF затрагивает в сумме более трех сотен генов, функция которых заключается в обеспечении снабжения тканей кислородом, стимулировании регенеративных процессов и включении защитных механизмов внутри клеток, подвергшихся воздействию гипоксии (J. Schödelet al., 2011. High-resolution genome-wide mapping of HIF-binding sites by ChIP-seq).
Например, одной из таких защитных реакций является повышение интенсивности реакций гликолиза (расщепления глюкозы до молочной кислоты в цитозоле клеток), как альтернативного пути наработки АТФ (в обычных условиях основная доля АТФ производится за счет кислородного дыхания, осуществляемого митохондриями). Также гипоксия стимулирует аутофагию, и одновременно подавляет некоторые особенно энергозатратные процессы. На уровне межтканевой регуляции происходит стимуляция не только эритропоэза, но и ангиогенеза (роста сосудов) — благодаря стимуляции синтеза и секреции фактора роста эндотелия сосудов VEGF, расширения капилляров, интенсивности вентиляции легких и целого ряда других физиологических процессов. Производство белков VEGFxxx может быть вызвано в клетках, которые не получают достаточного количества кислорода. Когда клетка испытывает дефицит в кислороде, она производит один из факторов транскрипции — фактор, индуцируемый гипоксией (HIF). Данный фактор (помимо других функций — в частности, модуляции эритропоэза, т. е. процесса образования эритроцитов в костном мозге) стимулирует высвобождение белков VEGFxxx. Циркулирующий белок VEGFxxx затем связывается с VEGF-рецептором на клетках эндотелия и активирует действие тирозинкиназы, запуская ангиогенез.В нервной ткани обнаружилась выраженная реакция на колебания снабжения мозга кислородом в клетках астроцитах. Оказалось, что выделяемый ими эритропоэтин не только участвует в активации эритропоэза, но и стимулирует миграцию нейробластов в область ишемического повреждения мозга, то есть регенерацию нервной ткани (J. C. Chavezet al., 2006. The Transcriptional Activator Hypoxia Inducible Factor 2 (HIF-2/EPAS-1) Regulates the Oxygen-Dependent Expression of Erythropoietin in Cortical Astrocytes).
При чрезмерно затянувшемся состоянии гипоксии к регуляции подключается p53 — еще один известный супрессор опухолей. В комплексе с белком Mdm2, он связывает HIFα, что приводит опять же к убиквитинированию и протеасомной деградации этого белка. К тому же белок p53 конкурирует c HIF за связывание коактиваторных белков CBP/p300.
p53 (белок p53) — это транскрипционный фактор, регулирующий клеточный цикл. p53 выполняет функцию супрессора образования злокачественных опухолей, соответственно ген TP53 является антионкогеном. Мутации гена TP53 обнаруживаются в клетках около 50 % раковых опухолей. Зачастую его называют «стражем генома».Белок р53 является продуктом гена-супрессора опухоли TP53 и экспрессируется во всех клетках организма. При отсутствии повреждений генетического аппарата белок р53 находится в неактивном состоянии, а при появлении повреждений ДНК активируется. Активация состоит в приобретении способности связываться с ДНК и активировать транскрипцию генов, которые содержат в регуляторной области нуклеотидную последовательность, которая называется p53-response element (участок ДНК, с которым связывается белок р53). Таким образом, р53 — фактор, который запускает транскрипцию группы генов и который активируется при накоплении повреждений ДНК. Результатом активации р53 является остановка клеточного цикла и репликации ДНК; при сильном стрессовом сигнале — запуск апоптоза.Белок р53 активируется при повреждениях генетического аппарата, а также при стимулах, которые могут привести к подобным повреждениям, или являются сигналом о неблагоприятном состоянии клетки (стрессовом состоянии). Функция белка р53 состоит в удалении из пула реплицирующихся клеток тех клеток, которые являются потенциально онкогенными (отсюда образное название белка р53 — англ. guardianofthegenome — хранитель генома). Данное представление подтверждается тем фактом, что потеря функции белка р53 может быть установлена в ~50 % случаев злокачественных опухолей человека. В регуляции активности белка р53 ведущая роль принадлежит посттрансляционным модификациям белка и его взаимодействиям с другими белками.В быстро делящихся(пролиферирующих) клетках было обнаружено увеличение концентрации белка р53 по сравнению с делящимися медленно. Значение увеличения концентрации р53 в данном случае в том, что клетки, которые быстро реплицируют ДНК, более подвержены возникновению повреждений генетического аппарата, чем, например, неделящиеся клетки в фазе G0. Следовательно, увеличение концентрации р53 — это подготовка клетки для быстрой реакции на возможное возникновение повреждений ДНК. Очевидно, что для остановки клеточного цикла в условиях стимуляции пролиферации внеклеточными ростовыми факторами требуется более высокая концентрация р53, чем в условиях фазы G0. Вследствие строгого посттрансляционного контроля активации белка р53, высокая концентрация белка р53 сама по себе не ведёт к его активации.Концентрация белка р53 увеличивается в результате снятия ингибирования трансляции его мРНК. Подавление трансляции происходит в результате связывания регуляторных белков с последовательностями нуклеотидов в 3'-нетранслируемой области мРНК. Модификация белка р53 приводит к его активации. Латентный (неактивный) белок р53 локализуется в цитоплазме (по крайней мере на некоторых стадиях клеточного цикла); активный белок р53 локализуется в ядре клетки. При отсутствии стрессового стимула белок р53 имеет короткий период полураспада (5—20 мин в зависимости от типа клеток). Активация белка сопряжена с увеличением его стабильности. В регуляции стабильности (и активности) белка р53 главная роль принадлежит белку Mdm2.









