Как всё начиналось?
Как и многие истории, всё началось с пивных баров и, увы, весьма печально. В середине 1960-х годах по США, Бельгии и ряду других стран среди отчаянных любителей пива прокатилась необычная хворь — кардиомиопатия, имеющая по всем характеристикам признаки токсической, обусловленной накоплением неизвестного тяжелого металла. Довольно быстро виновник был найден: им оказался хлорид кобальта (II) — популярный среди ряда крупных пивоварен эффективный пеногаситель. Интересно, что помимо кардиомиопатии у бедняг-пьяниц наблюдался высокий уровень гемоглобина, который коррелировал с высоким уровнем эритропоэтина.
Замечу, чтобы получить кобальтовую кардиомиопатию, потреблять пива необходимо было неимоверно много — около 4 литров в сутки, а всем остальным, возможно, пиво дарило даже некоторое «окрыление» на фоне повышенного гемоглобина. Так или иначе, добавку запретили, разрешив ее ограниченно применять в скотоводстве.
В этом году Нобелевской премии в области физиологии и медицины удостоены американцы Уильям Кэлин и ГреггСеменза, а также британец Питер Рэтклифф. В 2016 году работы этих исследователей уже получили оценку в виде другой престижной награды — премии Альберта Ласкера, ежегодно присуждаемой в США за фундаментальные медицинские исследования. Согласно официальной формулировке Нобелевского комитета, лауреаты отмечены «за открытие механизмов, посредством которых клетки воспринимают доступность кислорода и адаптируются к ней».
Следует отметить, что в действительности речь идет не о любых клетках, а в первую очередь о клетках человека и животных. Пожалуй, отправным пунктом исследований в области адаптации к гипоксии можно считать период конца 60-х годов XX века, когда физиологи приступили к внимательному изучению реакций организма человека на подъем в горы или анемические состояния. Эти исследования привели к открытию эритропоэтина — гормона, который выделяется в кровь (преимущественно тканями почек, а также печени), причем продукция его резко возрастает в ответ на дефицит кислорода.
Распространяясь по организму, и достигая костного мозга, эритропоэтин стимулирует формирование эритроцитов, что обеспечивает значительное улучшение снабжения тканей кислородом уже в течение нескольких часов после начала гипоксии. Однако еще долгое время никто не знал, во-первых, как именно клетки «оценивают» количество кислорода, во-вторых, все ли клетки на это способны, и, в-третьих, какие механизмы лежат в основе реализации клеточного ответа. Именно за решение этих вопросов и была присуждена Нобелевская премия по физиологии и медицине в этом году.
Исследования, которые получили высшую оценку Нобелевского комитета, были начаты на рубеже 80-х и 90-х годов XX века. Причем каждый из трех лауреатов пришел в эту область своим особым путем.
Питер Рэтклифф первоначально получил медицинское образование, затем перепрофилировался на молекулярную биологию. В конце 80-х его исследовательская работа была связана с изучением болезней почек, среди которых некоторую долю составляют патологии ишемической этиологии. Как уже было сказано, именно почки вырабатывают эритропоэтин в ответ на состояние гипоксии. В 1990 году Рэтклифф основал в Оксфорде лабораторию биологии гипоксии, которую возглавлял более 20 лет, поставив перед собой цель разобраться в механизмах регуляции экспрессии гена эритропоэтина.
Тематика работ ГреггаСемензы до начала 90-х годов касалась заболеваний, обусловленных нарушениями эритропоэза, таких как талассемия.
Талассеми́я (анемия Кули) — заболевание, наследуемое по рецессивному типу (двухаллельная система), в основе которого лежит снижение синтеза полипептидных цепей, входящих в структуру нормального гемоглобина. В норме основным вариантом (97 %) гемоглобина взрослого человека является гемоглобин А. Это тетрамер, состоящий из двух мономеров α-цепей и двух мономеров β-цепей. 3 % гемоглобина взрослых представлено гемоглобином А2, состоящим из двух альфа- и двух дельта-цепей. Существуют два гена HBA1 и HBA2, кодирующих мономер альфа, и один HBB-ген, кодирующий мономер бета. Наличие мутации в генах гемоглобина может привести к нарушению синтеза цепей определённого вида.В зависимости от того, синтез какого из мономеров нарушен, разделяют альфа-, бета- и дельта-талассемию
В 1992 году он выделил новый белок, связывающийся с регуляторным участком в гене эритропоэтина и обеспечивающий стимуляцию транскрипции данного гена при недостатке кислорода. Также, как и Рэтклифф, Семенза с этого момента практически полностью переключился на исследование молекулярных и клеточных механизмов адаптации организма к гипоксии.
Уильям Келин — специалист по опухолям, занимавшийся в конце 80-х — начале 90-х годов проблемой наследственного заболевания Гиппеля — Линдау.
Цереброретинальный ангиоматоз, англ. VonHippel–Lindaudisease — VHL) — факоматоз, прикотором гемангиобластомы мозжечка сочетаются с ангиомами спинного мозга, множественными врождёнными кистами поджелудочной железы и почек.Этот синдром с аутосомно-доминантным наследованием выражается в повышенном риске возникновения рака (чаще всего образуются опухоли головного или спинного мозга, сетчатки, почек).
В 1988 году было установлено, что причиной заболевания являются мутации в гене VHL (аббревиатура, образованная от англоязычного названия заболевания, von Hippel — Lindaudisease). И, как выяснилось впоследствии, белок, кодируемый этим геном, является еще одним из ключевых игроков в ответе клеток на вариации в концентрации кислорода в среде.
Любопытно отметить, что в первое время статьи из всех трех лабораторий выходили одна за другой, и нередко практически одновременно исследователи параллельно публиковали полученные результаты, описывающие одни и те же детали механизма. Впрочем, десятилетие спустя у них начали появляться и совместные публикации.
Что есть гипоксия?
Нормоксия — условие, при котором концентрация (напряжение) кислорода в окружающей организм/клетку среде «нормальное атмосферное», т.е. близко к 21%.
Гипоксия, соответственно, это все, что ниже.
Гипер оксия — все, что выше указанной цифры.
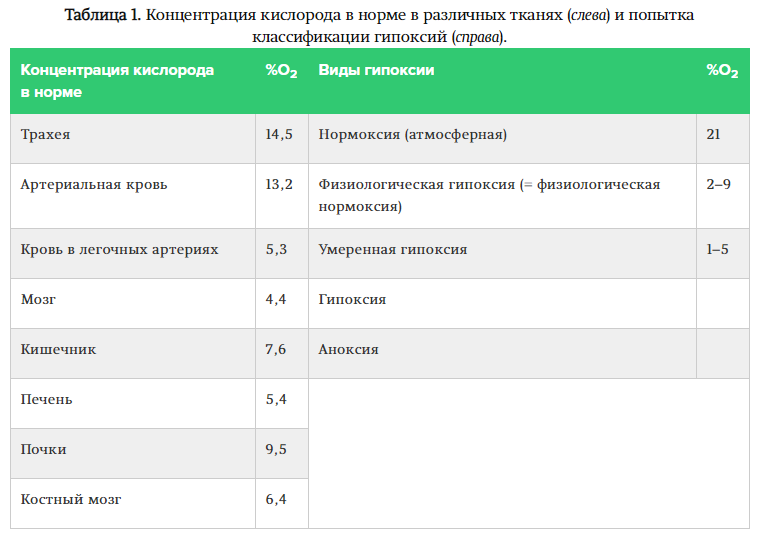
На самом деле, понятия эти весьма условны. Классической нормоксии in vivo нет даже для дыхательного эпителия (~14,5%), а большинство тканей в норме прибывает в условиях так называемой физиологической гипоксии (2–9% в зависимости от ткани, обычно около 5%), которая для них и не гипоксия вовсе. Помимо этого, выделяют также умеренную гипоксию, собственно гипоксию и аноксию. Единой чёткой классификации гипоксий нет, но есть попытки (как в таблице 1).
HIF. (На слайде)
VHL. (На слайде)
Рисунок 4. Факторы транскрипции HIF 1-3 и классический кислород-зависимый путь регуляции их активности.
Неканонические пути регуляции активности факторов HIFs или та самая негипоксическая гипоксия. Помните пример с кобальтовой кардиомиопатией? Это был хороший пример так называемого неканонического пути активации HIF, когда он, по сути, активировался в условиях нормоксии. В данном случае Co2+ выступает в качестве хелатора Fe2+ (содержащегося в активном центре пролилгидроксилаз PHD), ингибирует их функцию и нарушает кислород-зависимое разрушение α-субъединицы. Это приводит к активации HIFs в условиях нормоксии. Так у любителей пива происходила постоянная активация HIFs и HIF-зависимого гена эритропоэтина — даже несмотря на то, что в их кровь была пересыщена гемоглобином, и никакой реальной гипоксии, разумеется, не наблюдалось. Воздействовать на Fe2+ в составе пролилгидроксилаз PHD способны активные формы кислорода (АФК), которые образуются в клетке в огромном количестве разнообразных процессов.
Позднее выяснилось, что активность HIF может регулироваться множеством других механизмов на уровне транскрипции, трансляции и посттрансляционных модификаций (фосфорилирование, ацетилирование/деацетилирование, убиквитинирование/деубиквитинирование, SUMO-илирование, S-нитрозилирование, NEDD-илирование). Механизмы эти могут быть как зависящими от кислорода, так и нет; как селективными, так и нет по отношению к HIF-1α и HIF-2α изоформам. Но к этому мы вернемся несколько позже.
Как всё начиналось?
Как и многие истории, всё началось с пивных баров и, увы, весьма печально. В середине 1960-х годах по США, Бельгии и ряду других стран среди отчаянных любителей пива прокатилась необычная хворь — кардиомиопатия, имеющая по всем характеристикам признаки токсической, обусловленной накоплением неизвестного тяжелого металла. Довольно быстро виновник был найден: им оказался хлорид кобальта (II) — популярный среди ряда крупных пивоварен эффективный пеногаситель. Интересно, что помимо кардиомиопатии у бедняг-пьяниц наблюдался высокий уровень гемоглобина, который коррелировал с высоким уровнем эритропоэтина.
Замечу, чтобы получить кобальтовую кардиомиопатию, потреблять пива необходимо было неимоверно много — около 4 литров в сутки, а всем остальным, возможно, пиво дарило даже некоторое «окрыление» на фоне повышенного гемоглобина. Так или иначе, добавку запретили, разрешив ее ограниченно применять в скотоводстве.
В этом году Нобелевской премии в области физиологии и медицины удостоены американцы Уильям Кэлин и ГреггСеменза, а также британец Питер Рэтклифф. В 2016 году работы этих исследователей уже получили оценку в виде другой престижной награды — премии Альберта Ласкера, ежегодно присуждаемой в США за фундаментальные медицинские исследования. Согласно официальной формулировке Нобелевского комитета, лауреаты отмечены «за открытие механизмов, посредством которых клетки воспринимают доступность кислорода и адаптируются к ней».
Следует отметить, что в действительности речь идет не о любых клетках, а в первую очередь о клетках человека и животных. Пожалуй, отправным пунктом исследований в области адаптации к гипоксии можно считать период конца 60-х годов XX века, когда физиологи приступили к внимательному изучению реакций организма человека на подъем в горы или анемические состояния. Эти исследования привели к открытию эритропоэтина — гормона, который выделяется в кровь (преимущественно тканями почек, а также печени), причем продукция его резко возрастает в ответ на дефицит кислорода.
Распространяясь по организму, и достигая костного мозга, эритропоэтин стимулирует формирование эритроцитов, что обеспечивает значительное улучшение снабжения тканей кислородом уже в течение нескольких часов после начала гипоксии. Однако еще долгое время никто не знал, во-первых, как именно клетки «оценивают» количество кислорода, во-вторых, все ли клетки на это способны, и, в-третьих, какие механизмы лежат в основе реализации клеточного ответа. Именно за решение этих вопросов и была присуждена Нобелевская премия по физиологии и медицине в этом году.
Исследования, которые получили высшую оценку Нобелевского комитета, были начаты на рубеже 80-х и 90-х годов XX века. Причем каждый из трех лауреатов пришел в эту область своим особым путем.
Питер Рэтклифф первоначально получил медицинское образование, затем перепрофилировался на молекулярную биологию. В конце 80-х его исследовательская работа была связана с изучением болезней почек, среди которых некоторую долю составляют патологии ишемической этиологии. Как уже было сказано, именно почки вырабатывают эритропоэтин в ответ на состояние гипоксии. В 1990 году Рэтклифф основал в Оксфорде лабораторию биологии гипоксии, которую возглавлял более 20 лет, поставив перед собой цель разобраться в механизмах регуляции экспрессии гена эритропоэтина.
Тематика работ ГреггаСемензы до начала 90-х годов касалась заболеваний, обусловленных нарушениями эритропоэза, таких как талассемия.
Талассеми́я (анемия Кули) — заболевание, наследуемое по рецессивному типу (двухаллельная система), в основе которого лежит снижение синтеза полипептидных цепей, входящих в структуру нормального гемоглобина. В норме основным вариантом (97 %) гемоглобина взрослого человека является гемоглобин А. Это тетрамер, состоящий из двух мономеров α-цепей и двух мономеров β-цепей. 3 % гемоглобина взрослых представлено гемоглобином А2, состоящим из двух альфа- и двух дельта-цепей. Существуют два гена HBA1 и HBA2, кодирующих мономер альфа, и один HBB-ген, кодирующий мономер бета. Наличие мутации в генах гемоглобина может привести к нарушению синтеза цепей определённого вида.В зависимости от того, синтез какого из мономеров нарушен, разделяют альфа-, бета- и дельта-талассемию
В 1992 году он выделил новый белок, связывающийся с регуляторным участком в гене эритропоэтина и обеспечивающий стимуляцию транскрипции данного гена при недостатке кислорода. Также, как и Рэтклифф, Семенза с этого момента практически полностью переключился на исследование молекулярных и клеточных механизмов адаптации организма к гипоксии.
Уильям Келин — специалист по опухолям, занимавшийся в конце 80-х — начале 90-х годов проблемой наследственного заболевания Гиппеля — Линдау.
Цереброретинальный ангиоматоз, англ. VonHippel–Lindaudisease — VHL) — факоматоз, прикотором гемангиобластомы мозжечка сочетаются с ангиомами спинного мозга, множественными врождёнными кистами поджелудочной железы и почек.Этот синдром с аутосомно-доминантным наследованием выражается в повышенном риске возникновения рака (чаще всего образуются опухоли головного или спинного мозга, сетчатки, почек).
В 1988 году было установлено, что причиной заболевания являются мутации в гене VHL (аббревиатура, образованная от англоязычного названия заболевания, von Hippel — Lindaudisease). И, как выяснилось впоследствии, белок, кодируемый этим геном, является еще одним из ключевых игроков в ответе клеток на вариации в концентрации кислорода в среде.
Любопытно отметить, что в первое время статьи из всех трех лабораторий выходили одна за другой, и нередко практически одновременно исследователи параллельно публиковали полученные результаты, описывающие одни и те же детали механизма. Впрочем, десятилетие спустя у них начали появляться и совместные публикации.
Механизм клеточного ответа на гипоксию
Что есть гипоксия?
Нормоксия — условие, при котором концентрация (напряжение) кислорода в окружающей организм/клетку среде «нормальное атмосферное», т.е. близко к 21%.
Гипоксия, соответственно, это все, что ниже.
Гипер оксия — все, что выше указанной цифры.
На самом деле, понятия эти весьма условны. Классической нормоксии in vivo нет даже для дыхательного эпителия (~14,5%), а большинство тканей в норме прибывает в условиях так называемой физиологической гипоксии (2–9% в зависимости от ткани, обычно около 5%), которая для них и не гипоксия вовсе. Помимо этого, выделяют также умеренную гипоксию, собственно гипоксию и аноксию. Единой чёткой классификации гипоксий нет, но есть попытки (как в таблице 1).

HIF. (На слайде)
VHL. (На слайде)







