

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...
Топ:
Когда производится ограждение поезда, остановившегося на перегоне: Во всех случаях немедленно должно быть ограждено место препятствия для движения поездов на смежном пути двухпутного...
Эволюция кровеносной системы позвоночных животных: Биологическая эволюция – необратимый процесс исторического развития живой природы...
Комплексной системы оценки состояния охраны труда на производственном объекте (КСОТ-П): Цели и задачи Комплексной системы оценки состояния охраны труда и определению факторов рисков по охране труда...
Интересное:
Подходы к решению темы фильма: Существует три основных типа исторического фильма, имеющих между собой много общего...
Распространение рака на другие отдаленные от желудка органы: Характерных симптомов рака желудка не существует. Выраженные симптомы появляются, когда опухоль...
Что нужно делать при лейкемии: Прежде всего, необходимо выяснить, не страдаете ли вы каким-либо душевным недугом...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Аденовирусная инфекция гусей и уток –малоизученная инфекция, характеризующаяся персистенцией вируса, истончением скорлупы, уменьшением массы яиц.
Историческая справка. Инфекция, вероятно, распространена повсеместно. Аденовирусы уток и гусей выделены во многих странах Америки, Азии и Европы. Например, в Венгрии от мускусных уток выявлен вирус, который активно размножался в клетках фибробластов эмбрионов данного вида птиц. В последние 20 лет изолировали аденовирусы от гусят 1-7-суточного возраста (D119/6, D132/2, D137/1-3, D137/6 и 7, D156, D171/2, Р27, Р29 и др.), которые удачно репродуцировали в культуре клеток гепатоцитов эмбрионов гусей (1, 3, 10, 13, 16). В недалёком прошлом (до 90-х годов ХХ века) считали, что водоплавающие болеют только синдромом снижения яйценоскости (ССЯ) кур. Тесты по выявлению специфических антител постоянно показывали контакт птицы с возбудителем ССЯ и наличие его в организме водоплавающих. У уток пекинской породы, разводимых в России и Венгрии (1999-2002 гг.) сотрудниками ВНИИЗЖ, были выявлены в высоких титрах задерживающие гемагглютинацию антитела против аденовируса ССЯ штамма В8/87 (Рисунок 3).
Экономический ущерб. Не изучен.
Возбудитель. Аденовирус. Аденовирусы, выделенные у птиц, в настоящее время отнесены к трём различным родам (Aviadeno-, Atadeno-, Siadenovirus) семейства Adenoviridae. од Aviadenovirus включает аденовирусы уток, которые, вероятно, эволюционировали совместно с птицами. Два других рода представлены по одному вирусу, выделенному у кур (ССЯ) и индеек (THE). Они филогенетически отличаются от авиаденовирусов и предположительно появились у птиц как следствие недавней смены хозяина.
В настоящее время род Aviadenovirus включает 12 серотипов кур (FAdV – 1 - 8a, 8b - 11), 2 серотипа индеек (TАdV – 1-2), 3 серотипа гусей (GoAdV – 1-3). Кроме этого дополнительно определёны по одному серотипу мускусных уток (DAdV – 1) и одному – голубей (PiAdV – 1). Они обладают общим антигеном, специфическим для рода. FAdV разделены на 5 видов, что подтверждается филогенетическими подсчётами, в основе которых лежат частичные последовательности гена гексона.
|
|
ПЦР DAdV-2 и шести изолятов GoAdV (P29, D119/6, D137/1, D137/2, D137/6, D156) была успешной с одной, как минимум, парой праймеров. Последовательность фрагмента гена гексона в 800 пар оснований изолята D119/6 и D137/2 была идентичной, однако другие изоляты демонстрировали большую изменчивость. Филогенетическое древо содержит по одному представителю всех серотипов кур (FAdV) и изолят, выделенный у индеек (TAdV D90/2), как членов рода Aviadenovirus. Для лучшей ориентации были включены члены двух других родов - ССЯ из рода Atadenovirus и вирус геморрагического энтерита индеек (THE) из рода Siadenovirus. Изоляты, выделенные у водоплавающей птицы, составляют ветвь, явно отдельную от аденовирусов, выделенных у кур.
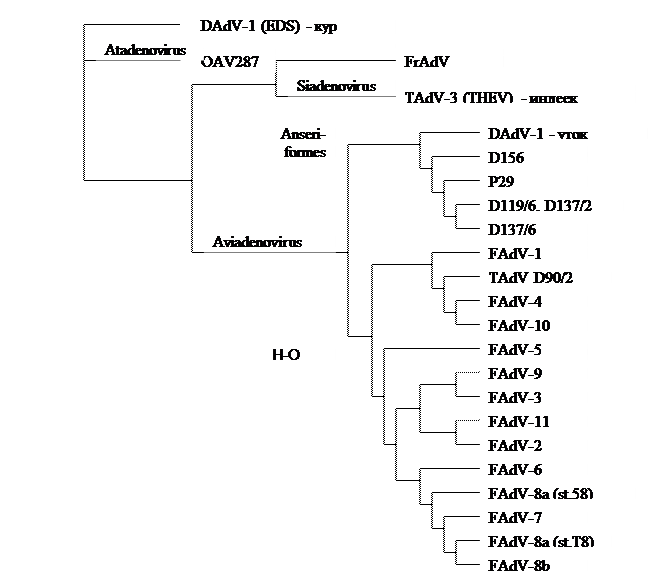
Рисунок 2 Филогенетическое расположение авиаденовирусов уток и гусей (отряд Anseriformes – гусинообразных)
Обозначения:
OAV287 – изолят аденовируса, выделенный у овец;
FrAdV-1 – изолят аденовируса типа 1, выделенный у лягушки;
Anseriformes – гусинообразные;
Galliformes – куринообразные.
В морфологическом отношении аденовирус уток близок к другим аденовирусам семейства и представляет собой изометрические частицы диаметром 70-90 нм с икосаэдрической симметрией, состоящие из 252 капсомеров. 12 капсомеров, находящиеся на вершине икосаэдров, несущий два отростка (фибера) длиной 10-37 нм и толщиной 2 нм. Размер сердцевины вириона составляет 58-60 нм. Она содержит инфекционную ДНК и два белка. ДНК линейная, двухспиральная, в составе капсида 12 структурных белков. У вируса плотность вирионов в CsCl 1,32-1,35 г/см3, коэффициент седиментации 560 S, молекулярная масса (170-176)х10 млн. D. Он лишен липопротеидной оболочки и устойчив к липидным растворителям (хлороформу, эфиру и др.). Максимальная устойчивость вируса в изотоническом растворе колеблется в пределах pH 6-9. Термостабилен: сохраняет инфекционную активность при 56оС в течение 60 минут, однако разрушается за 30 минут при 80оС в присутствии одновалентных катионов. После воздействия радиации инфекционная активность возбудителя утрачивается более быстро, чем гемагглютинирующая [18].
|
|
Фомина Н.В. (1995) уточняет, что все аденовирусы птиц обладают эпителиотропностью; сначала вызывают изменения в культурах эпителиальных клеток, а затем в фибробластах КЭ. Вирус в первично трипсинизированной культуре фибробластов КЭ индуцирует образование внутриядерных включений, выявляемых с помощью ЭМ или метода МФА. Клетки монослойных культур УЭ и индеек тоже чувствительны к аденовирусам. Фомина Н.В. (1995) сообщает, что Sharpless G.R. (1962) установил способность вируса поддерживаться в этих культурах длительное время. Аденовирус при дегенерации клеток культур на шестые сутки после заражения не освобождается от них полностью, а в культуральной жидкости его относительное содержание составляет около 6% [8].
В период с 1999 по 2002 годы во ВНИИЗЖ (Россия) Князевым В.П. были проведены тесты по выявлению специфических задерживающих гемагглютинацию антител против аденовируса штамма В 8/78 ССЯ-76 в сыворотках крови уток различных пород 4 птицефабрик России и Венгрии. Результаты РЗГА, где были применены 4 ГАЕ вируса и двукратные разведения сывороток, представлены на рисунке 3. Тесты проводились с целью выявления маркеров биологических агентов в УЭ, используемых для приготовления ВСМ при разработке вирусвакцины против ВГУ. Подобным тестам были подвергнуты желтки эмбрионов и сыворотки крови цесарок (Россия).
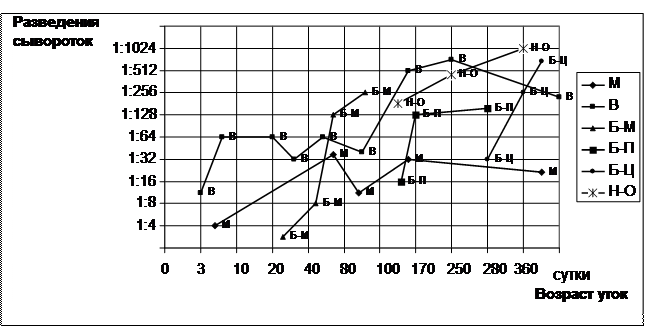
Рисунок 3 Динамика накопления задерживающих гемагглютинацию антител к аденовирусу штамма В 8/78 в сыворотках крови уток птицефабрик «Малая Дубна», «Новооскольская», ДППЗ «Благоварский» (Россия) и “Animal Farm Ltd.,” Dushok, (Венгрия) (1999-2002 гг.)
Обозначения:
Линии: - м - - п/ф «Малая Дубна», пекинская порода;
- в - -«Animal Farm Ltd.», Dushok, пекинская порода;
- б-м - - ДППЗ «Благоварская», мускусная порода;
- б-п - - ДППЗ «Благоварская», пекинская порода;
- б-ц - -ДППЗ «Благоварская», цветная башкирская порода;
- н-о - - п/ф «Новооскольская», пекинская порода.
|
|
Результаты РЗГА, отражённые на рисунке 3, показали, что утки пекинской, мускусной и цветной башкирской пород обладают антителами к куриному аденовирусу штамма В8/78 – от 20 до 50% общего поголовья конкретной возрастной группы. Исследования, проведённые в течение четырёх лет, удостоверили в повозрастной тенденции роста концентрации антител; до 3-месячного возраста титр находился в пределах от 1:4 до 1:32, тогда как в 150-360-суточном возрасте – от 1:512 до 1:1024, независимо от породы и местонахождения птицефабрики. Вероятно, это связано со снижением количества вируса в организме птицы в 20-40-суточном возрасте.
Примечание: обнаружение САТ в крови невакцинированных кур в титре 1:16 и выше, свидетельствует о циркуляции полевого возбудителя ССЯ – 76 и неблагополучии куриного (не утиного) хозяйства.
Эпизоотологические данные. За последнее время результаты серологических тестов и ПЦР-исследований показали вероятность постоянного возникновения аденовирусной инфекции не только у уток и гусей, но и перепелов, филинов и лебедей. В крови уток, лебедей и гусей обнаружены специфические антитела к соответствующим аденовирусам и изменения скорлупы яиц. К инфекции восприимчивы молодые индейки, из которых особи-реконвалесценты обладают антителами, ингибирующими гемагглютинацию вируса.
Резервуаром возбудителя является домашняя и дикая птица. Вирус способен длительное время персистировать в организме молодых особей, восстанавливать исходную инфекционную активность в период половой зрелости у несушек и контаминировать окружающую среду. Выделяется возбудитель болезни с фекалиями, секретами носовой и ротовой полостей; вероятно, присутствуют алиментарный и аэрогенный пути заражения.
В настоящее время вирусы птиц отнесены к 3 родам, один из них – возбудитель ССЯ-76, отнесён в отдельный – Atadenovirus.
На основании его морфологии, стратегии репликации генома и химического состава вириона он классифицирован как аденовирус. Попытки выявить у вируса ССЯ-76 группоспецифический для всех аденовирусов птиц антиген с использованием реакции иммунодиффузии, реакции иммунофлуоресценции и реакции нейтрализации не были успешными. Все известные штаммы вируса ССЯ-76 относятся к одному серотипу. Однако с использованием рестрикционного анализа генома установлены три генотипа вируса ССЯ-76. Разделение на генотипы согласуется с географическим распределением исследованных штаммов. Так первый генотип охватывает штаммы, выделенные от кур различных пород в Европе. Другой включает штаммы, выделенные от уток в Англии, и третий – штаммы, выделенные от кур с признаками ССЯ-76 в Австралии. Информация о патогенезе, вызываемом вирусом ССЯ-76 у водоплавающих птиц, является скудной, однако, имеющиеся сведения позволяют сделать вывод о том, что водоплавающие птицы тоже являются естественными хозяевами данного вируса. Исследования водоплавающих птиц, отловленных на Атлантических путях перелета в США, позволили выявить антитела к вирусу ССЯ-76 у различных видов уток (Ojamaicensis, Aythya collaris, Bucephala albeola, Aix sponsa, Aythya affinis, Anas platyrhynchos, Anas clypeata, Anas strepera, Mergus merganser). Антитела к вирусу выявляли у лысух (Fulica spp.), поганок, канадских гусей (Branta canadansis), чаек и других видов птиц (2, 4, 7, 9, 10, 14, 15, 18, 23).
|
|
Bouquet J.F. et al. (1982) изолировали аденовирус от мускусных уток и установили его 1 серотип [10]. Kruse W. et al. (1988) в Германии методами РЗГА и РН выявляли САТ в сыворотке крови гусей к вирусу ССЯ-76 и аденовирусу серотипов 1, 2 и 3.
Течение и симптомы болезни. Инкубационный период не определен. Течение инфекции длительное - до 6 и более недель. Наиболее характерными признаками являются наличие тонкой скорлупы, изменение физического состояния (помутнение и водянистость белка) содержимого яиц, снижение их выводимости и жизнеспособности молодняка. Отмечают взъерошенность оперения, состояние прострации, ограниченный прием корма, диарею и задержку роста.
Аденовирусная инфекция водоплавающих – болезнь латентная, не проявляющаяся в острой форме, что заметно отличает её от ССЯ кур.
При экспериментальном воспроизведении ССЯ инкубационный период составляет около 48 часов. После введения аденовируса в вену или брюшную полость у подопытных цыплят развивается диарея и гибель с летальностью до 60% в последующие 7-14 суток, тогда как у утят и уток этого не отмечают. У взрослых кур-несушек в течение 18-25 суток наблюдают кладку маловесных с мягкой скорлупой (в 49-87% случаев) или бесскорлупных (до 39%) яиц. К 5-6-недельному сроку наблюдений происходит восстановление яйцекладки.
Патогенез. Не изучен.
Патологоанатомические изменения. В естественных условиях у домашних и диких уток и гусей изменения не описаны, тогда как у других видов птиц они многообразны. Более постоянными считают атрофию яичников и сумки Фабрициуса, катаральный энтерит и гастрит, кровоизлияния в паренхиме печени и мышц, а также эрозии в зобе птицы 28-35-недельного возраста. На поверхности кожи редко обнаруживают гангренозный дерматит.
|
|
При экспериментальной инфекции утята и утки болеют без заметных аномалий во внутренних органах и летального исхода.
Парентеральное введение цыплятам “утиного” вируса – возбудителя ССЯ, в зависимости от его патогенности, может вызывать клиническое проявление болезни и их гибель. Чаще отмечают эрозии на слизистой оболочке зоба, обширные кровоизлияния в тканях печени, почек, миокарде, железистого желудка и двенадцатиперстной кишки.
В Японии (1988) проведены гистологические исследования по обнаружению изменений у голубей, погибших от аденовирусной инфекции. Выявлены базофильные и/или эозинофильные тельца-включения в клетках гепатоцитов, в эпителии мочевых канальцев и тонкого кишечника. Аденовирус, выделенный из печени, не вызывал ЦПД в культуре клеток фибробластов и изменения в хориоаллантоисной оболочке КЭ (1, 3, 5, 9).
Диагноз и дифференциальная диагностика. Постановка диагноза на аденовирусную инфекцию основывается на результатах изучения эпизоотологических данных и проведения лабораторных исследований.
Для вирусовыделения используют пробы крови (желательно лейкоцитов), носоглоточных смывов, соскобов с коньюнктивы и фекалий больных особей. От павших птиц отбирают измененные участки носовых перегородок, легких, трахеи, лимфоузлов, печени, кишечника и яйцевода. Из проб органов готовят 10-20% суспензии, обрабатывают их антибиотиками (пенициллином 10000-20000 ЕД/мл и стрептомицином 200-250 мкг/мл), осветляют при 600-800 g в течение 15-20 минут и используют для подкожного введения односуточным утятам, гусятам и цыплятам. Срок наблюдения до 5 недель. Следует иметь в виду, что наиболее высокую концентрацию аденовируса - возбудителя ССЯ, отмечают в содержимом кишечника и клоаки (в течение 12 суток), селезенке и почках (10 суток), фекалиях, легких, трахее и печени – 6-7 дней после заражения.
Оптимальный вариант вирусовыделения - заражение 8-10-суточных УЭ в аллантоисную полость, а также первичных культур фибробластов или гепатоцитов УЭ. Через 7-10 дней после заражения в аллантоисной жидкости инфекционный титр вируса может достигать 3-5 lg ЭЛД50/см3, а гемагглютинирующий — 10-16 лог2, тогда как в культуральных материалах - 4-5 lg ТЦД50 и 9-10 лог2, соответственно.
КЭ после инфицирования в желточный мешок заметно отстают в росте. Выводимость цыплят резко снижается. Результаты исследований показали, что КЭ менее чувствительны к заболеванию в сравнении с утиными. Поэтому для пассирования целесообразно использовать УЭ.
Для обнаружения вирусов кур и уток, а также их антигенов и генома применяют МФА, РН, РГА, ПЦР и РДП. Методом прямой МФА вирусный антиген может быть выявлен в культуре клеток фибробластов УЭ через 12-24 часа после заражения (2, 6, 14, 21, 23).
РН ставят с УЭ, культур клеток гепатоцитов, почки или фибробластов эмбрионов уток.
Для идентификации выделенного агента РЗГА ставят с 4 ГАЕ вируса, 1%-й взвесью эритроцитов кур на ЗФР pH 7,2-7,4, нормальной и специфической сыворотками.
Ретроспективную диагностику ССЯ кур проводят методами РН, РДП, РСК, РЗГА и ИФА. Отбирают пробы сывороток крови птиц в начале проявления симптомов болезни и через 2-3 недели у реконвалесцентов. Методами РЗГА и ИФА можно определить нарастание титра антител от нуля до 1:1024 и выше. Отмечено, что у домашних и диких уток довольно часто можно выявить только специфические антитела, тогда как у других видов: лебедей, голубей, фазанов, перепелов и гусей, при отсутствии антител наблюдают дополнительный признак - дефектность скорлупы яиц. Необходимо учитывать, что цыплята 2-3-недельного возраста, полученные из яиц кур-реконвалесцентов, содержат в крови антитела, выявляемые в РЗГА и ИФА.
В связи с тем, что комплементфиксирующий антиген определен общим для всех куриных штаммов аденовируса, РСК часто используют для диагностики болезни, выявления новых изолятов вируса и их типирования с помощью сывороток, полученных на морских свинках. Установлено совпадение результатов, полученных при использовании РСК и РДП (8).
Идентификация аденовируса, выделенного от уток и гусей, традиционно проводится методами количественной РН, ИФА, РЗГА и ПЦР.
Во ВНИИЗЖ (1997) разработаны методические указания по определению антител к вирусу ССЯ-76 в сыворотках птиц непрямым методом ИФА. Тест основан на взаимодействии антигена аденовируса с антителами исследуемой сыворотки крови с последующим выявлением специфического комплекса с помощью коньюгата антивидовых иммуноглобулинов, меченных пероксидазой хрена, наличие которого выявляется хромогенным субстратом. Метод используется для изучения иммунного фона поголовья. Птица считается иммунной, если у 80% кур титр антител составляет 1:800 и выше (авторы Дрыгин В.В., Волкова М.А., Мудрак Н.С. и др., ВНИИЗЖ) (8).
Во ВНИИЗЖ выпускают набор для диагностики ССЯ-76 в РЗГА на 250 проб и набор для диагностики ССЯ-76 иммуноферментным методом на 176 проб.
Волкова М.А. и др. (1977) провели сравнительную оценку непрямого метода ИФА и РЗГА для диагностики ССЯ кур, используя в качестве антигена вирус штамма В 8/78, репродуцированного в УЭ.
На полученный антиген вирусспецифическую контрольную сыворотку получали путём иммунизации СПФ-кур. Сенсибилизацию планшетов проводили концентратом антигена (1-5 мкг/см3) в 0,05 М карбонатно-бикарбонатном буфере рН 9,5-9,6. Авторы установили, что положительным тиром исследуемых сывороток необходимо считать разведения 1:200 в ИФА и 1:4 в РЗГА. Коэффициент корреляции выше 96%.
Возбудитель ССЯ постоянно выявляли в смежных России странах. Например, исследованиями, проведёнными на Украине в конце ХХ века, было подтверждено широкое распространение вируса ССЯ среди кур, не вакцинированных против данной инфекции. Титры антигемагглютинирующих антител в РЗГА составляли 1:256-512, а в ИФА – 1:800-1600 [1, 3, 8].
Фомина Н.В. (1995) сообщает, что Безрукавая И.Ю. и др. предлагают для выделения аденовирусов использовать пробы фрагментов яйцевода, яичников и кишечника с содержимым не позднее 2 часов после диагностического убоя птицы или хранения вируссодержащего диагностического материала при низких температурах. Для выделения вируса использовали культуру клеток утиных фибробластов УЭ, полученную от серонегативных по ССЯ уток, а также первичную культуру клеток почек куриных СПФ-эмбрионов, и проводили не менее трёх пассажей при ЭМ контроле.
При дифференциальной диагностике необходимо учитывать другие, невирусные, причины изменения цвета и толщины скорлупы. Например, изменение коричневого цвета скорлупы на белый происходит в течение 2 суток после приема корма с примесью никарбозина. Изменение толщины скорлупы зависит от дефицита кальция (до 3%) и витамина Д3 в корме, а также количественного показателя пестицидов внутри яйца.
Иммунитет. Не изучен. Утки и гуси как в естественных, так и в экспериментальных условиях, содержат в крови специфические антитела, обладающие вируснейтрализующей, преципитирующей и антигемагглютинирующей активностью.
Утята до 2-недельного возраста, полученные от экспериментально вакцинированных уток, в 40-90% случаев содержат в сыворотке крови САТ к аденовирусу.
Лечение. Не проводится.
Профилактика и меры борьбы. При аденовирусной инфекции водоплавающих не определены. Для специфической профилактики ССЯ кур используют масляную эмульсионную формолвакцину из штаммов В 6/38, 127 или ВС-14 аденовируса, выращенных в эмбрионах уток (или культуре клеток). Вводят вакцину однократно внутримышечно или подкожно в объеме 0,5 мл (1000 ГАЕ), начиная с 18-недельного возраста. Через 14-21 сутки у птицы образуется иммунитет, показателем которого считают наличие антигемагглютинирующих антител. Максимальное накопление их выявляют через 30 дней после инъекции препарата. Затем уровень антител постепенно снижается и через 40-50 недель их не обнаруживают методом РЗГА.
В России препарат из штамма В 8/78 (производство ВНИИЗЖ) используют согласно "Временному наставлению по применению вакцины против ССЯ-76 жидкой сорбированной инактивированной" (Борисов В.В. и др., 1995).
Список литературы
1. Ануфриева, Т.А. Синдром снижения яйценоскости: (обзор литературы) / Т.А. Ануфриева, Т.И. Ольшевская. – Владимир, 1992. – 14 с.
2. Индикация генома вируса ССЯ-76 с использованием ПЦР / В.А. Лобанов, В.В. Борисов, В.В. Дрыгин [и др.] // Соврем. аспекты вет. патологии ж-ных: статьи конф., посвящ. 40-летию ВНИИЗЖ. – Владимир, 1998. – С. 215-224.
3. Коровин, Р.Н. Аденовирусные инфекции сельскохозяйственной птицы / Р.Н. Коровин, И.К. Рождественский. – Л., 1990. – 79 с.
4. Лобанов, В.А. Первичная структура генов фибера и гексона аденовирусов птиц и разработка новых методов диагностики аденовирусной инфекции: автореф. дис. … канд. биол. наук / В.А. Лобанов. – Владимир, 1999. – 26 с.
5. Патоморфология при болезни птиц ССЯ-76 / В.А. Бакухин, О.Ф. Хохлачёв, Г.А. Севастьянов [и др.] // Ветеринария. – 1988. - № 6. – С. 28-31.
6. Разработка тест-системы для иммуноферментного метода диагностики аденовирусной инфекции птиц / А.С. Дубовой, В.Д. Сергеев, И.К. Рождественский, Г.А. Севастьянов // Сб. науч. тр. Ч. 1. Соврем. средства и методы борьбы с заразными болезнями с.-х. птиц. – Л., 1988. – С. 34.
7. Сравнительная оценка ИФА и РЗГА в диагностике синдрома снижения яйценоскости / М.А. Волкова, О.А. Борисова, Т.И. Назарова [и др.] // Проблемы инфекц. патологии с.-х. ж-ных: тез. докл. конф., посвящ. 100-летию открытия вируса ящура. – Владимир, 1997. – С. 158.
8. Фомина, Н.В. Аденовирусная инфекция животных: в 2-х т. / Н.В. Фомина. - М.: Колос, 1995.
9. Brugh, M. Experimental infection of laying chickens with adenovirus 127 and with a related virus isolated from ducks / M. Brugh, C.W. Beard, Р. Villegas // Avian Dis. – 1984. – Vol. 28. – P. 168-178.
10. Characterization of adenoviruses isolated from geese // Avian Pathol. – 1984. – Vol. 13. – P. 253-264.
11. Das, B.B. Outbreaks of egg drop syndrome to EDS-76 virus in quail (Coturnix coturnix japonica) / B.B. Das, H.K. Pradhan // Vet. Rec. – 1992. – Vol. 131. – P. 264-265.
12. Evidence of exposure of waterfowl and other aquatic birds to the hemagglutinating duck adenovirus identical to EDS-76 virus / C.M. Gulka, T.H. Piela, V.J. Yates [et al.] // J. Wild Dis. – 1984. – Vol. 20. – P. 1-5.
13. Goryo, M. Inclusion body hepatitis due to adenovirus in pigeons / M.Goryo, Y. Ueda, T. Umemura [e. a.] // Avian Pathol. – 1988. – V. 17. – P. 391-401.
14. Gough, R.E. Isolation of a hemagglutinating adenovirus from commercial duck / R.E. Gough, M.S. Collins, С. Spackman // Vet. Rec. – 1982. – Vol. 110. – P. 275-276.
15. Guittet, M. Experimental soft-shelled eggs disease (EDS-76) in Guinea fowl (Numida meleagridis) / M. Guittet, J.P. Picault, С. Bennejean // Proc. VIIth Int. Congr. World Vet. Poultry Assoc. – Oslo, Norway, 1981. – P. 22.
16. Isolation and characterization of an adenovirus isolated from Muscoly ducks / J.F. Bouquet, Y. Moreau, J.B. McFerran, T.J. Connor // Avian Pathol. – 1982. – Vol. 11. – P. 301-307.
17. Kruse, W. Обнаружение антител к аденовирусам от водоплавающих птиц / W. Kruse, E.F. Kaleta. – Gissen, 1988. – 46 p.
18. Li Gang. Restriction endonuclease analysis of egg drop syndrome viruses / Li Gang, Zhou Jinping, Hu Ginghai // // Abstr. XIth Int. Congr. World Vet. Poultry Assoc. – Budapest, 1997. – P. 273.
19. Liu, M.R.S. Occurrence and pathology of rough and thin shelled eggs in ducks / M.R.S. Liu // J. Clin. Soc. Vet. Sci. – 1986. – Vol. 12. – P. 65-76.
20. Meszaros, B. A. Experimental infections of laying hens with an adenovirus isolated from ducks showing EDS symptoms / B.A. Meszaros // Acta Vet. Hung. – 1985. – Vol. 33. – P. 125-127.
21. Schloer, G.M. Frequency of antibody to adenovirus 127 in domestic ducks and wild waterfowl / G.M. Schloer // Avian Dis. – 1980. – Vol. 24. – P. 91-98.
22. Schmidt, H. Untersuchungen uber eine Michininfection von Aviarem. Adenovirus und dem virus der infektiosenbronchitis / H. Schmidt, P. Schulze // Arch. Exp. Vet.-med. – 1970. – Bd. 24. – S. 587-607.
23. Van der Hunk, J. Characterization of group II avian adenoviruses with a panel of monoclonal antibodies / J. Van der Hunk. – Avian Dis. – 1990. – Vol. 34, N 1. – P. 12-25.
АДЕНОВИРУСНЫЙ ТРАХЕИТ
Аденовирусный трахеит- остропротекающая болезнь уток, характеризующаяся признаками трахеита, бронхита и пневмонии.
Историческая справка. Впервые болезнь зарегистрирована в Германии с октября 1983 по февраль 1984 года (1). Заболевание отмечено в хозяйствах промышленного типа по выращиванию молодняка уток.
Экономический ущерб определен снижением привесов переболевших особей и летальностью до 40%, финансовыми и материальными затратами на проведение мероприятий по ликвидации инфекции.
Возбудитель. Аденовирус (Adenovirus) относится к роду Aviadenovirus семейства Adenoviridae, имеет округлую и гексагональную форму с диаметром 72-84 нм. Вирусные частицы расположены в измененных клеточных ядрах вокруг эозинофильных телец эпителия трахеи или в вакуолях цитоплазмы гетерофильных гранулоцитов. Он устойчив к воздействию липорастворителей - эфиру и хлороформу.
Эпизоотологические данные. Болеют утята мускусной породы 1-3-недельного возраста. Повторное заболевание среди молодняка и взрослого поголовья не отмечено.
Течение и симптомы. Инкубационный период не определен. Болезнь продолжается 7-9 суток. Утята ограниченно принимают корм, становятся малоподвижными, худеют. Затем у большинства больных особей отмечают трахеальные и бронхиальные шумы, хрипы, одышку и цианоз клюва. Перед гибелью часто регистрируют истощенное состояние и асфиксию (Bergamm V et al., 1985) (1).
Патогенез. Не изучен.
Патологоанатомические изменения. На слизистой оболочке верхней половины трахеи обнаруживают желтоватые эластичные дифтероидные фиброзные наложения, суживающие ее просвет до полной его закупорки. В редких случаях регистрируют гиперемию и отек легких, застой крови в печени. Гистологические исследования показывают компенсаторную гиперемию слизистого эпителия, преобразованного в монослой полиморфных клеток, с мелкокистозным расширением тканевых щелей. Мерцательный эпителий в основном разрушен, сохранившиеся его клетки пронизаны гетерофильными гранулоцитами. Ядра апикальных эпителиальных клеток отечны и увеличены в несколько (до 5) раз, с включением различной величины эозинофильных круглых телец. В финальной стадии отмечается распад клеточного ядра, некроз клеток или базофильное сморщивание пораженной клетки.
Диагноз и дифференциальная диагностика. При постановке диагноза на аденовирусный трахеит учитывают информацию о результатах эпизоотологического обследования, специфичности проявления клинических симптомов и патологоанатомических изменений. Диагноз подтверждают электронно-микроскопическим обнаружением возбудителя болезни. Доминирующими признаками болезни является стенозирующий трахеит, бронхит и пневмония, а также присутствие эозинофильных и базофильных включений в эпителиальных клетках трахеи. Для проведения исследований готовят ультратонкие срезы тканей трахеи. Препараты, фиксированные раствором формалина, поочередно обрабатывают 2% раствором окиси осмия и эпоном 812, а затем окрашивают раствором метиленблау. В измененных клеточных структурах находят эозинофильные тельца в ядрах клеток и вирусные частицы возбудителя болезни.
Аденовирусный трахеит необходимо дифференцировать от гриппа, коронавирусной болезни и пастереллеза.
Грипп - ортомиксовирусная инфекция, распространенная во многих странах и диагностируется у многих видов домашней птицы. Возбудитель – ортомиксовирус, обладающий гемагглютинирующим свойством, с размером вирусных частиц от 80 до 120 нм, грушевидной или нитевидной формы. Чувствителен к воздействию хлороформа и эфира. Поражение желудочно-кишечного тракта сопровождается диареей. Нередко грипп протекает бессимптомно. Для выделения ортомиксовируса чаще используют КЭ и УЭ. Из лабораторных животных более чувствительны мыши, хорьки и хомяки. Распознавание вируса проводят серологическими методами – РЗГА, ИФА, РДП, РСК, а также ПЦР.
Коронавирусная болезнь – инфекция уток пекинской и мускусной пород разного возраста. Зарегистрирована в России, Украине и Беларуси. Вирусные частицы полиморфны, размером от 80 до 300 нм. Максимальное накопление вируса - в содержимом кишечника и печени больной утки. Чувствителен к инактивации эфиром и хлороформом. Отличительные клинические признаки – паралич и полупаралич ног, поражение кишечного тракта утят, снижение яйценоскости до 30% у маточного поголовья. Из патологоанатомических изменений более характерны катаральный и геморрагический энтерит с кровоизлияниями, кровенаполненность и дряблость печени, почек и селезенки, а также нарушение гемодинамики в паренхиматозных органах. Вирусовыделение проводят с использованиемУЭ и КЭ. Для обнаружения специфического антигена коронавируса и его идентификации применяют РДП и ИФА. Дополнительно для выявления возбудителя в пробах патологического материала используют прямой метод ЭМ и РГА.
Пастереллез– бактериальная болезнь около 30 видов птиц. Из уток к нему восприимчив молодняк разных пород в возрасте 40-60 суток. Пастерелла мультоцида культивируется на обычных питательных средах в аэробных условиях и обладает характерными биохимическими свойствами. У больных уток отмечают диарею и наличие артритов. Из патологоанатомических изменений чаще наблюдают мелкоточечные кровоизлияния на слизистых оболочках, перикардит, дуоденит, перигепатит или некротические узелки на поверхности печени. При хроническом течении - фибринозный перитонит. Для выделения культур микроорганизма используют бульон Хоттингера, МПА и МПБ, обогащенные 5% сыворотки крови животных или птиц. Возбулитель пастереллеза патогенен для многих видов лабораторных животных.
Иммунитет. Не изучен.
Лечение. Не проводится.
Профилактика и меры борьбы. Не разработаны. В Германии ликвидацию болезни проводили методом тотального убоя больных и подозреваемых в заражении утят. Тщательная дезинфекция помещений и оборудования была необходима для устранения возбудителя во внешней среде (1, 2).
Список литературы
1. Bergamm, V. Pathomorphologische und elektronenmikroskopische Feststell- und einer Adenovirus-Tracheitisbei Moschusenden (Cairina moschata) / V. Bergamm, R. Heidrick, E. Kinder // Mh. Vet. Med. – 1985. – Bd. 40, N 9. – S. 313-315.
2. McFerran, J.B. Adenovirus infections / J.B. McFerran, B. Adiar // Diseases of Poultry. – 10th ed. – 1997. – P. 607.
АМИЛОИДОЗ
Амилоидоз – хроническая болезнь неизвестной этиологии, частота заболевания которой увеличивается с возрастом утки. Болезнь является частой причиной потерь среди взрослых домашних и диких уток.
Амилоидная ткань присутствует в различных органах, особенно в печени. Регистрация данной болезни увеличивается в тех случаях, когда у птицы находят поражения на нижних конечностях. У взрослых особей коммерческих уток более крупных пород количество вспышек намного выше. Инцидентность значительно снижается при осуществлении контроля за весом тела уток. В состоянии стресса и при содержании в закрытом помещении амилоидоз усиливается. Болезнь поддаётся распознаванию при появлении макроскопических поражений. Наблюдается присутствие различных объёмов асцитической жидкости, которая может увеличивать брюшную полость. Печень увеличена, с песчаной окраской и по консистенции выглядит, как обваренная кипятком. Селезёнка увеличена, с признаками гиперемии могут быть разрывы органа.
Список литературы
1. Cowan, D.F. Avian amyloidosis. II. Incidence and contributing factors of the family Anatidae / D.F. Cowan // Pathol. Veterinaria. – 1968. – Vol. 5, N 1. – P. 59-66.
АСПЕРГИЛЛЁЗ
Аспергиллёз (синонимы: брудерная пневмония, псевдомикоз птиц, плесневый микоз) – контагиозная болезнь, характеризующаяся чаще поражением органов дыхания и реже кожного покрова с образованием фибринозных узелков, изменениями в воздухоносных мешках и летальностью до 60%.
Историческая справка. Аспергиллёз утят известен с давних времен. Болезнь регистрируется повсеместно, особенно в крупных утководческих хозяйствах. В период с 1981 по 1991 годы болезнь диагностирована в Московской, Черкасской, Черниговской, Ивано-Франковской областях, Ставропольском крае и других регионах СССР (Князев В.П. и др.). Аспергиллёз широко распространён в странах Юго-Восточной Азии.
Экономический ущерб. Определен задержкой роста и гибелью утят, затратами на проведение мероприятий по предупреждению и ликвидации аспергиллеза.
Возбудитель. Болезнь преимущественно вызывается грибом Aspergillus fumigatus из рода Aspergillus. Гриб неприхотлив, в естественных условиях растет при низких и умеренных температурах, относительной влажности воздуха выше 10-13%, на различных органических субстратах – овощах, злаках, готовых смесях корма, глубоко проникая внутрь предмета. На плотных питательных средах Сабуро и Чапека или картофельном агаре образует пушистые крупные колонии, сначала голубовато-зеленого, затем, через 3-5 суток, серо-зеленого цвета. Гифы бесцветные и септированные. Верхняя спороносная часть гиф имеет шаровидную форму. Споры (колонии) тоже шаровидные темно-зеленого цвета диаметром 2,5-3,0 мкм. Легко разносятся движением воздуха и предметами ухода. Споры и мицелий устойчивы к физическим факторам. Структуры гриба не обладают иммуногенными свойствами.
Эпизоотологические данные. Водоплавающие птицы чувствительны к аспергиллезу. Они близки по заболеваемости к индейкам, страусам и пингвинам. Среди инфицированных in ovo индюшат аспергиллез может достичь такого уровня, что в 10-суточном возрасте погибает до 10%. К менее восприимчивым относят кур и цесарок.
Резервуаром для A. fumigatus являются почва, корм, подстилка, поверхности стен, полов и оборудования инкубаторов, складские помещения, воздух и вода. Гриб активно размножается в выводных шкафах, на эмбрионах, легко проникает через поры скорлупы яиц и в последующем вызывает острую форму болезни (Князев В.П., Калашников В.А., Московская обл., 1982 г).
Часто отмечают ассоциацию аспергиллеза с колибактериозом, сальмонеллезом, микотоксикозами, коронавирусной болезнью, вирусным гепатитом утят и другими болезнями инфекционной этиологии. В Азии, по данным Higgins D. (1993), аспергиллез по уровню патогенности для утят занимает одно из первых мест, уступая пастереллезу, септицемии (P. anatipestifer), колибактериозу, вирусному гепатиту утят и чуме уток. Другие бактериальные, риккетсионные и вирусные болезни не настолько значимы, по его предположению, как аспергиллез.
В Европе и Северной Америке аспергиллез регистрируют реже, чем стафилококкоз, колибактериоз, чуму и вирусный гепатит утят.
Патогенез. Заражение утят происходит через яйцо и систему дыхания. Наилучшим методом тропизма A. fumigatus является легочная ткань и серозная оболочка воздухоносных мешков. Споры грибов прорастают, образуются колонии, что ведет к развитию воспалительного процесса. Вероятно, в гранулах гриб продуцирует токсины, влияющие на дыхание. Гибель птицы происходит по причине расстройства функции дыхательной системы и в дальнейшем удушья.
Течение и симптомы. Инкубационный период варьирует от 3 до 10 суток. Отмечают острую и хроническую формы течения болезни. Острую форму чаще регистрируют при трансовариальном заражении утят. Степень проявления данной формы зависит от патогенности мицелия, сохранения его после инактивации гриба на поверхности скорлупы яиц перед инкубацией, а также от присутствия ингибиторов (витаминов Е и С, метионина и т.д.) для гриба аспергилла.
Первые признаки при острой форме - скованность, малоподвижность, одышка, «зевание», учащенное дыхание, периодическое вытягивание шеи вперед и вверх, «заглатывание» воздуха. Из носовых ходов может выделяться серозная жидкость. На 2-4 сутки проявления болезни утята снижают привесы и слабеют. В последующем отмечают судороги, параличи и диарею. Нередко болезнь заканчивается гибелью птицы.
Острую форму у индеек-бройлеров чаще отмечают в 4-6-недельном возрасте. Вначале болезнь протекает в субклинической форме, затем симптомы ее проявляются более отчетливо. Кроме легких и воздухоносных мешков, поражаются и другие органы: кожа (дерматит), костный мозг (воспаление), глазные яблоки и головной мозг. В последнем случае типичным симптомом является кривошея.
Хроническую (затяжную) форму в основном диагностируют у ремонтного и взрослого поголовья уток после трансовариального или, чаще, аэрогенного проникновения аспергилл в легкие. Основные признаки: отставание в росте,
|
|
|

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!