

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...
Топ:
Комплексной системы оценки состояния охраны труда на производственном объекте (КСОТ-П): Цели и задачи Комплексной системы оценки состояния охраны труда и определению факторов рисков по охране труда...
Выпускная квалификационная работа: Основная часть ВКР, как правило, состоит из двух-трех глав, каждая из которых, в свою очередь...
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного...
Интересное:
Инженерная защита территорий, зданий и сооружений от опасных геологических процессов: Изучение оползневых явлений, оценка устойчивости склонов и проектирование противооползневых сооружений — актуальнейшие задачи, стоящие перед отечественными...
Аура как энергетическое поле: многослойную ауру человека можно представить себе подобным...
Наиболее распространенные виды рака: Раковая опухоль — это самостоятельное новообразование, которое может возникнуть и от повышенного давления...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Состав веществ тела микроорганизмов в принципе мало отличается от химического состава тела животных и растений,
Важнейшими химическими элементами, преобладающими в клетках микроорганизмов, являются углерод, кислород, водород, азот, сера, фосфор, калий, натрий, магний, кальций, хлор и железо. Первые четыре из указанных" элементов составляют основу органического вещества, поэтому называются органогенными элементами. Они составляют 90-97% сухого вещества. Другие элементы называются зольными или минеральными, на долю их приходится 3-10%. Из них большую часть составляет фосфор, который входит в состав важных веществ клетки (нуклеиновых кислот, АТФ и др.).
В клетках микроорганизмов находятся, хотя и в крайне малых количествах, микроэлементы: медь, цинк, марганец, молибден и многие другие. Некоторые микроэлементы входят в состав ферментов, витаминов.
Соотношение отдельных химических элементов заметно колеблется в зависимости от вида микроорганизма и условий его роста. Содержание (среднее) органогенных элементов в клетках микроорганизмов (в % на сухое вещество) приведено в табл. 1.
Таблица 1
| Органогенные элементы | Бактерии | Дрожжи | Мицелиальные грибы |
| Углерод Азот Водород Кислород | 50,4 12,3 6,8 30,5 | 49,8 12,4 6,7 31,1 | 47,9 5,3 6,5 40,2 |
Все элементы связаны в клетках в различные соединения, среди которых преобладает вода.
Вода составляет 75-85% массы клеток. Она имеет важное значение в жизни микроорганизмов. Все вещества поступают в клетку только с водой, с ней же удаляются и продукты обмена.
Часть воды в клетке находится в связанном Состоянии (с белками, углеводами и другими веществами) и входит в клеточные структуры. Остальная вода находится в свободном состоянии. Она служит дисперсной средой для коллоидов и растворителем различных органических и минеральных соединений, образующихся в клетке при обмене веществ. Вода — участник многих химических реакций, протекающих в клетке.
|
|
Содержание воды в клетке изменяется в зависимости от условий внешней среды, физиологического состояния клетки, ее возраста и т. п. В спорах бактерий и грибов значительно меньше воды, чем в вегетативных клетках, за счет низкого содержания в них свободной воды. Потеря свободной воды влечет за собой высыхание клетки и более или менее глубокие изменения обмена веществ. С потерей связанной воды нарушаются клеточные структуры и наступает гибель клетки.
Органические вещества. Сухое вещество клеток микроорганизмов не превышает 15—25% и состоит преимущественно (до 85-95%) из органических соединений — белков, нуклеиновых кислот, углеводов, липидов и др.
Белковые вещества являются основными компонентами клетки. Содержание их в бактериях достигает 40-80% сухого вещества, в дрожжах 40-60, грибах — 15-40%. По аминокислотному составу белки микроорганизмов сходны с белками других организмов.
Некоторые белки выполняют каталитические функции: катализируют различные биохимические реакции, протекающие постоянно в микробной клетке. Такие белки называются ферментами.
Многие микроорганизмы накапливают большое количество белков в клетке. Считается, что такие микроорганизмы можно рассматривать в качестве возможных продуцентов пищевого и кормового белка. Рентабельность промышленного производства таких "белковых продуктов" определяется быстротой накопления биомассы микроорганизмов и использованием для их выращивания дешевого недефицитного сырья.
В клетках микроорганизмов содержатся нуклеиновые кислоты — рибонуклеиновая кислота (РНК) и дезоксирибо-нуклеиновая (ДНК).
ДНК сосредоточена главным образом в ядре клеток или в нуклеоидах бактериальных клеток. В молекуле ДНК закодирована вся наследственная информация клетки, "записаны" все особенности будущего организма, выработанные в процессе длительной эволюции и свойственные данному виду. РНК преимущественно сосредоточена в цитоплазме и в рибосомах.
|
|
Углеводы входят в состав различных мембран клеток микроорганизмов. Они используются для синтеза различных веществ в клетке и в качестве энергетического материала. Углеводы могут откладываться в клетке и в виде запасных питательных веществ. В клетках большинства бактерий углеводы составляют 10—30% сухого вещества, у грибов содержание углеводов выше — 40-60%. В теле микроорганизмов углеводы встречаются преимущественно в виде полисахаридов — гликогена, гранулезы (углевод, близкий к крахмалу), декстрина, клетчатки или близких ей соединений. Полисахариды находятся ив связанном состоянии с белками, липидами.
Липиды в клетках большинства микроорганизмов составляют 3—10% сухого вещества. Лишь у некоторых дрожжей и плесеней количество липидов может быть значительно выше — до 40—60%. Липиды входят в состав клеточной стенки, цитоплазматической мембраны и в состав других мембран, а также откладываются в виде запасных гранул. Часть липидов связана с другими веществами клетки, образуя сложные комплексы.
В клетках микроорганизмов обнаруживают пигменты, витамины и другие органические вещества.
Пигменты, или красящие вещества, обусловливают окраску микроорганизмов, иногда они выделяются в окружающую среду. Фотосинтезирующие бактерии содержат особые пигменты типа хлорофилла растений — бактериохлорофилл. Фототрофные бактерии и некоторые дрожжи образуют, кроме того, пигменты - каротиноиды. Каротиноиды, как и бактериохлорофилл, участвуют в ассимиляции углекислого газа. У некоторых дрожжей в значительных количествах образуются желто-розовые и оранжевые каротиноиды, которые являются провитаминами витамина А.
Минеральные вещества. Они составляют не более 5-15% сухого вещества клетки и представлены сульфатами, фосфатами, карбонатами, хлоридами и др. Фосфаты могут быть в свободном виде и входят в состав различных соединений: нуклеиновых кислот, АТФ и АДФ.
Минеральные соединения играют большую роль в регулировании внутриклеточного осмотического давления и коллоидного состояния цитоплазмы. Они влияют на скорость и направление биохимических реакций, являются стимуляторами роста, активаторами ферментов.
|
|
Ферменты микроорганизмов
Общая характеристика
Все разнообразные и многочисленные биохимические реакции, протекающие в живом организме в связи с его обменом веществ, совершаются при участии ферментов — биологических катализаторов, вырабатываемых клетками организма.
Ферменты "есть в полном смысле возбудители жизни", — писал академик И. П. Павлов.
Структура, и свойства, ферментов. Ферменты представляют собой белки простые (протеины) или сложные (протеиды), состоящие из белка и небелкового компонента — активном группы. Таким образом, есть ферменты однокомпонентные и двухкомпонентные.
В состав активной группы двухкомпонентных ферментов входят витамины или их производные, различные металлы (Ре, Со, Си), азотистые основания и др.
Активная группа ферментов обусловливает их каталитическую способность, а белковая часть — специфические свойства, избирательную способность действовать на определенный субстрат.
Прочность связи активной группы с белком у разных ферментов неодинакова. У некоторых она легко может отделяться от белковой части фермента и вступать во временную связь с другими белками. Такие активные группы называют коферментами.
Активные группы, прочно связанные с белковой частью фермента, называются простатическими группами этих ферментов.
В однокомпонентных ферментах роль активной группы выполняют определенные химические группировки в молекуле белка, составляя активный (каталитический) центр фермента.
Ферменты обладают очень высокой активностью. Ничтожно малого количества фермента достаточно, чтобы вовлечь в реакцию значительную массу реагирующего вещества (субстрата). Например, 1 г амилазы при благоприятных условиях может превратить в сахар 1 т крахмала.
Ферменты действуют чрезвычайно быстро, резко ускоряя реакцию. Молекула фермента за 1 мин может вызвать превращение десятков и сотен тысяч молекул соответствующего субстрата.
|
|
Особенностями ферментов являются их субстратная специфичность и специфичность действия — каждый фермент взаимодействует лишь с одним определенным веществом и катализирует лишь одно из тех превращений, которым может подвергаться данное вещество.
Специфичность ферментов обусловлена структурными особенностями их молекул и субстрата. Субстрат и фермент подходят друг к другу, как ключ к замку.
Катализируемая однокомпонентным ферментом реакция начинается со связывания субстрата с ферментом в определенном участке его — активном центре. Образуется комплекс фермент — субстрат. По окончании реакции образовавшийся комплекс фермента с продуктами реакции распадается, и при этом освобождаются исходный фермент и конечные продукты ферментативного процесса (рис. 19).
У двухкомпонентных ферментов в связывании и переносе отдельных фрагментов субстрата участвуют коферменты и простетические группы.
Ферменты отличаются неустойчивостью (лабильностью) к воздействию ряда факторов внешней среды. Эта неустойчивость во многом объясняется белковой природой ферментов и выражается в том, что они теряют свою активность (инактивируются).

Рис. 19. Схема взаимодействия комплекс активированный фермента с субстратом
Условия действия ферментов. Важнейшим фактором, определяющим активность ферментов, является температура. По мере повышения температуры возрастает начальная скорость ферментативной реакции. Однако по достижении известного предела дальнейшее повышение температуры вызывает денатурацию ферментного белка.
Уровень температуры, вызывающий денатурацию различных ферментов, неодинаков. Для одних ферментов это 40-50°С, для других (термоустойчивых) — только 70"С, но при температуре около 100"С почти все ферменты инактивируются.
Некоторые ферменты после тепловой инактивации восстанавливают каталитическую активность (в случае обратимого процесса денатурации белка).
Оптимальная температура, при которой данный фермент наиболее активен, для разных ферментов различна и в известной мере характеризует каждый фермент. У холодолюбивых микроорганизмов температурный оптимум ферментов значительно ниже, чем у теплолюбивых.
При температуре ниже оптимальных пределов скорость ферментативных процессов уменьшается. В условиях температур, близких к нулю и особенно ниже нуля, эти реакции значительно замедляются, а некоторые приостанавливаются, хотя при таких температурах ферменты заметно не разрушаются.
Большое влияние на ход ферментативных процессов оказывает рН среды. Для действия каждого фермента имеется свое оптимальное значение рН среды. При значении рН выше или ниже оптимальной величины активность ферментов снижается.
|
|
На активность ферментов влияет и присутствие в среде некоторых химических веществ. Одни из них ускоряют ферментативную реакцию (активаторы), другие — снижают ее или полностью приостанавливают (ингибиторы). Действие многих активаторов и ингибиторов специфично.
Активаторами ферментов являются, например, металлы (Сu, Мn, Мg, Со), витамины.
Ингибиторами ферментов служат соли тяжелых металлов, антибиотики, Н2S и др. Ингибиторы соединяются с активными группами или активными центрами ферментов, парализуя тем самым связывание с ними субстрата.
Лучистая энергия (ультрафиолетовые лучи, радиоактивные излучения) инактивирует ферменты.
Концентрация субстрата, т. е. вещества, на которое действует фермент, и концентрация фермента также влияют в известной мере на скорость процессов.
Биохимические процессы, протекающие в микробных клетках, регулируются ферментами, поэтому любой фактор, действующий на активность фермента, действует и на микроорганизм.
Каждый микроорганизм обладает комплексом разнообразных ферментов, своеобразием и активностью которых определяются их биохимическая деятельность, избирательность в отношении питательных веществ, роль микроорганизмов в круговороте веществ в природе, в процессах порчи пищевых продуктов.
Ферменты, присущие данному микроорганизму, входящие в число компонентов его клетки, называют конститутивными. Существуют ферменты индуцируемые {адаптивные), которые вырабатываются клеткой только при наличии в среде вещества (индуктора), стимулирующего синтез данного фермента. Например, микроорганизм, не ассимилирующий мальтозу, можно приучить к использованию ее, культивируя в среде с этим сахаром как единственным источником углерода. В этих условиях микроорганизм синтезирует фермент, которым ранее он не обладал.
В живой клетке действие ферментов происходит упорядочение, строго согласованно. Ферменты локализованы в различных клеточных структурах (в мезосомах, митохондриях, цитоплазматической мембране и др.).
Некоторые ферменты выделяются микроорганизмами наружу (в среду), их принято называть экзоферментами.
Они играют большую роль в подготовке пищи к ее поступлению в клетку. Происходит внеклеточное "переваривание" пищи — расщепление сложных веществ субстрата (крахмала, белков и др.) на более простые, способные проникать в клетку.
Ферменты, прочно связанные с цитоплазмой, не выделяющиеся при жизни клетки в окружающую среду, называют эндоферментами (внутриклеточными). Они участвуют во внутриклеточных процессах обмена веществ.
Хотя ферменты и вырабатываются клеткой, они после ее гибели временно остаются в активном состоянии, и может произойти автолиз (от греч. аutos — сам, lysis — растворение) — саморастворение, или самопереваривание, клетки под влиянием ее внутриклеточных ферментов. При разрушении клеток ферменты поступают в среду — субстрат, в котором развивались микроорганизмы. При хранении пищевых продуктов, значительно обсемененных микроорганизмами, даже в условиях, исключающих их развитие, возможно снижение качества продуктов за счет ферментов автолизированных микробных клеток.
Классификация ферментов
Номенклатура ферментов складывалась постепенно, по мере их открытия и изучения. Названия ферментов вначале носили случайный характер. Например, фермент, расщепляющий крахмал, был назван диастазом, а фермент желудочного сока, расщепляющий белки, — пепсином. Позднее название фермента стали составлять из корня слова, обозначающего вещество, на которое действует фермент, добавляя к нему окончание "аза". Так, фермент, расщепляющий крахмал (амилум), стали называть амилазой, фермент, разлагающий мальтозу, — мальтазой и т. п. Наряду с этим ферменты называют и по функции — по химической реакции, которую они катализируют. Например, ферменты, катализирующие отщепление водорода от субстрата (дегид-рогенирование), называют дегидрогеназами, а расщепляющие "сложные органические соединения путем гидролиза — гидролазами.
В настоящее время известно более 2000 ферментов.
В соответствии с принятой в настоящее время классификацией ферментов (Правила номенклатуры ферментов, 1972) все ферменты делят на шесть классов: 1-й — оксидо-редуктазы; 2-й — трансферазы; 3-й — гидролазы; 4-й — лиазы; 5-й — изомеразы; 6-й — лигазы. Классы подразделяют на подклассы, которые делят на подподклассы. Каждый фермент имеет название и шифр из четырех цифр. Первая цифра обозначает класс, вторая — подкласс, третья — подподкласс, четвертая — порядковый номер данного фермента.
Ниже рассматриваются только некоторые наиболее распространенные ферменты микроорганизмов.
Оксидоредуктазы, — окислительно-восстановительные ферменты. В этот класс входят многочисленные ферменты, катализирующие окислительно-восстановительные реакции процессов энергетического обмена (дыхания, брожения) микроорганизмов. К оксидоредуктазам относятся следующие ферменты.
Дегидрогеназы — ферменты, катализирующие реакцию дегидрогенирования органических соединений: отщепление водорода. Отнятый водород передается дегидрогена-зой какому-либо другому веществу (промежуточному — временному или конечному акцептору водорода). Одновременно одно вещество окисляется, а другое восстанавливается.
Дегидрогеназы специфичны по отношению к донору водорода и к его акцептору. Их делят на анаэробные и аэробные.
Анаэробные (первичные) дегидрогеназы передают отнятый от окисляемого субстрата водород другим дегидрогена-зам или молекулам каких-либо органических веществ, но не кислороду воздуха. Эти дегидрогеназы являются двухкомпонентными ферментами. Кофермент многих анаэробных дегидрогеназ — никотинамид-аденин-динуклеотид (сокращенно НАД) (см. схему на с. 63).
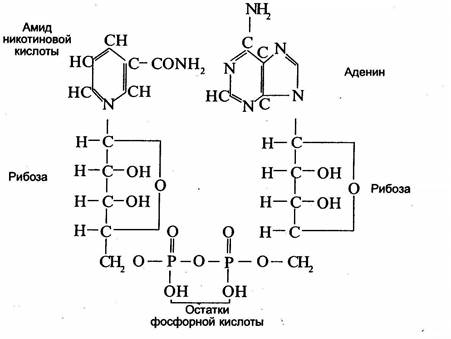
Коферментом других анаэробных дегидрогеназ является никотинамид-аденин-динуклеотид-фосфат (НАДФ).
Анаэробные дегидрогеназы имеются как у анаэробов, так и у аэробов.
Аэробные (вторичные) дегидрогеназы передают активированный водород, отнятый у окисляемого вещества или от вос становленной анаэробной дегидрогеназы, кислороду воздуха непосредственно либо через промежуточных переносчиков.
Аэробные дегидрогеназы, передающие водород субстрата непосредственно кислороду, называют оксидазами. К оксидазам относится, например, полифенолоксидаза, катализирующая реакцию окисления, полифенолов с образованием темноокрашенных соединений — меланинов. Этот фермент имеется у многих плесневых грибов. Действие полифенолоксидазы проявляется в потемнении тканей плодов и овощей, пораженных этими плесенями.
К аэробным дегидрогеназам относятся флавиновые ферменты, коферментом которых является флавин-аденин-ди-нуклеотид (ФАД). В состав кофермента входит рибофлавин (витамин В2). Одни флавиновые ферменты могут переносить водород непосредственно на кислород, т. е. являются оксидазами; другие передают водород от окисляющихся веществ кислороду через ряд промежуточных переносчиков. В таких случаях участвуют системы ферментов, а водород многократно переносится от одного вещества к другому, пока не достигнет своего конечного акцептора — кислорода. Последний подвергается восстановлению с образованием воды или перекиси водорода.
Особо важное значение в процессах аэробного дыхания имеет цитохромная ферментная система, состоящая из цитохромов и фермента цитохромоксидазы.
Цитохромы, представляют собой гемопротеиды. В состав простетической группы (гема), функционирующей как переносчик электронов, входит двухвалентное железо. Роль цитохромов в процессе дыхания заключается в последовательном переносе электронов от водородного атома восстановленной дегидрогеназы на цитохромоксидазу.
Цитохромоксидаза — двухкомпонентный гемосодержащий фермент, катализирует окислительно-восстановительную реакцию между восстановленным цитохромом (последним в цепи цитохромов) и кислородом.
Цитохромная система содержится в клетках всех микроорганизмов, за исключением облигатно-анаэробных бактерий.
Каталаза — двухкомпонентный фермент, расщепляет перекись водорода на воду и молекулярный кислород.
Трансферазы — ферменты переноса. Ферменты этой группы катализируют перенос частей молекул или атомных группировок от одних соединений к другим. Известно много таких ферментов; их различают по тем группам, перенос которых они катализируют.
Наиболее важное значение в обмене веществ имеют фосфотрансферазы и аминотрансферазы.
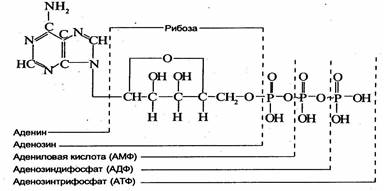
Фосфотрансферазы (киназы) катализируют перенос остатков фосфорной кислоты с одного вещества на другое.
Большинство реакций переноса фосфатных групп протекает с участием аденозинтрифосфата (АТФ) и аденозин-дифосфата (АДФ). Эти реакции имеют большое значение, благодаряим осуществляется перенос энергии с одного вещества на другое.
Из приведенной ниже формулы видно, что АТФ — высокоэнергетическое соединение; оно имеет одну простую связь (-) и две макроэргические ("богатые энергией"), обозначаемые значком (~). При гидролизе обычной фосфатной связи освобождается 8,4*103-12,6*103 Дж на грамм-молекулу отщепленного фосфата, а при гидролизе макроэргической связи — около 4,2*104 Дж.
Фосфотрансферазы участвуют в процессах дыхания и брожения.
Аминотрансферазы — ферменты, осуществляющие реакции переаминирования, т. е. межмолекулярный перенос аминогруппы (-NH2) с аминокислот на кетокислоты. Эти ферменты обладают специфичностью. Аминотрансферазы — двухкомпонентные ферменты, в состав кофермента входит витамин В6. В обмене веществ они играют большую роль, участвуют в образовании новых аминокислот в клетке.
Гивролазы. К гидролазам относятся ферменты, катализирующие процессы расщепления и синтеза сложных органических веществ по типу гидролитических реакций с участием воды. Большинство гидролаз являются однокомпонентными ферментами.
Гидролазы подразделяют на подгруппы в зависимости от вещества, на которое они действуют.
Карбогидразы — это ферменты, катализирующие гидролиз и синтез глюкозидов, ди-, три- и полисахаридов.
Примерами карбогидраз, расщепляющих дисахариды, широко распространенных у микроорганизмов, служат:
мальтаза (α-глюкозидаза) — расщепляет мальтозу (солодовый сахар) на две молекулы глюкозы;
сахараза (инвертаза, β -фруктофуранозидаза) — расщепляет сахарозу на глюкозу и фруктозу;
лактаза (β -галактозидаза) — расщепляет молочный сахар (лактозу) на галактозу и глюкозу.
Из гидролаз, действующих на полисахариды, наибольшее значение имеют следующие;
амилазы — ферменты, катализирующие гидролиз крахмала. Известно три типа амилаз: α-амилаза, β -амилаза и глюкоамилаза. Они различаются свойствами и способом действия на крахмал. Амилазы находятся в мицелиальных грибах и многих бактериях; дрожжи не содержат амилаз;
целлюлоза — фермент, гидролизующий целлюлозу (клетчатку).
Пектолитические ферменты — это комплекс ферментов (протопектиназа, пектинэстераза, полигалактуроназа), гидролизующих протопектин и растворимый пектин с образованием метилового спирта, галактуроновых кислот, пентоз, гексоз.
Пектолитические ферменты имеются у многих плесеней и у некоторых бактерий.
Пептидазы (протеолитические ферменты) катализируют гидролиз белков, пептидов, расщепляя пептидные связи.
Пептидазы обладают специфичностью, каждая пептидаза разрывает пептидные связи между определенными аминокислотами.
Дезаминазы и амидазы — ферменты, катализирующие гидролитическое расщепление аминокислот и амидов с отщеплением азота в виде аммиака.
Эстеразы — ферменты, катализирующие реакции расщепления и синтеза сложных эфиров (эстеров). Они широко распространены у микроорганизмов. Важную роль в обмене веществ микроорганизмов играют липазы. Липазы — это ферменты, вызывающие гидролиз жиров на глицерин, и высокомолекулярные жирные кислоты.
Лиазы. К классу лиаз относятся ферменты, которые катализируют реакции негидролитического расщепления органических веществ, сопровождаемые отщеплением от субстрата тех или иных химических групп; СО2, НдО, МНд.
Альдолаза — фермент, обратимо расщепляющий шестиуглеродную молекулу фруктозодифосфат на два трехуглеродных соединения: фосфодиоксиацетон и фосфоглицериновый альдегид. Этот фермент участвует в начальной стадии превращения сахара в процессе дыхания и брожения.
Декарбоксилазы — ферменты, катализирующие декар-боксилирование (отщепление СО2) органических кислот.
Во многих микроорганизмах содержится, например, пи-руватдекарбоксилаза, катализирующая отщепление СО2 от пировиноградной кислоты с образованием уксусного альдегида. В состав кофермента этой декарбоксилазы входит витамин В1.
Декарбоксилазы аминокислот участвуют в отщеплении СО2 от аминокислот с выделением аминов.
Микроорганизмы, Особенно гнилостные бактерии, богаты декарбоксилазами аминокислот.
Изомеразы. Ферменты этого класса осуществляют превращение органических соединений в их изомеры — внутримолекулярное перемещение радикалов, атомов, атомных группировок.
К этому классу относятся следующие:
триозофосфатизомераза — катализирует взаимное превращение фосфотриоз; фосфодиоксиацетона и фосфо-глицеринового альдегида;
глюкозофосфатизомераза — катализирует обратимое превращение глюкозо-6-фосфат во фруктозо-6-фосфат.
Оба эти фермента участвуют на первых стадиях превращения сахара в процессах дыхания и брожения.
Лигазы (синтетазы). В этот класс входят ферменты, катализирующие реакции синтеза сложных органических соединений из более простых. Эти реакции требуют затраты энергии и обычно протекают одновременно с расщеплением пирофосфатной (макроэргической) связи в АТФ. Примерами таких ферментов могут служить:
карбоксилазы – катализируют при участии АТФ присоединение углекислого газа к органическим кислотам;
глутаминсинтетаза и аспарагинсинтетаза — ферменты синтеза глутамина и аспарагина из NН3 и соответствующих аминокислот с участием АТФ.
Лигазы играют большую роль в углеводном и азотном обмене микроорганизмов.
Использование микробных ферментов
Человек издавна использовал ферментативную активность микроорганизмов. Широкое применение микроорганизмов в пищевых производствах основано на использовании их ферментативной деятельности в перерабатываемом пищевом сырье. Культуры микроорганизмов можно заменять их ферментами, выделив их в виде препаратов из клеток или культуральной среды.
Использование микроорганизмов для получения ферментов имеет ряд преимуществ по сравнению с растительным и животным сырьем:
микроорганизмы обладают богатым "ассортиментом" ферментов; среди них есть такие, которые отсутствуют у
животных и в растениях;
микроорганизмы быстро размножаются и в течение короткого времени дают огромную массу клеток, из которых (или из культуральной среды) можно выделить большое
количество фермента;
микроорганизмы растут на относительно дешевых субстратах, например, на отходах различных промышленных
производств;
управлять развитием микроорганизмов при современной аппаратуре таких производств значительно легче и проще, чем выращивать растения и животных.
В настоящее время во многих отраслях народного хозяйства ферменты микробного происхождения вытесняют ферменты растительного и животного происхождения.
Отечественное производство микробных ферментных препаратов в последние годы интенсивно развивается. В настоящее время десятки различных ферментов в виде индивидуальных ферментных белков и технических препаратов разной степени очистки производятся в промышленном масштабе с использованием культур плесневых грибов, бактерий, дрожжей.
Ферментный препарат отличается от фермента тем, что содержит помимо белка различные балластные вещества. В настоящее время ферментные препараты довольно широко применяют в пищевой промышленности. Так, препараты грибных амилолитических ферментов используют при производстве этилового спирта из крахмалосодержащего сырья вместо зернового солода; в пивоварении — в целях частичной замены солода несоложенным (не подвергавшимся прорастанию) ячменем; в хлебопекарной промышленности — взамен солода при изготовлении заварного ржаного хлеба; добавляют грибные амилазы и в пшеничное тесто. Поскольку в этом препарате помимо амилазы имеются, хотя и в небольшом количестве, другие ферменты (мальтаза, пептидазы), процесс изготовления теста ускоряется: увеличиваются объем и пористость хлеба, улучшаются его внешний вид, аромат, вкус. С помощью грибной глюкоамилазы получают глюкозную патоку и кристаллическую глюкозу из крахмала.
Пектолитические грибные ферментные препараты используют в соко-морсовом производстве и виноделии. В результате разрушения пектина этими ферментами ускоряется процесс выделения сока, увеличивается его выход, улучшаются фильтрация и осветление соков.
Ферментные препараты, содержащие микробные пептидазы, применяют для повышения стойкости (предохранения от белкового помутнения) вина и пива; в сыроделии — взамен (частично) сычужного фермента. Целесообразно использовать микробные пептидазы для размягчения мяса, ускорения созревания мяса и сельди, получения из отходов рыбной и мясной промышленности пищевых гидролизатов и в других технологических процессах переработки животного и растительного сырья. В легкой промышленности их применяют при обработке кож, тканей, мехов, льна; в сельском хозяйстве — при приготовлении различных видов кормов для животных. В медицине и медицинской промышленности ферменты используют в виде лечебных препаратов, при обработке сырья, предназначенного для лекарственных веществ и других целей.
|
|
|

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой...

Типы оградительных сооружений в морском порту: По расположению оградительных сооружений в плане различают волноломы, обе оконечности...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!