

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Своеобразие русской архитектуры: Основной материал – дерево – быстрота постройки, но недолговечность и необходимость деления...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Своеобразие русской архитектуры: Основной материал – дерево – быстрота постройки, но недолговечность и необходимость деления...
Топ:
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного хозяйства...
Устройство и оснащение процедурного кабинета: Решающая роль в обеспечении правильного лечения пациентов отводится процедурной медсестре...
Интересное:
Аура как энергетическое поле: многослойную ауру человека можно представить себе подобным...
Что нужно делать при лейкемии: Прежде всего, необходимо выяснить, не страдаете ли вы каким-либо душевным недугом...
Мероприятия для защиты от морозного пучения грунтов: Инженерная защита от морозного (криогенного) пучения грунтов необходима для легких малоэтажных зданий и других сооружений...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
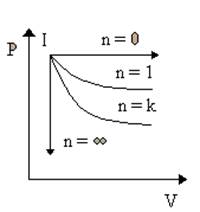 Реальные процессы в газах, при которых изменяются все три параметра состояния, называются политропными процессами и описываются так называемым уравнением политропы:
Реальные процессы в газах, при которых изменяются все три параметра состояния, называются политропными процессами и описываются так называемым уравнением политропы:
PVn=const
1. n=0; P=const изобарный
2. n=1; PV=const изотермический
3. n= ∞; PV∞=const
P1/∞V=const'; V=const изохорный
4. n=k; PVk=const; k= 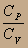 >1 адиабатный
>1 адиабатный
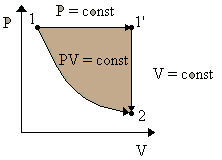 Работа, совершаемая за время процесса - это площадь под кривой (рассматриваем равновесные процессы). Если переходить из одного состояния в другое разными путями, то работа будет неодинаковой, т.е. работа (как и теплота) зависит от пути процесса
Работа, совершаемая за время процесса - это площадь под кривой (рассматриваем равновесные процессы). Если переходить из одного состояния в другое разными путями, то работа будет неодинаковой, т.е. работа (как и теплота) зависит от пути процесса
Рассмотрим процесс изотермического сжатия и расширения газа, протекающий равновесно. Как его провести? Нужно расширить газ при Т=const, но он может охлаждаться при расширении (реальный газ). Существует идеализированный подход - понятие об идеальном газе, идеальном устройстве. В данном случае рассмотрим идеальное устройство - цилиндр с поршнем без трения, внутри - идеальный газ. Цилиндр помещается в термостат с Т=const. Сжатие идёт за счёт нагружения цилиндра песчинками. При приближении веса песчинки к неосязаемо малой величине мы асимптотически приближаемся к равновесной кривой. Какую работу совершает газ при сжатии δА=PdV;
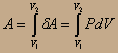
Газ - идеальный, поэтому к нему применимо уравнение Клапейрона-Менделеева: PV=nRT => 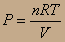
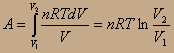
За счёт чего совершается работа при изотермическом расширении газа:
Q=ΔU+A; A=Q-ΔU;
т.е. мы видим, что работа может совершаться как за счёт теплоты, отбираемой у термостата, так и (в общем случае) за счёт уменьшения внутренней энергии самого идеального газа. Для установления истинной причины Гей-Люссак и Джоуль поставили опыт:
Газ – воздух
В термостат опущен термометр для установления изменения температуры. Если расширение газа в пустоту происходит за счёт внутренней энергии, то в обоих случаях должна резко падать температура, что фиксируется отбором тепла от термостата. А=0 (газ расширяется в пустоту) => Q=ΔU; Запустили газ, термометры были неточные, они не заметили изменения температуры. Q=0; U=0; Был сделан вывод, что при изменении объёма внутренняя энергия не изменяется. Но это справедливо только для идеального газа.
|
|
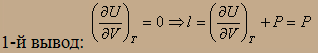 внутреннее давление идеального газа отсутствует.
внутреннее давление идеального газа отсутствует.
2-й вывод: Расширение идеального газа не может идти за счёт внутренней энергии. Тогда работа идёт за счёт передачи теплоты от термостата:
т.к. P1V1=P2V2, то 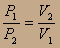 и
и 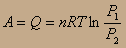 итого
итого 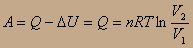
К реальным газам это неприменимо.
Изохорный процесс
V=const; δA=PdV; dV=0; A=0;
Как он проводится в модельных условиях? В цилиндре поршень жестко закреплён на одном уровне, затем переносим этот цилиндр по серии термостатов с постепенно повышающейся Т. С увеличением Т газ будет пытаться расшириться, но этого не произойдёт, будет повышаться давление. А подводимая теплота будет идти на изменение внутренней энергии:
Q= ΔU+A; QV =ΔU; 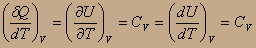
dU=CVdT; => ΔU=CVΔT= CV(T2 –T1);
Изменение внутренней энергии при передаче тепла от термостатов цилиндру. При выводе данного выражения мы не учитывали зависимость C=f(T) и считали, что при не очень большом изменении температуры CV =const.
Изобарный процесс
P=const
 Возьмём, как и прежде, цилиндр с газом и поршнем, нагруженным до давления Р. Поршень должен и в этом случае свободно скользить в цилиндре, который будем переносить по ряду термостатов с постоянно повышающейся температурой. Газ нагревается и расширяется от V1 до V2 при P=const. Следовательно,
Возьмём, как и прежде, цилиндр с газом и поршнем, нагруженным до давления Р. Поршень должен и в этом случае свободно скользить в цилиндре, который будем переносить по ряду термостатов с постоянно повышающейся температурой. Газ нагревается и расширяется от V1 до V2 при P=const. Следовательно, 
Применяя эту формулу к идеальному газу, для которого
получим A=nR(T2-T1);
Последнее выражение показывает, что работа изобарного процесса пропорциональна разности температур идеального газа. С учётом полученного выражения для работы I-е начало термодинамики можно записать так:
QP =ΔU+PΔV=(U2-U1)+P(V2-V1)=(U2+PV2)-(U1+PV1)=H2-H1 , где H ≡U+PV- энтальпия
|
|
Н - энтальпия или теплосодержание, функция состояния, т.к. U - есть функция состояния, Р и V - параметры состояния. QP=ΔH Тепловой эффект процесса при Р=const равен изменению энтальпии системы, QV=ΔU при V=const - внутренней энергии системы.
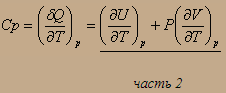 Выведем связь между СP и СV :
Выведем связь между СP и СV :
Из второго аналитического выражения первого начала термодинамики имеем:
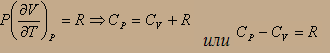 часть 2 показывает, что теплота, необходимая для нагревания тела на один градус, расходуется на увеличение внутренней энергии системы и на работу против внешнего постоянного давления Р, преодолеваемого системой при расширении вследствие нагревания. Для идеального газа, т.к. U≠f(P), то
часть 2 показывает, что теплота, необходимая для нагревания тела на один градус, расходуется на увеличение внутренней энергии системы и на работу против внешнего постоянного давления Р, преодолеваемого системой при расширении вследствие нагревания. Для идеального газа, т.к. U≠f(P), то 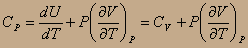
Из уравнения состояния идеального газа PV=RT
Адиабатический процесс
Это процесс, протекающий в условиях полной тепловой изоляции, т.е. Q=0 или δQ=0.
Проводится он так: цилиндр и поршень изготовлены из материала, не проводящего теплоту. Так же, как и в случае изотермического расширения, поршень вообразим загруженным мелким песком, уравновешивающим давление газа Р. Сбрасывая по одной песчинке, т.е. проводя процесс равновесно, постепенно уменьшаем внешнее давление. При этом газ расширяется, совершая работу без поглощения теплоты. Поэтому в соответствии с первым законом термодинамики:
dU+ δA=0 => dU+PdV=0; -dU=PdV;
Т.е. при адиабатном процессе работа совершается за счёт убыли внутренней энергии газа, который при этом охлаждается. Вычислим её величину:
dU=CVdT; δA=-CV dT; 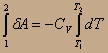
Aадиаб.=-СV(T2-T1)=CV(T1-T2). Здесь, как и ранее, считаем, что СV≠f(T);
Выведем связь между объёмом и давлением в адиабатическом процессе, т.е. получим уравнение адиабаты
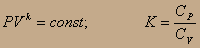 >1 СP-CV=R -dU=PdV; -CVdT=PdV; СVdT+PdV=0
>1 СP-CV=R -dU=PdV; -CVdT=PdV; СVdT+PdV=0
Заменим Р из уравнения идеального газа и разделим на Т:
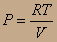
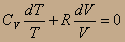 PV=RT; в полученном уравнении разделены переменные, поэтому его можно интегрировать, считая, что СV≠f(T). Тогда
PV=RT; в полученном уравнении разделены переменные, поэтому его можно интегрировать, считая, что СV≠f(T). Тогда
получаем С V lnT+RlnV=const; или, объединяя логарифмы 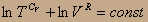

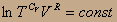
Если постоянен логарифм, то постоянна и функция пол логарифмом, т.е.
Заменяя температуру из уравнения идеального газа, получим PV=RT; 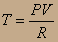


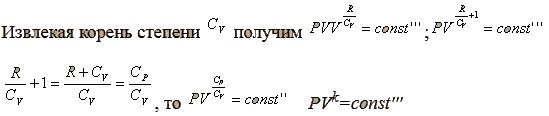
Билет №35. Закон Гесса и его следствия. Тепловые эффекты химических процессов. Теплоты образования и сгорания веществ. Теплота растворения.
Закон Гесса
Основным в термохимии является понятие теплового эффекта. О нём недостаточно сказать, что это теплота, выделяющаяся или поглощающаяся при химической реакции. Последнее верно при соблюдении следующих условий:
|
|
1. Объём или давление постоянны (P=const и V=const)
2. Не совершается никакой работы, кроме возможной при P=const работы расширения
3. Температура продуктов реакции равна температуре исходных веществ. При этих условиях тепловой эффект становится величиной, наиболее определённой и зависящей только от характера протекающей химической реакции.
В соответствии с условием №1 в термохимии различают тепловые эффекты химических реакций при V=const Q V и при P=const Q P (это рассматривалось ранее)
QV = U 2 - U 1 = ΔU; QP = H 2 - H 1 = ΔH;
U 2 - внутренняя энергия продуктов реакции
U 1 - внутренняя энергия исходных веществ
Эти соотношения показывают, что тепловой эффект является функцией состояния системы в данных условиях.
Энтальпию можно рассматривать как некую "полную энергию", т.е. как сумму внутренней энергии U и "объёмной энергии" PV. Однако наиболее ясно физический смысл Н проявляется в соотношении QP = ΔH; разность энтальпий в двух состояниях системы равна тепловому эффекту изобарного процесса. Выведенные соотношения позволяют сформулировать основной закон термохимии - закон Гесса: тепловой эффект химической реакции при V=const или P=const не зависит от пути хода реакции, т.е. от промежуточных стадий, и определяется только родом начальных и конечных веществ и их состоянием (1836 г). Гесс установил этот закон экспериментально ещё до окончательной формулировки первого начала термодинамики.
Закон Гесса позволяет определять тепловые эффекты реакций, которые или невозможно измерить непосредственно, или по каким-либо причинам не были измерены.Закон Гесса позволяет обращаться с термохимическими уравнениями, как с алгебраическими, т.е. складывать и вычитать их, если только тепловые эффекты относятся к одинаковым условиям.Такие расчеты для теплот образования,теплот сгорания часто называют следствия из закона Гесса.
 ЭТО МАЛО И НЕСЕРЬЕЗНО. НОРМ ИНФА В МЕТОДЧКЕ ЛЕВЧЕНКОВА «1-Е НАЧАЛО ТЕРМОДИНАМИКИ.
ЭТО МАЛО И НЕСЕРЬЕЗНО. НОРМ ИНФА В МЕТОДЧКЕ ЛЕВЧЕНКОВА «1-Е НАЧАЛО ТЕРМОДИНАМИКИ.
Билеты №9,14,20.Зависимость теплового эффекта химической реакции от температуры (закон Кирхгоффа). Приближения закона Кирхгоффа
|
|
Закон Кирхгоффа
Его вывод практически идентичен указанному в методичке, поэтому приведу тут только приближения.
Для вычисления интегралов необходимо знать зависимость С P =f(T). Поэтому формулу Кирхгоффа применяют в трёх приближениях.
В первом, наиболее грубом приближении, полагают ΔC P =0, т.е. считают равными суммарные теплоёмкости продуктов и исходных веществ. Поэтому получаем  тепловой эффект процесса не зависит от температуры.
тепловой эффект процесса не зависит от температуры.
Во втором, более точном приближении, считают Δ CP = const ≠ f (T)
Тогда получаем Δ HT = ΔCPT + ΔHy, где ΔHy - константа интегрирования
Пример: проведём расчёт во втором приближении зависимости ΔH =f(T) для реакции превращения СН4 в С2Н4: 2СН4→ С2Н4 + 2Н2
Значения ΔH обр (СН4,С2Н4) можно взять из табл., ΔH обр (Н2)=0 (простое вещество), тогда по следствию из закона Гесса:
ΔH х. p. = ΔH обр. С2H4 -2 ΔH обр. СН4 = 48300 кал/моль.
Также из таблиц находят значения стандартных теплоёмкостей при Т=298,15 К:
На основании этих данных можно записать изменение теплоёмкости:
Δ Ср=9,87+2·6,90-2·8,60=6,47кал/град
Поэтому, зная = 48300, можно рассчитать константу интегрирования ΔHJ: ΔHJ =48300-6,47·298,15=46370;
Отсюда получаем окончательно формулу второго приближения: ΔHT = 46370+6,47Т;
В третьем, наиболее точном приближении использования формулы Кирхгоффа учитывают зависимость Δ С P = f(T).
Следует заметить, что теоретический расчет теплоёмкости, особенно для газов и жидкостей,не всегда возможен и весьма трудоемок. Поэтому наиболее надёжный путь до настоящего времени состоит в использовании эмпирических формул. Экспериментальные значения теплоёмкостей при различных температурах стараются охватить степенным температурным рядом, причём в зависимости от желаемой степени точности используют ряды с различным числом членов, т.е.
С P = a + b Т+сТ2+...
Например, для Н2 и СН4:
, H 2 =6,9469-0,1999·10-3Т+0,4808·10-6Т2 (кал/град·моль)
, CH 4 =3,422+17,845·10-3Т+4,165·10-6Т2 (кал/град·моль)
Следовательно, Δ CP =Δа+ΔвТ+ΔсТ2+...
Где, например, Δа является следующей алгебраической суммой, записываемой с учётом коэффициентов химического уравнения: 
Поэтому после подстановки Δ С P = f(T) в формулу Кирхгоффа, получаем расчётную формулу третьего приближения: 
 Здесь, как и ранее, ΔHJ - постоянная, которую чаще всего определяют из известного ΔH 298.
Здесь, как и ранее, ΔHJ - постоянная, которую чаще всего определяют из известного ΔH 298.
|
|
|

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!