В основе всех вычислений изменения энтропии в равновесных процессах лежит соотношение  или
или 
a). Рассмотрим сначала нагревание веществ. Если оно происходит при V=const, то  , при P=const
, при P=const 
Тогда  Если положить, что
Если положить, что  ,то
,то  Из полученных выражений следует, что при нагревании тела его энтропия всегда увеличивается.
Из полученных выражений следует, что при нагревании тела его энтропия всегда увеличивается.
б). Рассмотрим некоторые изотермические процессы. При постоянной температуре протекают различные процессы так называемых фазовых превращений 1-го рода: плавления, испарения, возгонки, превращения кристаллических модификаций.
Тогда  где
где  - теплота изотермического процесса. Если фазовое превращение протекает при Р=const, то
- теплота изотермического процесса. Если фазовое превращение протекает при Р=const, то  и
и 
Надлежит понять и запомнить, что, поскольку при фазовых переходах: плавлении, испарении, возгонке - теплота поглощается, т.е., все они связаны с увеличением энтропии. В связи с фазовыми переходами полезно обратить внимание на закономерность, носящую название правила Трутона: мольное увеличение энтропии в процессе парообразования при нормальной температуре кипения (Р=1 атм) примерно одинаково для различных жидкостей и равно 21-22 э.е.
Обратимся теперь к энтропии идеального газа, выразив её в виде функции Т,V и Р, предполагая равновесные процессы изменения состояния. Запишем объединённую формулу 1-го и 2-го начал термодинамики:  , следовательно,
, следовательно,  . Поскольку
. Поскольку  , то
, то

Интегрируем последнее выражение, считая, 


Если Т1=Т2, то
 Следовательно, в процессе изотермического расширения идеального газа энтропия возрастает.
Следовательно, в процессе изотермического расширения идеального газа энтропия возрастает.
Билеты № 7,31,34.Постулат Планка. Абсолютные значения энтропии.
Постулат Планка. Абсолютные значения энтропии
По приведённым выше уравнениям невозможно вычислить абсолютные значения энтропии системы. Такую возможность даёт новое, недоказуемое положение, не вытекающее из двух законов термодинамики, которое было сформулировано Планком:
Энтропия индивидуального кристаллического вещества при абсолютном нуле равна нулю: S0=0
Постулат Планка справедлив только для индивидуальных веществ, кристаллы которых идеально построены (в кристаллической решётке все узлы заняты молекулами или атомами, правильно чередующимися и закономерно ориентированными). Такие кристаллы называются идеально твёрдыми телами. Реальные кристаллы не являются таковыми, т.к. их кристаллическая решётка построена не идеально.
 Энтропия кристаллической решётки, построенной в некоторой степени беспорядочно, больше энтропии идеально построенной кристаллической решётки. Поэтому реальные кристаллы и при 0 К обладают энтропией, большей нуля. Однако энтропии реальных хорошо образованных кристаллов индивидуальных веществ при абсолютном нуле невелики.
Энтропия кристаллической решётки, построенной в некоторой степени беспорядочно, больше энтропии идеально построенной кристаллической решётки. Поэтому реальные кристаллы и при 0 К обладают энтропией, большей нуля. Однако энтропии реальных хорошо образованных кристаллов индивидуальных веществ при абсолютном нуле невелики.
В соответствии с постулатом Планка получаем выражение (18):
Как видно из последнего выражения, если бы теплоёмкость сохраняла конечное значение до абсолютного нуля, то при охлаждении до 0 К подынтегральная функция, а следовательно, и энтропия, должна была бы увеличиваться до бесконечности. Очевидно,S0=0 может иметь место лишь потому, что теплоёмкости кристаллических веществ стремятся, как это установлено экспериментально, к 0 при приближении Т->0K. Теплоёмкость изменяется пропорционально некоторой степени температуры выше первой (для многих кристаллических веществ – пропорционально T3)
Постулат Планка используется при термодинамическом исследовании
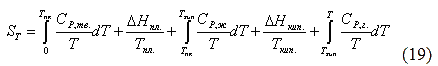 химических процессов для вычисления абсолютных значений энтропий (т.н. абсолютных энтропий) химических соединений - величин, которые имеют большое значение при расчёте химических равновесий. При этом абсолютная энтропия рассчитывается по уравнению (18). Для вычисления необходимо знать экспериментальные значения теплоёмкости, определённые до возможно более низких температур - до 10 К. Значение теплоёмкости до 0 К находят путём экстраполяции.
химических процессов для вычисления абсолютных значений энтропий (т.н. абсолютных энтропий) химических соединений - величин, которые имеют большое значение при расчёте химических равновесий. При этом абсолютная энтропия рассчитывается по уравнению (18). Для вычисления необходимо знать экспериментальные значения теплоёмкости, определённые до возможно более низких температур - до 10 К. Значение теплоёмкости до 0 К находят путём экстраполяции.
Интегральные члены уравнения (19) находят графическим интегрированием. Для этого строят кривые  и численное значение интеграла определяют по величине площади, ограниченной кривой и осью абсцисс, заключёнными между соответствующими температурами:
и численное значение интеграла определяют по величине площади, ограниченной кривой и осью абсцисс, заключёнными между соответствующими температурами:

 Энтропии веществ могут быть найдены и другим методом – путём квантово-статистического расчёта.
Энтропии веществ могут быть найдены и другим методом – путём квантово-статистического расчёта.
Билеты № 4,24,39,47. Применение первого и второго начал термодинамики к химическим системам Изохорно-изотермический и изобарно-изотермический потенциалы.



 или
или 
 , при P=const
, при P=const 
 Если положить, что
Если положить, что  ,то
,то  Из полученных выражений следует, что при нагревании тела его энтропия всегда увеличивается.
Из полученных выражений следует, что при нагревании тела его энтропия всегда увеличивается. где
где  - теплота изотермического процесса. Если фазовое превращение протекает при Р=const, то
- теплота изотермического процесса. Если фазовое превращение протекает при Р=const, то  и
и 
 , следовательно,
, следовательно,  . Поскольку
. Поскольку  , то
, то



 Следовательно, в процессе изотермического расширения идеального газа энтропия возрастает.
Следовательно, в процессе изотермического расширения идеального газа энтропия возрастает. Энтропия кристаллической решётки, построенной в некоторой степени беспорядочно, больше энтропии идеально построенной кристаллической решётки. Поэтому реальные кристаллы и при 0 К обладают энтропией, большей нуля. Однако энтропии реальных хорошо образованных кристаллов индивидуальных веществ при абсолютном нуле невелики.
Энтропия кристаллической решётки, построенной в некоторой степени беспорядочно, больше энтропии идеально построенной кристаллической решётки. Поэтому реальные кристаллы и при 0 К обладают энтропией, большей нуля. Однако энтропии реальных хорошо образованных кристаллов индивидуальных веществ при абсолютном нуле невелики.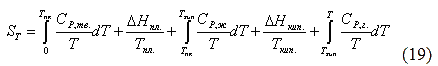 химических процессов для вычисления абсолютных значений энтропий (т.н. абсолютных энтропий) химических соединений - величин, которые имеют большое значение при расчёте химических равновесий. При этом абсолютная энтропия рассчитывается по уравнению (18). Для вычисления необходимо знать экспериментальные значения теплоёмкости, определённые до возможно более низких температур - до 10 К. Значение теплоёмкости до 0 К находят путём экстраполяции.
химических процессов для вычисления абсолютных значений энтропий (т.н. абсолютных энтропий) химических соединений - величин, которые имеют большое значение при расчёте химических равновесий. При этом абсолютная энтропия рассчитывается по уравнению (18). Для вычисления необходимо знать экспериментальные значения теплоёмкости, определённые до возможно более низких температур - до 10 К. Значение теплоёмкости до 0 К находят путём экстраполяции. и численное значение интеграла определяют по величине площади, ограниченной кривой и осью абсцисс, заключёнными между соответствующими температурами:
и численное значение интеграла определяют по величине площади, ограниченной кривой и осью абсцисс, заключёнными между соответствующими температурами:
 Энтропии веществ могут быть найдены и другим методом – путём квантово-статистического расчёта.
Энтропии веществ могут быть найдены и другим методом – путём квантово-статистического расчёта.


